从火热回归理性,肠道菌群能否成为医学突破前夜的火花
2021-04-19 “科技导报”公众号 “科技导报”公众号
肠道菌群作为寄居在人体肠道内微生物群落的总称,是近年来微生物学、医学、生命科学等领域最引人关注的研究焦点之一。
肠道菌群作为寄居在人体肠道内微生物群落的总称,是近年来微生物学、医学、生命科学等领域最引人关注的研究焦点之一。
学界大约在十余年前开始关注肠道菌群领域,在2016年左右出现过一次热潮。
2019-2020年随着新冠疫情的爆发,人们意识到需要重新思考如何处理好微生物与人类的关系,又将大家对肠道菌群和病毒等微生物的关注度有所提高。
随着对慢病的深入研究,肠道菌群的重要性将会越来越凸显出来。但同时,围绕肠道菌群的争议也时常出现。
由此,《科技导报》新媒体就此问题专访了北京中医药大学生命科学学院研究员张成岗,本文对他的观点进行了梳理。
肠道菌群微生态同免疫力息息相关
一方面,肠道菌群有食物消化和营养吸收的作用;另一方面,肠道菌群能够刺激免疫系统,帮助人体形成良好的免疫防御机制,表现为免疫力的增强和提升,对病毒感染具有抵抗力,同时对病原菌也能够形成抵抗力。
胎儿出生后,在人体与肠道菌群终生共生的过程中,有益于健康的肠道菌群不仅能够刺激人体免疫系统的正常发育,而且也被人体免疫系统正确识别为“好的菌群”,这些菌群与人体胃肠道黏膜拥有良好的共生状态,互惠互利、合作共赢。
而其他导致人体生病的微生物则被人体免疫系统识别为“坏的菌群”,会被免疫系统攻击和清除。
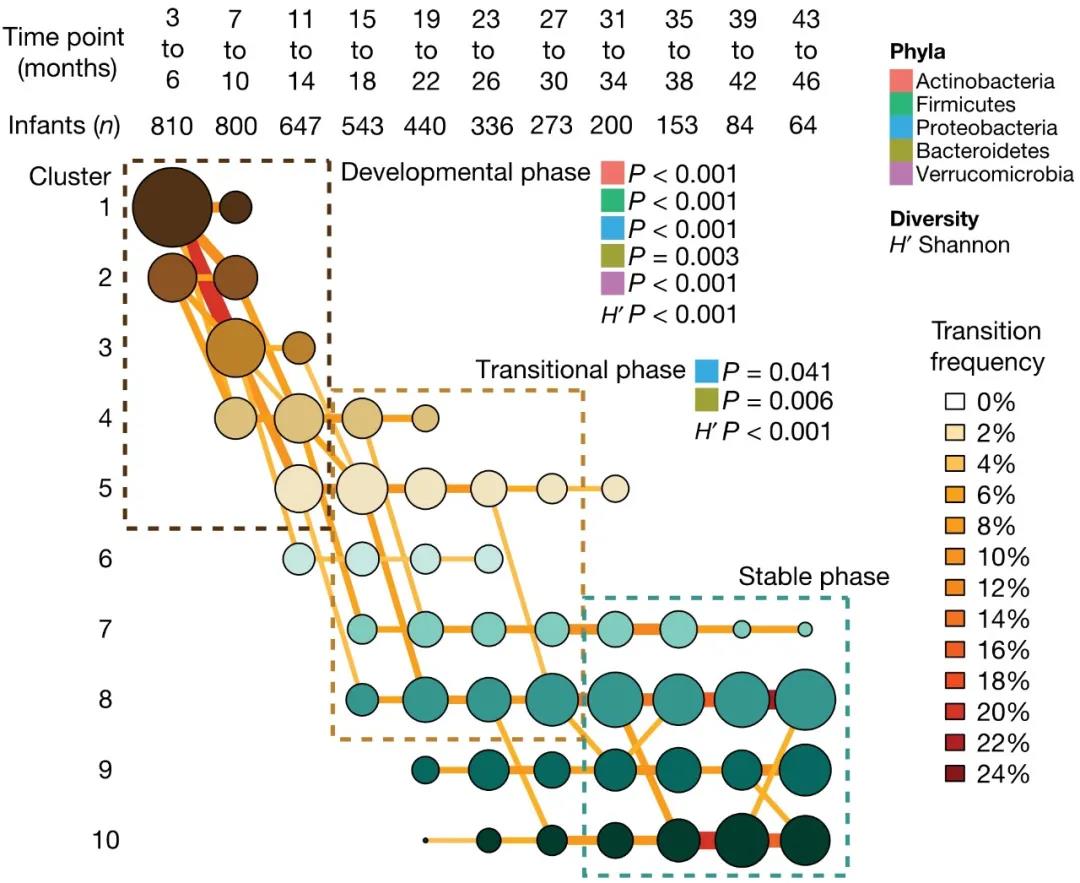
婴儿的肠道菌群生长可以分为三个阶段 来源:Nature
拟杆菌门(Bacteroidetes)及厚壁菌门(Firmicutes)是人类肠道内的优势有益菌。
存在于脆弱拟杆菌等肠道共生菌外膜上的部分分子,可有效刺激驻留在结肠壁上的免疫细胞,通过启动免疫保护信号级联机制,激活免疫保护信号通路,诱导结肠中的免疫细胞释放干扰素-β(IFN-β),干扰病毒RNA或DNA复制而抑制病毒生长,从而保护机体免受病毒感染,同时还能刺激免疫细胞并增强其杀伤力,诱导已感染病毒的细胞的自我毁灭。
拟杆菌属的多种细菌均可启动类似的免疫级联反应,发挥保护人体健康的作用。
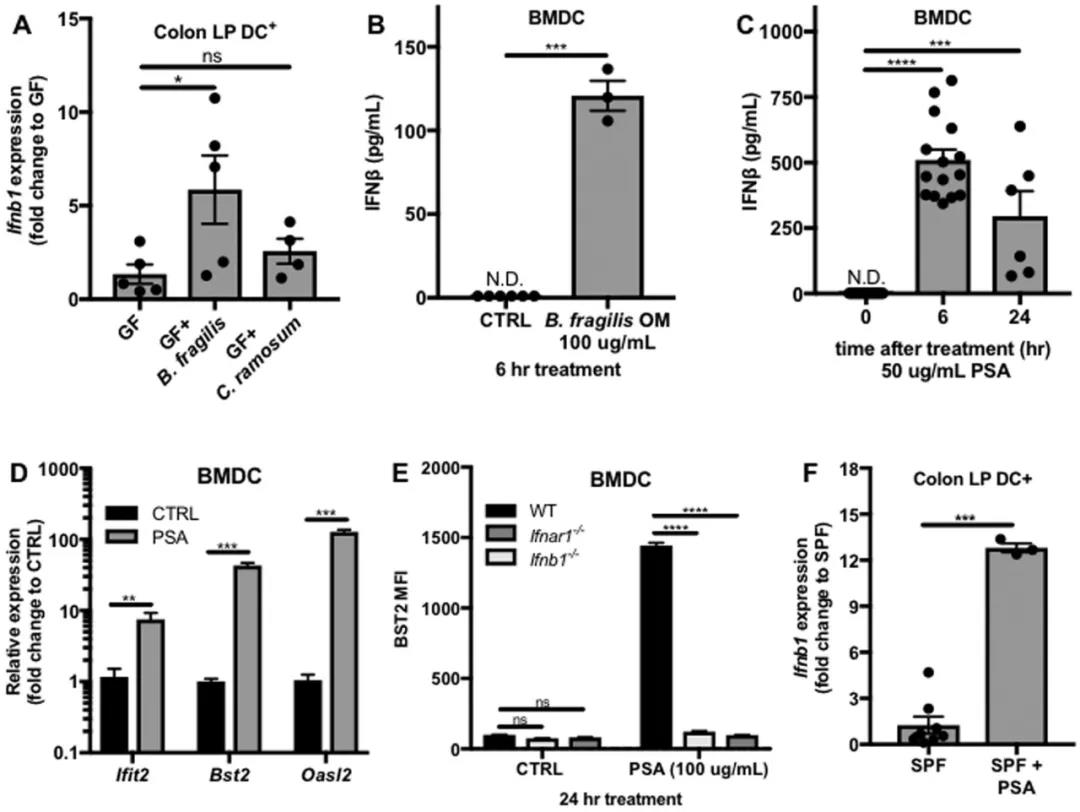
脆弱拟杆菌的外膜表面的PSA分子可以诱导IFN-β的分泌 来源:Cell
良好的肠道菌群微生态能够促进人体具有和维持良好的免疫力,形成有效的免疫防御机制,抵御病毒感染,保护人体健康。
而滥用抗生素则往往会导致好菌群和坏菌群都被破坏,从而严重影响肠道菌群微生态的平衡状态,进而影响人体免疫力,导致免疫力下降,抵抗力变差,容易生病如过敏等。
肠道菌群影响新冠症状
正如前文所说,有大量研究表明肠道微生物在调节机体免疫中发挥着重要作用,肠道菌群的变化与局部和全身炎症密切相关,而COVID-19患者的典型临床表现就是肺炎和细胞因子风暴。
同时,有研究证实患者往往存在胃肠道症状和肠道菌群失调的情况,且在重症患者的粪便样本中能够检测到新冠病毒的RNA。

用于预测重症新冠肺炎的血液蛋白组生物标志物风险评分(PRS) 来源:medRxiv
2021年初,在香港中文大学的研究人员发表于《消化道》(Gut)的论文中发现,肠道中细菌的种类和数量可能会影响COVID-19的严重程度以及免疫系统对感染的反应程度,微生物组组成的失衡可能与患者持续的炎症症状有关。
通过对粪便样本分析发现,不论是否接受过包括抗生素在内的药物治疗,COVID-19患者同非COVID-19受试者的肠道微生物组之间都存在显着差异,说明肠道菌群可能会影响免疫系统对新冠病毒感染的反应,甚至影响疾病的严重程度和结果。
换言之,失调、紊乱的肠道菌群可能会导致患者在感染新冠病毒以后,持续引发免疫相关的健康问题。

COVID-19与非COVID-19受试者之间肠道菌群的组成差异 来源:Gut
2020年2月4日,在国家卫健委与国家中医药管理局公布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》中指出“可使用肠道微生态调节剂,维持肠道微生态平衡,预防继发细菌感染”。

来源:国家卫生健康委员会官方微信“健康中国”
微生态制剂是利用对宿主有益的正常微生物或其促进物质制备而成,具有维持或调整微生态平衡、防治疾病和增进宿主健康的作用,目前多项研究均肯定了微生态制剂在临床不同领域的应用。目前临床使用最为广泛的微生态制剂是各类益生菌。
李兰娟院士在“四抗二平衡”(抗病毒、抗低氧血症、抗休克、抗继发感染,以及维持水电解质平衡、微生态平衡)的治疗建议中,也明确指出了应用微生态制剂让肠道菌群保持平衡在提高患者的免疫力、预防二次感染中的重要性。
维持和确保肠道菌群的健康状态,对于疫情防控以及治疗新冠患者具有重要意义,对于今后其他传染病的防控有促进作用,尤其是当肠道菌群中以有益菌为主、通过占位效应保护胃肠道黏膜之后,病原微生物引发传染病的风险就能够有所降低。
需要强调的是,尽管已有较多证据表明微生态制剂可以帮助COVID-19患者(特别是重症患者)预防继发感染、调节菌群紊乱、提高免疫功能,但至今尚不清楚微生态制剂是否对新型冠状病毒有直接作用。
另类却管用的粪菌移植
粪菌移植(Fecal microbiota transplantation,FMT)为溃疡性结肠炎、代谢综合征、免疫疾病、精神疾病等的治疗提供了虽然有些另类、然而却管用的选择,目前已用于肝性脑病、难治性移植物抗宿主病、慢性功能性便秘和肠易激综合征等的治疗。
FMT治疗的原理和“播种”类似,直接使用健康人群的肠道菌群作为供体,提供给受体患者的肠道,用于纠正患者肠道菌群的失调紊乱,发挥对疾病的治疗作用。
具体操作通常有三种路径:将供体粪菌(菌液形式)通过肠镜导入到小肠的末端;经过上消化道到达到空肠营养管或经鼻空肠管导入患者十二指肠或更远处的小肠;灌肠。目前也有很多公司在尝试做粪菌胶囊。
2019年曾经出现过,由于FMT而导致患者死亡的事故,因此美国FDA对此类应用叫停,要求FMT实施机构增加对供体菌群的质量控制,以免出现向免疫力低下的患者使用粪菌移植后出现菌血症甚至死亡的严重问题。
所以,尽管FMT有一定的成效,但尚未开展广泛的临床应用。
一般来说,需要进行FMT手术的患者,身体状况本身就已经出现问题,包括免疫力不足、抵抗力下降等。
此时,即便向其提供菌群的供体人员自身拥有正常、健康的菌群,但是给患者提供后,在患者肠道中也会和患者的固有菌群以及患者的胃肠道黏膜之间存在一个“固有菌群”与“外来菌群”相互适应的“磨合期”。
如果患者的身体状态还可以,免疫力能够防止“菌群大战”伤及身体;否则就会出现“城门失火,殃及池鱼”的情况,导致患者身体受到伤害。
同时,由于肠道微生态会受到生活方式、饮食习惯以及是否使用抗生素等的影响,如果要巩固FMT的治疗效果,理论上接受FMT治疗的患者需要按照医嘱在生活方式和饮食习惯等方面的积极配合。
在后续研究和临床应用中需要重点考虑的问题是:供体的粪菌并不一定适合于受体,即存在“菌型匹配”的问题。
因此,在开展临床应用的时候,还需要做进一步研究,例如对接受FMT治疗之后的患者需要进行一段时期的跟踪评价,确保健康受益。
肠道菌群为癌症免疫治疗带来新希望
人体具有良好、健康的免疫力是机体对抗肿瘤、提高肿瘤治疗效率的关键。
癌症免疫疗法作为继化疗、手术治疗和放疗后的“第四种疗法”,在近年来受到了越来越多的关注。
目前已有相当多的研究证实了肠道菌群可以通过影响免疫功能改变机体抗肿瘤能力,在肿瘤的免疫治疗中发挥着重要作用。

登上Science封面的“肠道菌群与癌症” 来源:Science
与传统的癌症疗法不同,免疫治疗通过激活或改造人体免疫系统抵抗肿瘤的固有功能,并使其成为攻击癌细胞的有力武器,而这一过程会受到肠道菌群的影响。
不同种类的肠道菌群会产生多种代谢产物,会通过多种分子机制、细胞机制及免疫机制,引发或调控癌症的发生与发展。
肠道菌群对宿主免疫系统的调节会影响癌症治疗过程中的免疫应答,菌群紊乱容易增加癌症风险。
健康的肠道菌群微生态有利于提高肿瘤的免疫治疗效率,而失调紊乱的肠道菌群则会弱化肿瘤的免疫治疗效果,其中部分原因与失调的肠道菌群会增加人体免疫负担,影响免疫治疗效果的充分发挥。
肠道菌群有可能通过影响免疫能力,对常用的肿瘤治疗策略如检查点阻断剂、干细胞移植、放/化疗和细胞疗法的疗效和毒性有一定影响。
近日,美国国立癌症研究所和匹兹堡大学希尔曼癌症中心合作发表于《科学》(Science)的研究,为基于肠道菌群的癌症治疗带来了新的希望。
在该研究中,研究人员招募了对抗PD-1单药、联合抗CTLA-4或其他研究药物的治疗均无应答的黑色素瘤患者,对他们进行粪菌移植(FMT)联合抗PD-1免疫治疗,然后跟踪临床和免疫结果。
结果发现,通过改变肠道微生物组,可以使对免疫疗法无应答的晚期黑色素瘤患者转变为应答者,对相关的药物产生反应。

粪菌移植(FMT)联合抗PD-1免疫治疗晚期黑色素瘤患者的Ⅱ期临床试验方案 来源:Science
这项研究表明,FMT或许可以改善对免疫疗法不敏感的晚期癌症患者的治疗预后,但仍需要进行更多的研究,以确定在此过程中发挥作用的特定微生物,以及其中的生物学机制。
鉴于肠道菌群与人体健康的密切相关性,使用适合于自身的肠道微生态调节剂(如益生元、益生菌、合生元、后生元等)和膳食干预等方法,改善肠道微生态,对提高免疫力、提高癌症治疗效率具有促进作用。
此外,在确实需要的情况下,也可在医生指导下使用粪菌移植等手段提高抗癌疗效。
理性认识肠道菌群研究热潮
由于肠道菌群背后往往夹杂着商业因素等原因,加之其中也有不少的新知识与此前人们的认知不一致,也很容易引起争议,因此需要科学、理性、客观、谨慎看待。
应当说,在肠道菌群领域的研究中,目前尚未到成熟阶段,很多新发现还在不断出现中,在这种情况下,需要确保科学性和严谨性,有一分证据就说一分话,不可夸大,即便是某种与肠道微生态有关的疗法对于这个人适用,也不可随意地推广到给所有人适用,因为科学研究本身是有边界的。
对此,中科院微生物所王军和厦门大学马永慧等联合提出的关于肠道菌群研究的7大事实和5大倡议,值得大家借鉴、参考:
(1)肠道微生物组是科学研究的前沿,其基础研究及应用转化在全球不断发展;
(2)肠道微生物组参与健康和疾病的发生,但肠道菌群失调只是疾病的一个因素;
(3)肠道微生物组研究仍处于起步阶段,存在混乱及利益冲突,但也存在自净和自律机制;
(4)肠道微生物组研究应遵循规范的伦理原则、避免炒作和包装、积极披露利益冲突并提示安全风险问题、遵纪守法并坚持科学循证原则、积极参加科普教育促进公众参与,从而有利于学界和产业界共同努力,促进肠道微生物组研究和产业转化的健康发展。
当然,在肠道菌群十余年来的发展过程中,从火热到理性的回归,也不排除在目前随着大量数据和科学线索日趋增多的情况下,有可能催生形成新的科学假说和理论,或许有可能成为医学突破前夜的火花,促进人类通过更好地调控肠道菌群而走向健康的新纪元。
肠道菌群今后研究重点
近年来国内外实施的一系列微生物组学计划,已经为肠道菌群领域的发展提供了科学、可靠的数据和土壤,预期相关研究重点如下:
(1)构建不同慢病和肠道菌群之间的关联数据库,促进慢病与菌群相关性、甚至因果性证据的进一步积累,促进人们对慢病发生、发展的深刻理解;
(2)研究针对肠道菌群进行调控的新技术、新方法、新产品,提高慢病防控效率;
(3)结合肠道菌群微生态,深入开展中医药研究,促进中医生命科学和中西医结合的研究与发展;
(4)发展肠道菌群微生态的解析技术,不仅在微生物基因组DNA序列组装等方面取得进步,而且还需要从微生态这一群体水平开展从结构到功能的深入研究;
(5)发展肠道菌群的检测技术即针对肠道菌群的健康体检技术,建立起可用于评价肠道菌群是否处于健康状态、亚健康状态、失调紊乱状态甚至致病状态的理论、方法和技术;
(6)构建通过医学检测评估、可用于粪菌移植的“粪菌银行”“粪菌(生物)样本库”,为临床上开展粪菌移植、提高患者慢病治疗效率提供可靠的供体菌群;
(7)从肠道菌群“生态链”的角度出发,深入研究肠道菌群与动物、植物、菌群、噬菌体等的相互作用关系,有可能对生命起源与进化提供新的启发;
(8)鼓励肠道菌群相关领域科技工作者在科学、合理、客观、可靠的研究过程中提出新假说、新模型、新理论,并进行科学研究和实践论证。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肠道菌#
63