NEJM述评:基因编辑系统CRISPR-Cas9终将战胜杜氏肌营养不良症
2016-04-30 MedSci MedSci原创
最新一期新英格兰医学杂志(NEJM)发表了一篇来自斯坦福大学遗传学教授 Michele P. Calos 博士关于热门基因编辑技术 CRISPR-Cas9用于Duchenne's肌营养不良症(DMD)的研究观点文章。 热门基因编辑技术 CRISPR-Cas9 已被用于肌营养不良症、杜氏肌营养不良(DMD)这些疾病模型小鼠的研究当中,三组研究人
最新一期新英格兰医学杂志(NEJM)发表了一篇来自斯坦福大学遗传学教授 Michele P. Calos 博士关于热门基因编辑技术 CRISPR-Cas9用于Duchenne's肌营养不良症(DMD)的研究观点文章。
热门基因编辑技术 CRISPR-Cas9 已被用于肌营养不良症、杜氏肌营养不良(DMD)这些疾病模型小鼠的研究当中,三组研究人员近期分别在 Science 杂志上发表了关于如何使用CRISPR-Cas9 技术移除杜氏肌营养不良(DMD)中的编码肌营养不良蛋白的基因从而影响该蛋白的表达的文章(Science:CRISPR技术进军出生后基因治疗,成功治愈杜氏肌肉营养不良症)(CRISPR/Cas9基因编辑技术快速向疾病治疗方向迈进)。
研究人员使用 CRISPR-Cas9 基因编辑系统剪掉 mdx老鼠模型上的 Dmd 变异部分,从而让在肌纤维中的抗肌萎缩蛋白的较短部分得以合成进而恢复局部肌肉功能(图1)。据认为该方法能够潜在的移除 80% DMD 患者中的疾病变异,虽然它需要掌握每位患者的基因序列水平的变异知识从而制定相应的移除策略。
腺相关病毒(AAV)对于小鼠的肌肉来说是一个高效的基因转递运输工具,但其携带DNA的能力有限(例如,仅能携带延伸小于4.7 kb的DNA),研究人员使用基于腺相关病毒(AAV)的基因治疗载体将 CRISPR-Cas9 的必备部分输送至肌肉中。编码Cas9核酸内切酶(Cas9)的基因被打包成一个AAV载体;Cas9蛋白(一个核酸内切酶)对DNA进行切割。引导RNA(gRNA)序列被打包在不同的AAV颗粒;该gRNAs能引导CRISPR-Cas9蛋白到特定的DNA序列。一旦gRNA已经绑到其同源DNA序列,Cas9核酸内切酶便沿着DNA进行切割。
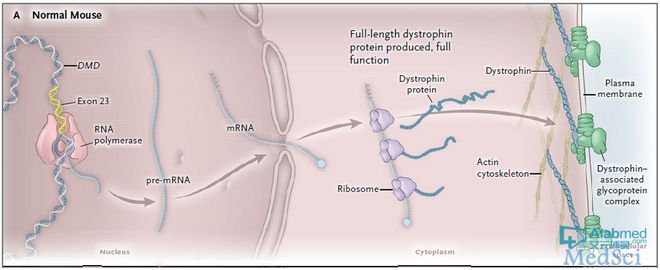
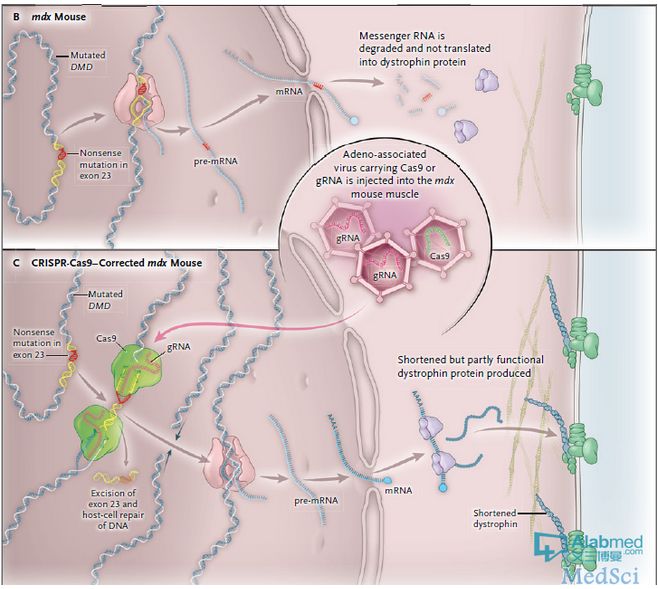
携带着 Dmd 23外显子上的无义突变 AAV 片段被运载进入杜氏肌营养不良mdx老鼠模型中。该变异导致Dmd 信使RNA(mRNA)翻译成蛋白的过程过早的终止并消除了抗肌萎缩蛋白的产生。在基因矫正策略中,gRNAs引导Cas9蛋白切割两个非编码内含子侧翼外显子23(图1)。切割的末端被细胞的内源性非同源末端连接功能重新连接上,从而允许DMD mRNA的阅读框保持不变。抗肌萎缩蛋白照样生成,尽管没有被切除外显子编码的氨基酸。基因矫正的初始效率估计约为2%。但抗肌萎缩蛋白的水平一直在增加,也许是因为持续的修正,自从肌肉纤维的AAV构建仍然持续存在数月。一组研究人员提出的证据表明,基因修正也发生在卫星细胞、肌肉的驻地干细胞。卫星细胞的修正可能是一个有价值的结果,因为纠正的干细胞会持续产生修正纤维。一个采用腺相关病毒(AAV)或电穿孔法(electroporation)引导 CRISPR-Cas9 和 gRNAs(设计为切除DMD的21和23外显子)至 mdx 老鼠的肌肉中的相似研究策略也提供了肌肉功能获得改善的证据。然而,这些基因携带方法要想转化成临床应用恐怕非常困难。
CRISPR-Cas9 跟现有的其他正在发展的办法相比较如何呢?通过对基因组进行改变,达到了对肌肉细胞的永久性修复。这与目前正在临床试验评估中的“外显子跳跃”寡核苷酸的药物相比较。这些寡核苷酸被强制以这样的方式进行选择性剪接,DMD外显子含有的突变拼接出mRNA ,导致截短抗肌萎缩蛋白的合成。但由于外显子跳跃的反应物不改变底层DMD序列,他们必须要经常读取(readministered)。另一种AAV基因治疗方法涉及用截短的“微缩”版DMD。较短的DNA序列装配到AAV载体并被认为在老鼠身上是有效的,虽然合成全链蛋白更为理想。这种策略不需要对宿主细胞基因组中进行操纵,每一个接受AAV-微肌营养不良蛋白的肌肉细胞矢量的产生治疗性蛋白。此外,该策略是通性的,并不需要对每个患者进行定制。然而,通过AAV载体实现的表达预期不会是永久性的,所以抗肌萎缩蛋白的产生可能不如在CRISPR校正肌细胞中那样恒久实现。另外,“微缩”DMD编码抗肌萎缩蛋白相较于由CRISPR-Cas9改良的 DMD 要小,因此在功能上有所折中。
相对于其他已经被提出来的方法而言 CRISPR-Cas9 的障碍包括效率相对低下。Dmd 表达仅在一部分经过治疗的细胞中“获救”。虽然CRISPR-Cas9 的精确度一直在改善,但对于那些不希望被切割的基因组位置仍然存在被无辜切割的风险(切割出现脱靶的风险)。因此,在 CRISPR 系统能够足够安全的进行临床试用申请前还需要进行更多足够的工作进行研究。而且对于 CRISPR-Cas9 如何能被有效的运送至大量受累的DMD肌肉中还存在一个普遍的疑问。AAV 在老鼠中的表现很好,而其在人体组织这复杂的迷宫中是否也能将基因准确无误的进行运载还是未知的。此外,人体针对AAV衣壳、Cas9蛋白和抗肌萎缩蛋白的免疫反应本身就是一个不可忽视的障碍。对于这些问题都可以找到可解决的途径,正如存在可以避免这些问题的途径一样。对付如 DMD 这类棘手的疾病的方法将会越来越多,而这终将预示着未来的成功。
原始出处:
Michele P. Calos.The CRISPR Way to Think about Duchenne’s.N Engl J Med 2016; 374:1684-1686April 28, 2016DOI: 10.1056/NEJMcibr1601383
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肌营养不良#
80
#基因编辑系统#
90
#肌营养不良症#
84
真能战胜?
163
#CRISPR#
68
#CRISPR-Cas9#
0
#Cas9#
62
#CRISPR-Cas#
69
#Cas#
56