【论著】| 食管鳞状细胞癌PD-L1不同抗体免疫组织化学检测的一致性分析
2023-09-20 中国癌症杂志 中国癌症杂志 发表于上海
本研究旨在探讨ESCC手术切除标本中PD-L1不同抗体IHC检测的一致性。
[摘要]
背景与目的:程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)是食管癌免疫治疗应用最广泛的疗效预测生物标志物,准确可靠的PD-L1检测对于筛查免疫治疗的潜在受益者至关重要。本研究旨在探讨食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)患者PD-L1的表达情况以及7种不同克隆号PD-L1抗体免疫组织化学(immunohistochemistry,IHC)检测的一致性,为规范食管癌PD-L1 IHC检测及后续临床研究提供参考。
方法:收集2020年1月—2021年12月复旦大学附属肿瘤医院的146例ESCC手术切除标本,用PD-L1 22C3、SP263、28-8、E1L3N XP、CST E1L3N、BP6099和MXR006 7种克隆号抗体进行染色,并采用联合阳性评分(comprehensive positive score,CPS)、肿瘤细胞比例评分(tumor proportion score,TPS)和免疫细胞评分(immune cell proportion score,IPS)3种评分标准,在不同临界值下对抗体的一致性进行统计学分析。
结果:PD-L1 22C3与两种伴随诊断抗体(SP263、28-8)对比结果显示:CPS临界值为10时,3种抗体之间均一致性较好(Kappa:0.66~0.80);CPS临界值为1时,28-8与22C3、SP263抗体一致性较好(Kappa=0.80、0.65),22C3与SP263一致性一般(Kappa=0.49);TPS临界值为10%和1%时,3种抗体之间均具有很高的一致性(Kappa:0.79~0.89,0.71~0.91)。PD-L1 22C3与4种国产抗体(E1L3N XP、CST E1L3N、BP6099、MXR006)对比结果显示:CPS临界值为10和TPS临界值为10%时,5种抗体之间均一致性较好(Kappa:0.67~0.88,0.65~0.79);CPS临界值为1时,5种抗体之间一致性较好或一般(Kappa:0.58~0.88);TPS临界值为1%时,5种抗体之间均一致性很好(Kappa:0.85~0.92);IPS临界值为1%和10%时,5种抗体之间一致性一般或较差(Kappa:0.46~0.66,0.30~0.62)。
结论:PD-L1 22C3与两种伴随诊断抗体(SP263、28-8)在CPS和TPS中一致性较好;PD-L1 22C3与4种国产抗体(E1L3N XP、CST E1L3N、BP6099、MXR006)在CPS和TPS中一致性较好,而采用IPS时不同克隆号抗体的一致性较差。这些抗体之间具有一定的可互换性,可为食管鳞状细胞癌PD-L1临床检测提供更多选择。
[关键词] 食管鳞状细胞癌;程序性死亡[蛋白]配体-1;免疫组织化学;一致性分析
中国是食管癌高发的国家,约占世界每年新发病例的一半,尤其是男性患者,发病率和死亡率分别位于第5位和第4位。其中最主要的组织学类型是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC),约占总体食管癌的90%[1-2]。食管癌预后较差,目前可选择的治疗方式有限。程序性死亡[蛋白]配体-1 (programmed death ligand-1,PD-L1)在许多类型的细胞中表达,包括胎盘细胞、血管内皮细胞、T细胞、树突状细胞及巨噬细胞。而PD-L1在肿瘤细胞表面的表达则成为了肿瘤逃脱免疫细胞促成肿瘤生长的驱动因素[3]。通过靶向程序性死亡[蛋白]-1(programmed death-1,PD-1)或PD-L1进行抗肿瘤的免疫治疗可使包括ESCC在内的多种肿瘤患者获益。在ESCC中研究最多的PD-1/PD-L1抑制剂主要有帕博利珠单抗、卡瑞利珠单抗、纳武单抗、特瑞普利单抗、替雷利珠单抗及阿特珠单抗等,这些药物的临床试验已初步显示出良好的疗效。
PD-L1是食管癌免疫治疗应用最广泛的疗效预测生物标志物,准确可靠的PD-L1免疫组织化学(immunohistochemistry,IHC)检测对于筛查免疫治疗的潜在受益者至关重要。美国食品药品管理局(Food and Drug Administration,FDA)已批准PD-L1 22C3的IHC抗体采用联合阳性评分(comprehensive positive score,CPS)评估PD-L1表达状态,用于指导ESCC患者能否接受KEYTRUDA二线治疗的伴随诊断。KEYNOTE-181研究[4]结果显示,肿瘤组织PD-L1 CPS≥10的复发性或转移性ESCC患者中,与化疗相比,抗PD-1治疗的人群总生存期(overall survival,OS)更长、死亡风险更低。如今国际上普遍认可的PD-L1 IHC检测抗体克隆号包括22C3、28-8和SP263等,国内也有多种PD-L1 IHC抗体,包括E1L3N XP、CST E1L3N、BP6099和MXR006等克隆号。不同PD-L1检测中使用的抗体、检测平台、判读标准和相应的阳性阈值不同,同一实验室不可能针对不同PD-L1抗体同时开展多个平台检测,但不同检测方法的结果可能导致不一致的治疗选择。目前针对食管癌不同PD-L1抗体一致性的研究非常有限,因此需要在中国人群中对多种PD-L1检测方法进行一致性评估。本研究旨在探讨ESCC手术切除标本中PD-L1不同抗体IHC检测的一致性。
1 资料和方法
1.1 临床资料
收集2020年1月—2021年12月于复旦大学附属肿瘤医院行ESCC手术切除并经病理学检查确诊的标本,共计146例。其中78例标本进行PD-L1 22C3与两种伴随诊断抗体(SP263和28-8)染色,其余68例标本进行PD-L1 22C3与4种国产抗体(E1L3N XP、CST E1L3N、BP6099、MXR006)染色。
1.2 标本处理及染色
所有标本均经4%中性缓冲甲醛溶液固定,常规脱水,石蜡包埋,4 μm切片,H-E染色和IHC染色。每张切片需经病理学评估确认活肿瘤细胞数目不低于100个/张。本研究PD-L1 IHC染色的所有步骤均由全自动IHC染色系统自动完成,根据说明书要求,每轮检测过程中应同时进行组织质控,且每例标本应平行进行阴性试剂质控的染色,同时每例标本应进行H-E染色以辅助标本的PD-L1判读,每张PD-L1 IHC染色的载玻片上均应检测到PD-L1对照组织(扁桃体组织)呈阳性。
所有入组的146例标本均经过Dako PD-L1 IHC 22C3 pharmDx抗体检测,采用Autostainer Link 48全自动IHC染色系统染色。其中78例标本经过两种伴随诊断抗体试剂染色:VENTANA PD-L1 SP263抗体采用BenchMark ULTRA全自动IHC染色系统染色;Dako PD-L1 IHC 28-8 pharmDx抗体采用Autostainer Link 48全自动IHC染色系统染色。其余68例标本均经过4种国产抗体试剂染色:AmoyDx PD-L1 E1L3N XP抗体、 Biolynx PD-L1 BP6099抗体和MEDx PD-L1 CST E1L3N抗体采用Leica BOND-MAX/Ⅲ全自动IHC染色系统染色;MXB PD-L1 MXR003 抗体采用MXB Lumatas自动化染色系统染色。
1.3 结果判读
进行PD-L1 22C3与两种伴随诊断克隆号抗体(SP263和28-8)染色的78例标本,每张病理切片的PD-L1表达分别进行CPS和肿瘤细胞比例评分(tumor proportion score,TPS);进行PD-L1 22C3与4种国产抗体(E1L3N XP、CST E1L3N、BP6099、MXR006)染色的68例标本,每张病理切片的PD-L1表达分别进行CPS、TPS和免疫细胞评分(immune cell proportion score,IPS)。
所有判读均由两名经验丰富的病理科医师(已获得Targo培训认证并成为中国PD-L1评分培训师)在盲法下进行,结合H-E染色和PD-L1 IHC染色的情况判读评分,有分歧的病例经过讨论后达成一致。评分标准如下:CPS为任何强度PD-L1膜染色的肿瘤细胞和肿瘤相关免疫细胞占所有肿瘤总数的百分比乘以100(1~100),最大值为100;TPS为任何强度PD-L1膜染色的肿瘤细胞占所有肿瘤细胞总数的百分比(0%~100%);IPS为任何强度PD-L1膜染色的免疫细胞占所有免疫细胞总数的百分比(0%~100%)。
1.4 统计学处理
所有统计分析均使用SPSS 26.0和GraphPad Prism 9.0软件进行。采用Kappa检验分析CPS、TPS和IPS之间的一致性,一致性程度分类如下:Kappa值<0.20,很差;0.21~0.40,较差;0.41~0.60,一般;0.61~0.80,较好;0.81~1.00,很好。
2 结 果
2.1 ESCC使用不同抗体在不同判读标准下的PD-L1阳性率
所有146例标本均按照CPS阳性临界值为1和10、TPS阳性临界值为1%和10%进行判读,不同抗体在不同CPS或TPS临界值判读下阳性率有所差别。
22C3、SP263和28-8抗体在78例标本中染色结果如表1所示,CPS临界值为10时,SP263阳性率最高(52.6%),22C3阳性率最低(48.7%);CPS临界值为1时,SP263阳性率最高(93.6%),22C3阳性率最低(87.2%);TPS临界值为10时,SP263阳性率最高(35.9%),22C3阳性率最低(32.1%);TPS临界值为1时, SP263阳性率最高(61.5%),22C3阳性率最低(52.6%)。各抗体具体染色情况如图1所示。
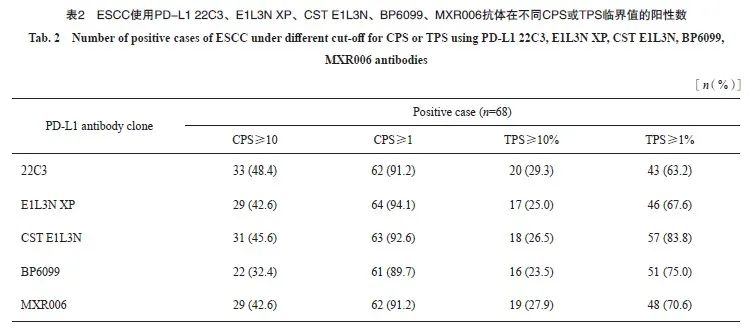
22C3、E1L3N XP、CST E1L3N、BP6099和MXR006抗体在68例标本中染色结果如表2所示,CPS临界值为10时,22C3阳性率最高(48.4%),BP6099阳性率最低(32.4%);CPS临界值为1时,E1L3N XP阳性率最高(94.1%),BP6099阳性率为最低(89.7%);TPS临界值为10时,22C3阳性率最高(29.3%),BP6099阳性率最低(23.5%);TPS临界值为1时,CST E1L3N阳性率最高(83.8%),22C3阳性率最低(63.2%)。

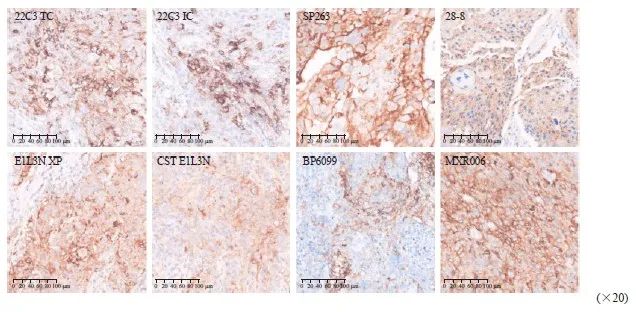
图1 PD-L1 22C3、SP263、28-8、E1L3N XP、CST E1L3N、BP6099和MXR006抗体在ESCC中不同程度的染色结果
Fig. 1 Different degrees of staining using PD-L1 22C3, SP263, 28-8, E1L3N XP, CST E1L3N, BP6099 and MXR006 antibodies in ESCC
2.2 ESCC中PD-L1 22C3与SP263、28-8抗体检测的一致性分析
按照CPS阳性临界值为1和10、TPS阳性临界值为1%和10%进行判读分层。比较22C3与SP263、28-8抗体间检测结果的一致性,根据Kappa值绘制热图,CPS临界值为10时,3种抗体之间均一致性较好(Kappa:0.66~0.80);CPS临界值为1时,28-8与22C3、SP263抗体一致性较好(Kappa=0.80、0.65),22C3与SP263一致性一般(Kappa=0.49)。TPS临界值为10%和1%时,3种抗体之间均具有很高的一致性(Kappa:0.79~0.89,0.71~0.91),详见表3和图2。
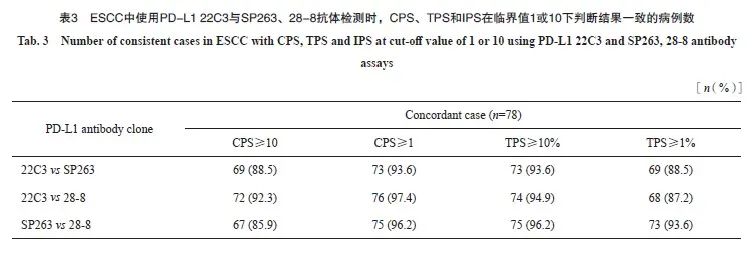
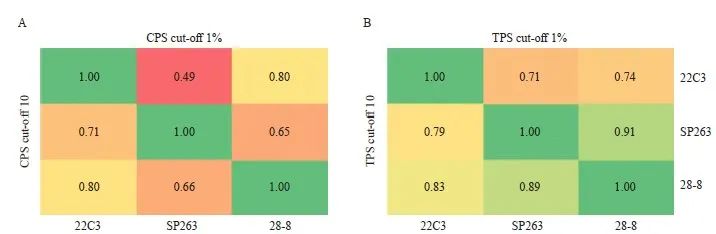
图 2 ESCC中使用PD-L1 22C3、SP263和28-8抗体检测时,CPS(A)和TPS(B)分别在临界值1和10下的判读结果
Fig. 2 Interpretation results of CPS (A) and TPS (B) at cut-off 1 and 10, respectively, using PD-L1 22C3, SP263 and 28-8 antibodies in ESCC
The agreement between CPS and TPS was analyzed by Kappa test.
2.3 ESCC中PD-L1 22C3与4种国产抗体检测的一致性分析
进行PD-L1 22C3与4种国产抗体(E1L3N XP、CST E1L3N、BP6099、MXR006)染色的68例标本的判读结果如图3所示。以22C3判读结果递增为趋势排列,根据两名病理科医师各病例CPS、TPS和IPS判读结果平均值绘制散点图及拟合曲线,从而显示各抗体之间的一般关系。TPS和CPS中5种抗体一致性较好,而IPS中差异较大(图3A~3C)。根据判读结果绘制多组多变量分布图,比较各抗体在CPS、TPS和IPS中的结果分布及其中位数情况。TPS中差异不大,而IPS和CPS中差异较大,均为BP6099最低,22C3中最高(图3D)。
按照CPS阳性临界值为1和10、TPS阳性临界值为1%和10%、IPS阳性临界值为1%和10%进行判读分层。比较22C3与E1L3N XP、CST E1L3N、BP6099、MXR006抗体间检测结果的一致性,根据Kappa值绘制热图,CPS临界值为10时,5种抗体之间均一致性较好(Kappa:0.67~0.88);CPS临界值为1时,5种抗体之间一致性较好,部分一致性一般(Kappa:0.58~0.88)。TPS临界值为10%时,5种抗体之间均一致性很好(Kappa:0.85~0.92),TPS临界值为1%时,5种抗体之间均一致性较好(Kappa:0.65~0.79)。IPS临界值为10%时,5种抗体之间一致性一般,部分一致性较差(Kappa:0.30~0.62),IPS临界值为1%时,5种抗体之间均一致性一般(Kappa:0.46~0.66),详见表4和图4。

图3 ESCC中使用PD-L1 22C3与4种国产抗体在3种评分系统下的判读结果比较
Fig. 3 Comparison of interpretation results in ESCC using PD-L1 22C3 with four domestic clone number antibodies under three scoring systems
A-C: Comparison of CPS, TPS and IPS interpretation results using PD-L1 22C3, E1L3N XP, CST E1L3N, BP6099 and MXR006 antibodies in each case. D: Distribution and median comparison of CPS, TPS and IPS interpretation results using PD-L1 22C3, E1L3N XP, CST E1L3N, BP6099 and MXR006 antibodies in 68 cases.
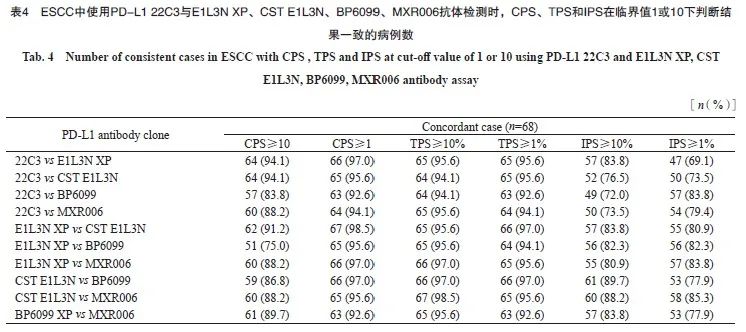
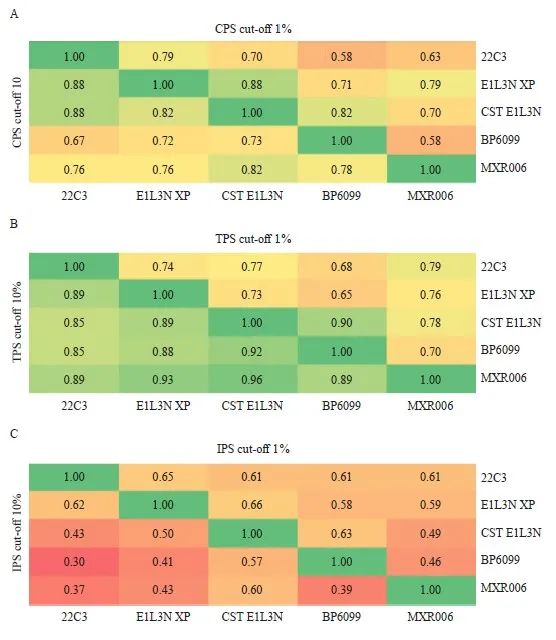
图4 ESCC中使用PD-L1 22C3、E1L3N XP、CST E1L3N、BP6099和MXR006抗体检测时,CPS(A)、TPS(B)和IPS(C)分别在临界值1和10下的判读结果
Fig. 4 Interpretation results of CPS (A), TPS (B) and IPS (C) at cut-off 1 and 10, respectively, using PD-L1 22C3, E1L3N XP, CST E1L3N, BP6099 and MXR006 antibodies in ESCC
The agreement between CPS, TPS and IPS was analyzed by Kappa test.
3 讨 论
PD-L1表达与食管癌免疫治疗效果显著相关,可作为筛选免疫治疗潜在获益人群的生物标志物。近期一项中国食管癌PD-L1研究[5]显示,533例食管癌患者中有240例(45%)患者的PD-L1表达为阳性(CPS≥10),而293例(55%)患者的PD-L1表达为阴性(CPS<10)。与其他组织学类型相比,在ESCC(46.8%)中PD-L1阳性率更高,而腺癌(15.4%)和神经内分泌肿瘤(33.3%)较低。一篇以亚洲人ESCC数据为主的meta分析[6]显示, PD-L1阳性率为18.4%~82.8%,即使判读标准同为TPS≥1%时,部分研究中PD-L1阳性率仅为33.5%,而一些研究中却高达80.8%。上述数据表明,不同研究采用的抗体和判读标准不一致,可能导致PD-L1阳性率的显著差异,然而目前食管癌领域的IHC一致性的相关研究却很少。
一些早期的临床试验如CheckMate-032等[7-9]将PD-L1阳性定义为≥1%肿瘤细胞染色,而KEYNOTE-180[3]和KEYNOTE-181[4]中将肿瘤相关免疫细胞也纳入了评估指标中,以PD-L1 22C3 CPS作为评估PD-L1表达状态的指标。美国FDA已批准PD-L1的IHC抗体22C3采用CPS评估PD-L1表达状态,用于指导ESCC患者能否接受KEYTRUDA二线治疗的伴随诊断。近期的一项meta分析[10]重点关注CPS和TPS在评价食管癌免疫治疗获益上的差异,其中4项研究显示,CPS≥10和CPS<10的两个亚组疗效有显著差异,CPS≥10的患者HR为0.60,而CPS<10的患者HR为0.83,另外5项研究TPS≥1%的患者的免疫治疗效果与TPS<1%亚组也有显著差异:TPS≥1%亚组从PD-L1治疗中OS获益的HR为0.61,而TPS<1%组HR为0.82。综上,CPS和TPS都可能成为ESCC潜在的判读指标。
本研究采用ESCC手术切除标本,进行了28-8、22C3和SP263这3种伴随诊断抗体的一致性评估,结果显示,三者具有较好的一致性,该结果与其他肿瘤中PD-L1检测抗体一致性研究类似。例如,在蓝印计划[11-12]中,非小细胞肺癌中28-8、22C3和SP263这3种抗体在TPS和IPS中均呈现出较好的一致性。同样,在乳腺癌、黑色素瘤、恶性胸膜间皮瘤、头颈部鳞状细胞癌和尿路上皮癌的检测中,3种抗体的一致性也得到了证实[13-17]。目前大多数探讨PD-L1抗体一致性的研究,主要集中于28-8、22C3、SP142和SP263这4种伴随诊断抗体的比对,而E1L3N克隆号作为非常经济和实验研究中非常广泛使用的PD-L1抗体之一,关于其临床应用的研究却很少。法国的一项NSCLC中PD-L1抗体一致性研究[18]评估了5种PD-L1抗体克隆号(28-8、22C3、E1L3N、SP142和SP263),发现E1L3N和SP263呈现出高度的一致性(Kappa=0.81)。目前未见有关食管癌中E1L3N抗体与标准化检测一致性的研究报道,本研究结果显示,22C3与E1L3N的两个克隆号(E1L3N XP、CST E1L3N)均具有较好的一致性,这填补了目前的研究空白。
本研究中,22C3分别与E1L3N XP、CST E1L3N、BP6099、MXR006这4种国产抗体在CPS≥10为阳性临界值时一致性较好,具有一定的可互换性,这为临床检测提供了更多选择。在TPS中,5种抗体间呈现出高度一致性,而在IPS中的一致性则较差,这一特点与同类研究相似。例如,一篇关于一致性研究的综述[19]指出,在评估NSCLC中TPS上的PD-L1表达时,28-8、22C3和SP263这3种抗体的一致性和可重复性很高,而在评估在IPS上的PD-L1表达时的一致性很差。Udall等[20]的综述中也有类似的记载,他们认为28-8、22C3和SP263 3种抗体,在评估TPS上的PD-L1表达情况时具有可互换性。与TPS相比,IPS的一致性降低可能与病理科医师的主观性判读差异有关。PD-L1判读结果是通过病理科医师视觉估算而产生,不同病理科医师或同一病理科医师不同时间评估可能有差别。因此,病理科医师在判读前需要经过统一培训,以最大程度地减少判读的主观性所造成的差异。从本研究的结果可以看出,IPS判读的一致性相对较低,这可能将影响将免疫细胞纳入的评分系统(如CPS)。因此,除了将判读标准统一化之外,如何识别形态各异的免疫细胞,并且更好地进行染色细胞数量的评估,也是推进PD-L1判读一致性的重要方面。
总之,本研究比较了ESCC中7种PD-L1抗体的检测效果,揭示了中国人群ESCC PD-L1表达率,并且对PD-L1各种抗体CPS、TPS和IPS之间评估的差异进行了探讨,为提高食管癌PD-L1判读一致性及后续探索PD-L1表达与食管癌免疫治疗效果预测及预后等研究的准确性提供了重要参考。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]李琦, 李涛, 范羽, 等. PD-1/PD-L1在食管鳞状细胞癌中的表达及临床意义[J]. 肿瘤预防与治疗, 2018, 31(4)248-257
LI Q, LI T, FAN Y, et al. Expression of PD-1/PD-L1 in esophageal squamous cell carcinoma and its clinical significance[J]. J Cancer Control Treat, 2018, 31(4)248-257
[2]王程浩, 韩泳涛. 2020年中国临床肿瘤学会《食管癌诊疗指南》解读[J]. 肿瘤预防与治疗, 2020, 33(4): 285-290.
WANG C H, HAN Y T. Interpretation of the 2020 guidelines for the diagnosis and treatment of esophageal cancer by Chinese society of clinical oncology[J]. J Cancer Control Treat, 2020, 33(4): 285-290.
[3] SHAH M A, KOJIMA T, HOCHHAUSER D, et al. Efficacy and safety of pembrolizumab for heavily pretreated patients with advanced, metastatic adenocarcinoma or squamous cell carcinoma of the esophagus: the phase 2 KEYNOTE-180 study[J]. JAMA Oncol, 2019, 5(4): 546-550.
[4] KOJIMA T, SHAH M A, MURO K, et al. Randomized phase Ⅲ KEYNOTE-181 study of pembrolizumab versus chemotherapy in advanced esophageal cancer[J]. J Clin Oncol, 2020, 38(35): 4138-4148.
[5] HUANG Z L, JIN Y, CAI X, et al. Association of the programmed death ligand-1 combined positive score in tumors and clinicopathological features in esophageal cancer[J]. Thorac Cancer, 2022, 13(4): 523-532.
[6] GUO W, WANG P, LI N, et al. Prognostic value of PD-L1 in esophageal squamous cell carcinoma: a meta-analysis[J]. Oncotarget, 2018, 9(17): 13920-13933.
[7] BANG Y J, RUIZ E Y, VAN CUTSEM E, et al. Phase Ⅲ, randomised trial of avelumab versus physician’s choice of chemotherapy as third-line treatment of patients with advanced gastric or gastro-oesophageal junction cancer: primary analysis of JAVELIN Gastric 300[J]. Ann Oncol, 2018, 29(10): 2052-2060.
[8] MURO K, CHUNG H C, SHANKARAN V, et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial[J]. Lancet Oncol, 2016, 17(6): 717-726.
[9]JANJIGIAN Y Y, BENDELL J, CALVO E, et al. CheckMate-032 study: efficacy and safety of nivolumab and nivolumab plus ipilimumab in patients with metastatic esophagogastric cancer[J]. J Clin Oncol, 2018, 36(28): 2836-2844.
[10] LEONE A G, PETRELLI F, GHIDINI A, et al. Efficacy and activity of PD-1 blockade in patients with advanced esophageal squamous cell carcinoma: a systematic review and metaanalysis with focus on the value of PD-L1 combined positive score[J]. ESMO Open, 2022, 7(1): 100380.
[11] HIRSCH F R, MCELHINNY A, STANFORTH D, et al. PDL1 immunohistochemistry assays for lung cancer: results from phase 1 of the blueprint PD-L1 IHC assay comparison project [J]. J Thorac Oncol, 2017, 12(2): 208-222.
[12]TSAO M S, KERR K M, KOCKX M, et al. PD-L1 immunohistochemistry comparability study in real-life clinical samples: results of blueprint phase 2 project[J]. J Thorac Oncol, 2018, 13(9): 1302-1311.
[13] KRIGSFELD G S, ZERBA K, NOVOTNY J Jr, et al. A comparative study of the PD-L1 IHC 22C3 and 28-8 assays on lung cancer samples[J]. Int J Radiat Oncol, 2019, 104(1): 236-237.
[14] WATANAB E T , O K U D A K , MU R A S E T , e t a l . F o u r immunohistochemical assays to measure the PD-L1 expression in malignant pleural mesothelioma[J]. Oncotarget, 2018, 9(29): 20769-20780.
[15] DE RUITER E J, MULDER F J, KOOMEN B M, et al. Comparison of three PD-L1 immunohistochemical assays in head and neck squamous cell carcinoma (HNSCC)[J]. Mod Pathol, 2021, 34(6): 1125-1132.
[16] KRIGSFELD G S, PRINCE E, ZERBA K, et al. Analysis of real-world PD-L1 testing in patients with urothelial carcinoma[J]. J Clin Oncol, 2019, 37(7_suppl): 447.
[17] KARNIK T, KIMLER B F, FAN F, et al. PD-L1 in breast cancer: comparative analysis of 3 different antibodies[J]. Hum Pathol, 2018, 72: 28-34.
[18] ADAM J, LE STANG N, ROUQUETTE I, et al. Multicenter harmonization study for PD-L1 IHC testing in non-small-cell lung cancer[J]. Ann Oncol, 2018, 29(4): 953-958.
[19]BÜTTNER R, GOSNEY J R, SKOV B G, et al. Programmed death-ligand 1 immunohistochemistry testing: a review of analytical assays and clinical implementation in non-small-cell lung cancer[J]. J Clin Oncol, 2017, 35(34): 3867-3876.
[20] UDALL M, RIZZO M, KENNY J, et al. PD-L1 diagnostic tests: a systematic literature review of scoring algorithms and testvalidation metrics[J]. Diagn Pathol, 2018, 13(1): 12.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言