Nat Med:axi-cel治疗不适合自体移植LBCL的2期ALYCANTE研究结果
2023-10-03 聊聊血液 聊聊血液 发表于陕西省
法国Rennes大学医院Roch Houot教授牵头开展了一项2期研究 ,以评估单次axi-cel输注作为二线治疗在被认为不适合 ASCT 但适合CAR-T 细胞治疗的高危R/R LBCL 患者中的疗
ALYCANTE研究
ZUMA-7研究证明,对于适合自体造血干细胞移植(ASCT)的高危复发/难治性大B细胞淋巴瘤(R/R LBCL)患者,axicabtagene ciloleucel(axi-cel)作为二线治疗的疗效优于标准治疗(SOC)。然而在临床实践中,约半数 R/R LBCL 患者并不适合大剂量化疗[HDCT]/ASCT,部分因素可能妨碍患者接受HDCT/ASCT,包括高龄、虚弱和共存疾病,此外既往接受过 ASCT 作为一线巩固治疗的患者通常不适合接受二次 ASCT。对于不适合 HDCT/ASCT 的 R/R LBCL 患者,二线免疫化疗后的结局较差,尤其是在难治性或早期复发的患者中(一线治疗后12个月内)。
尽管尚未在不适合 HDCT/ASCT 的 R/R LBCL 患者中评价axi-cel作为二线治疗,但临床试验数据和真实世界证据表明,CAR-T细胞治疗在不适合移植的患者亚组中是可行的,尤其是在老年和less-fit患者中。在此背景下,法国Rennes大学医院Roch Houot教授牵头开展了一项2期研究 (ALYCANTE),以评估单次axi-cel输注作为二线治疗在被认为不适合 ASCT 但适合CAR-T 细胞治疗的高危R/R LBCL 患者中的疗效和安全性。研究结果近日发表于《Nature Medicine》。

研究方法&结果
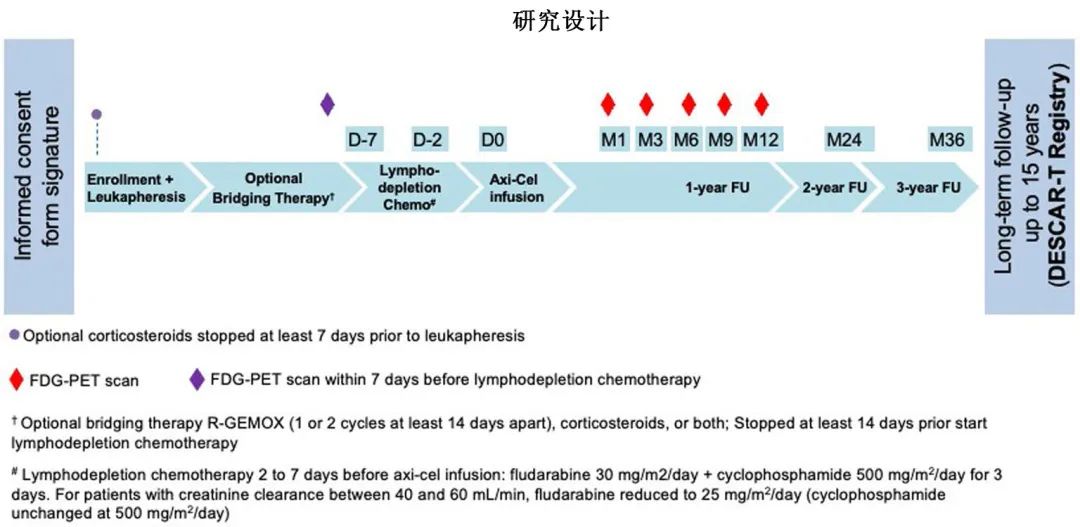
ALYCANTE研究为仍在进行中的单臂、多中心、开放标签2期研究,纳入≥18岁、组织学确诊的侵袭性B细胞非霍奇金淋巴瘤(根据2016 WHO标准),且必须对含单克隆 CD20 抗体和含蒽环类药物方案(CHOP或 CHOP 样方案)的一线免疫化疗难治或在治疗12个月内复发,此外不适合ASCT(年龄≥65岁、HCT-CI评分≥3或既往ASCT作为一线巩固治疗)。
患者和治疗
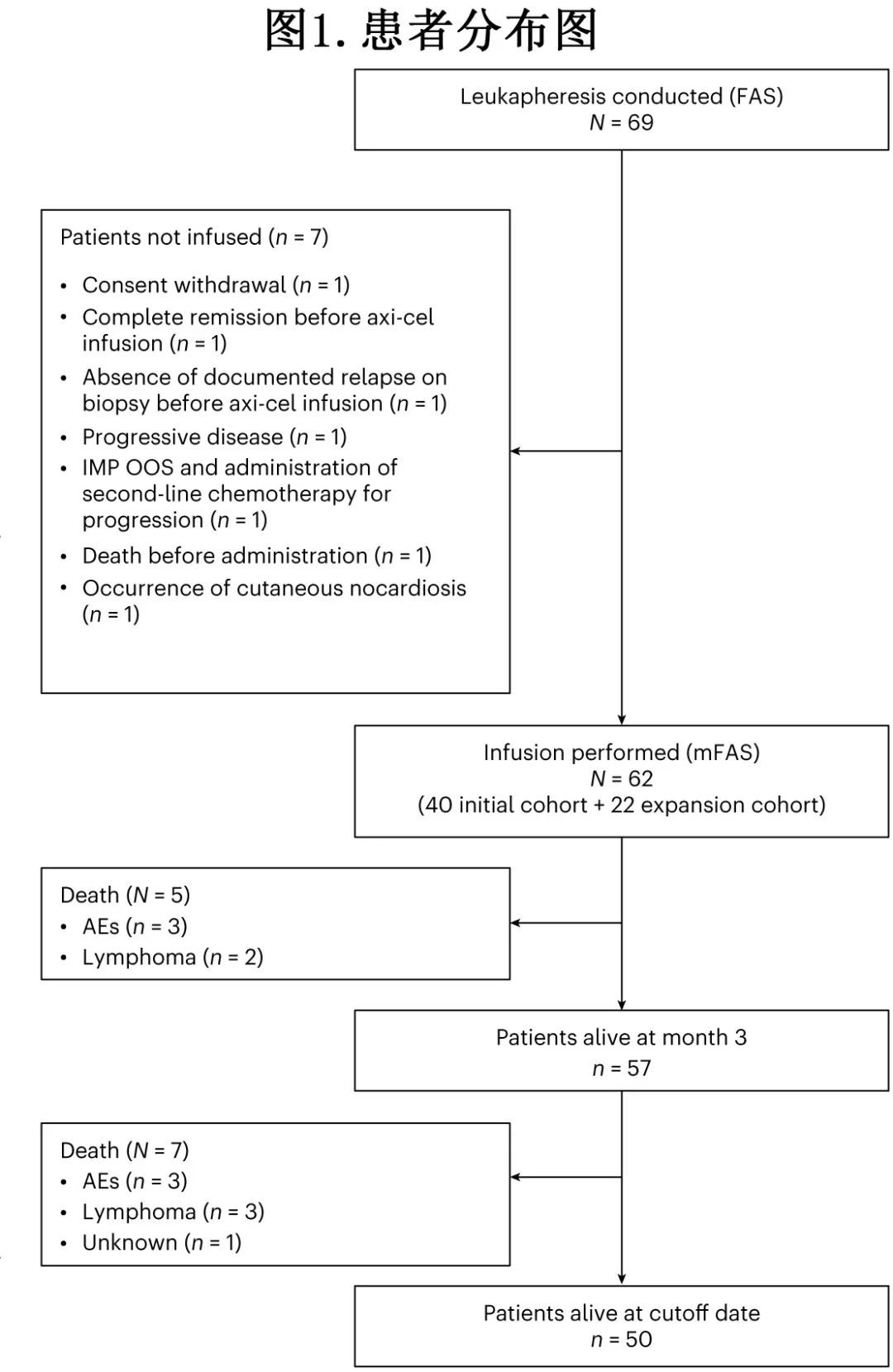
共有69例患者入组并接受了白细胞单采,定为全分析集 (FAS),其中62例 (89.8%)接受了单次axi-cel输注,因此被纳入改良全分析集 (mFAS)。有5例重要的入选标准方案违背:3例为完成一线化学免疫治疗后超过12个月发生疾病复发,2例为中心审查后组织学诊断为 1-3A 级滤泡性淋巴瘤。患者流程图如图1所示,7例患者接受了白细胞单采但未接受 CAR-T细胞输注。研究入组和axi-cel输注之间的中位时间为41.5天,输注后的中位随访时间为12.0个月。
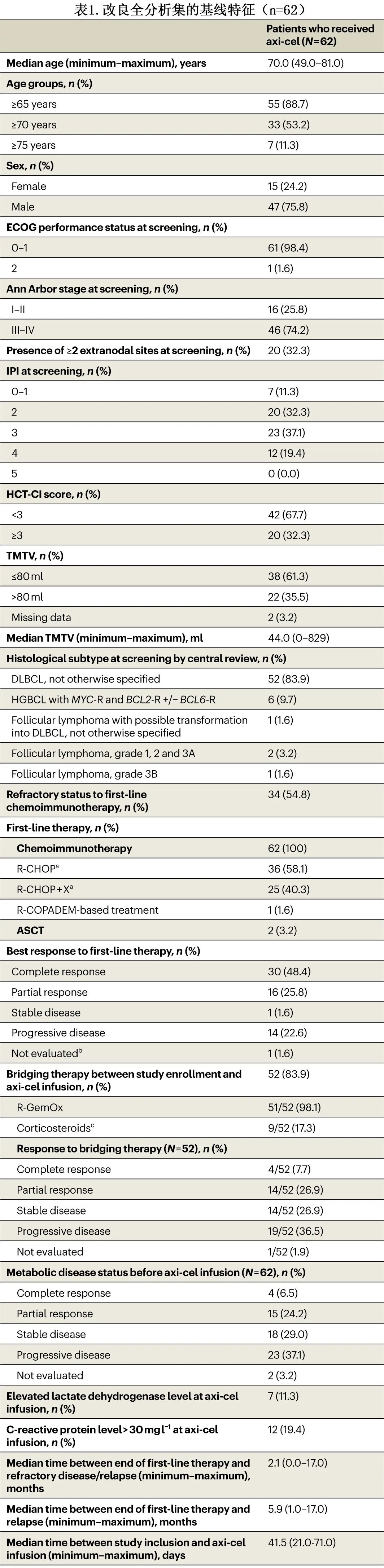
mFAS(N=62) 中患者的人口统计学和疾病特征总结见表1。中位年龄70岁,女性15例 (24.2%),国际预后指数 (IPI)≥3 分35例 (56.5%)。几乎所有患者的ECOG体能状态均为0或1(n=61;98.4%)。大多数患者 (n=52;83.9%) 经组织学诊断为弥漫性大 B 细胞淋巴瘤 (DLBCL)。共有34例患者 (54.8%) 为一线免疫化疗原发性难治。患者被认为不适合HDCT/ASCT的因素包括:年龄≥65岁 (88.7%)、高HCT-CI评分≥3(32.3%) 和/或既往ASCT(3.2%)。总体而言,52例患者 (83.9%) 在白细胞单采后根据研究者的判断接受了桥接治疗;在这52例患者中的51例 (98.1%) 中,桥接治疗包括 R-GemOx 给药1个周期 (n=25)、2个周期 (n=25) 或3个周期 (n=1)。此外,52例患者中的9例 (17.3%) 接受了皮质类固醇,其中1例患者接受了单纯皮质类固醇而未接受R-GemOx。在接受桥接治疗的患者中,63.4%无应答(疾病稳定或疾病进展)。
主要疗效结局
在mFAS(N=62) 中,研究者根据 Lugano 标准评估的axi-cel输注后3个月时的完全代谢缓解 (CMR)为71.0%(表2)。与 mFAS 相比,对FAS(N=69) 的敏感性分析未显示研究者评估的3个月 CMR 有显著差异,为66.7%。同样,排除2例1-3级滤泡性淋巴瘤患者和4例桥接治疗后达到完全缓解的患者的事后分析发现,3个月时研究者评估的 CMR 为67.9%,与 mFAS 中报告的3个月 CMR 相当。值得注意的是,在axi-cel输注后1个月达到部分代谢缓解 (PMR) 的10例患者中,5例患者在3个月时转为CMR,未接受任何额外治疗。
次要疗效结局
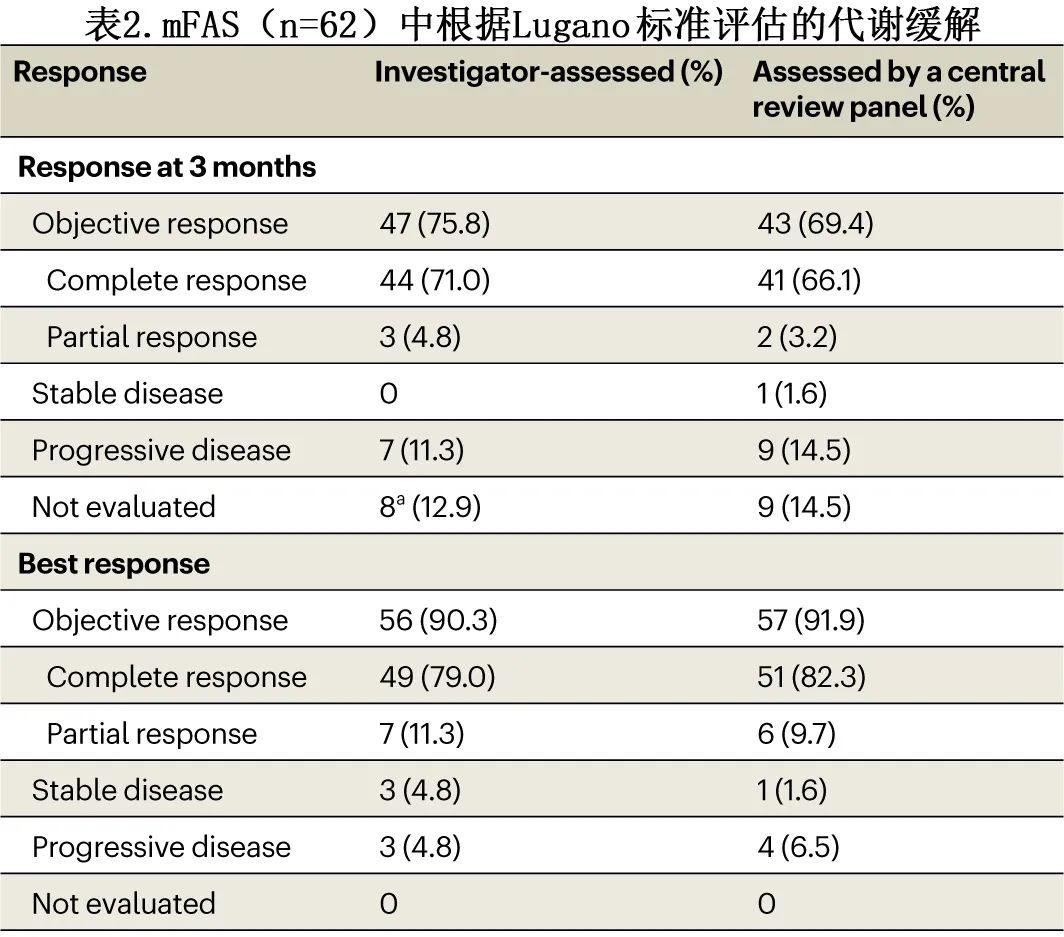
axi-cel输注后3个月,研究者评估的 ORR 为75.8%。在输注后6个月,经研究者评估,共有37例患者 (59.7%) 保持CMR。研究者评估的最佳 ORR 和最佳 CMR 分别为90.3%和79.0%。当由中心审查小组评估时,3个月时 CMR 和 ORR 分别为66.1%和69.4%;最佳 ORR 和最佳 CMR 分别为91.9%和82.3%(表2)。
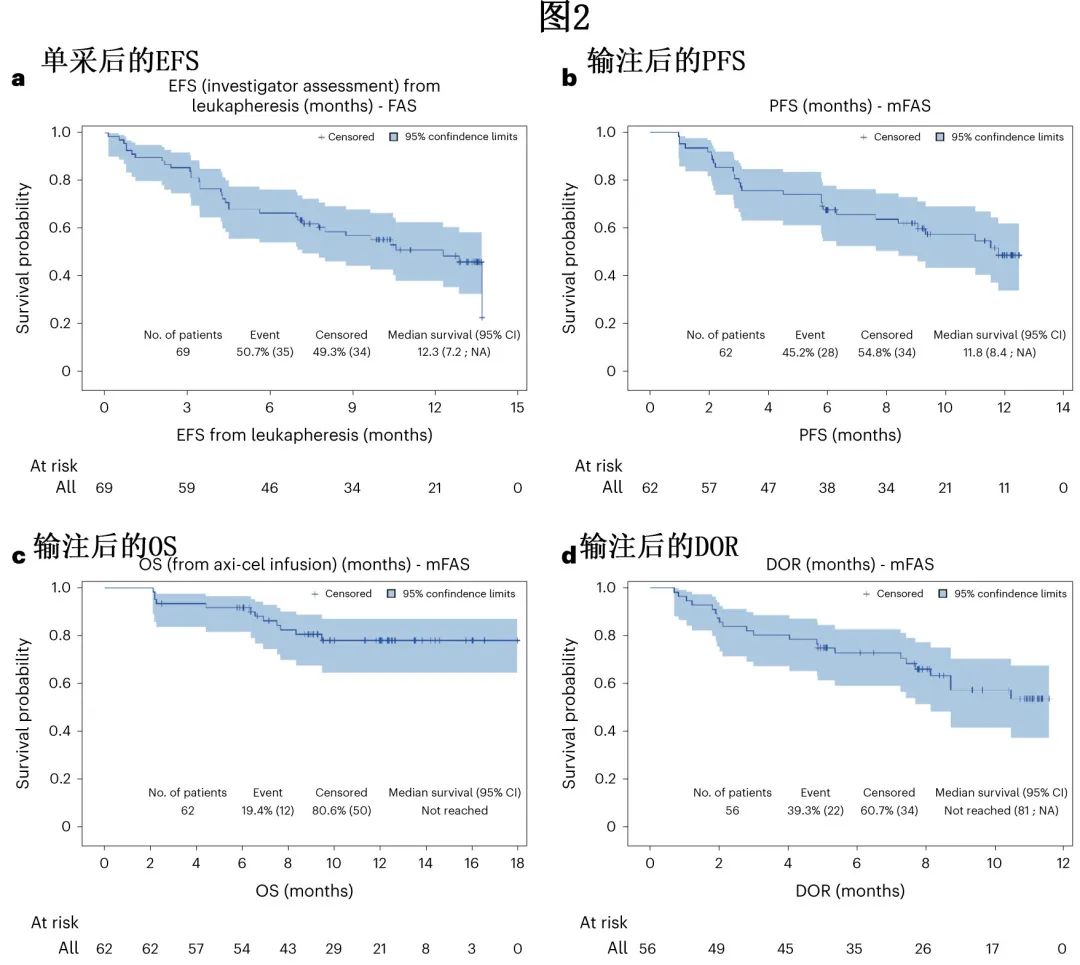
中位随访12.0个月,白细胞单采后的中位无事件生存期(EFS)为12.3个月 (图2a)(n=69),6个月和12个月的估计 EFS 率分别为66.7%和51.2%。axi-cel输注后的中位无进展生存期(PFS)为11.8个月 (图2b)(N=62),6个月和12个月的 PFS 率估计值分别为67.7%和48.8%。输注后的中位总生存期(OS)未达到(图2c)(N=62),6个月和12个月的估计 OS 率分别为91.9%和78.3%。未达到中位缓解维持时间(DOR)(图2d)。
安全性
所有患者均发生至少1起任何级别的不良反应。62例患者中的59例 (95.2%) 发生了≥3级不良反应,最常报告的≥3级不良反应为中性粒细胞减少症(66.1%的患者发生)、贫血 (38.7%) 和血小板减少症 (38.7%)。33例患者 (53.2%) 发生任何级别的各种感染(即COVID-19、尿路感染、脓毒症、呼吸道感染、皮肤感染),最常见的感染为COVID-19,有15例患者 (24.2%) 报告,其中7例≥3级,2例为5级。
与 CAR-T 细胞毒性相关的特别关注的不良反应见表3。93.5%的患者发生细胞因子释放综合征 (CRS),8.1%的患者报告≥3级CRS;axi-cel输注后至 CRS 发生的中位时间为1.5天 (IQR,1.0-3.0),中位 CRS 持续时间为5.0天 (IQR,4.0-9.0)。51.6%的患者发生免疫效应细胞相关神经毒性综合征 (ICANS),14.5%的患者报告≥3级ICANS;输注后至 ICANS 发作的中位时间为6.0天 (IQR,5.0-8.0),中位 ICANS 持续时间为5.0天 (IQR,3.0-8.0)。未发生与 CRS 或神经系统事件相关的死亡。CAR-T 细胞毒性主要通过白细胞介素-6受体拮抗剂托珠单抗(77.4%的患者给药)和/或皮质类固醇(64.5%的患者)进行管理。因 CAR-T 细胞毒性入住ICU共16例 (25.8%)。62例患者中的23例 (37.1%) 发生了≥3级的长期血细胞减少(定义为 axi-cel 输注后30天未消退的贫血、中性粒细胞减少症和/或血小板减少症的≥3级实验室结果)。
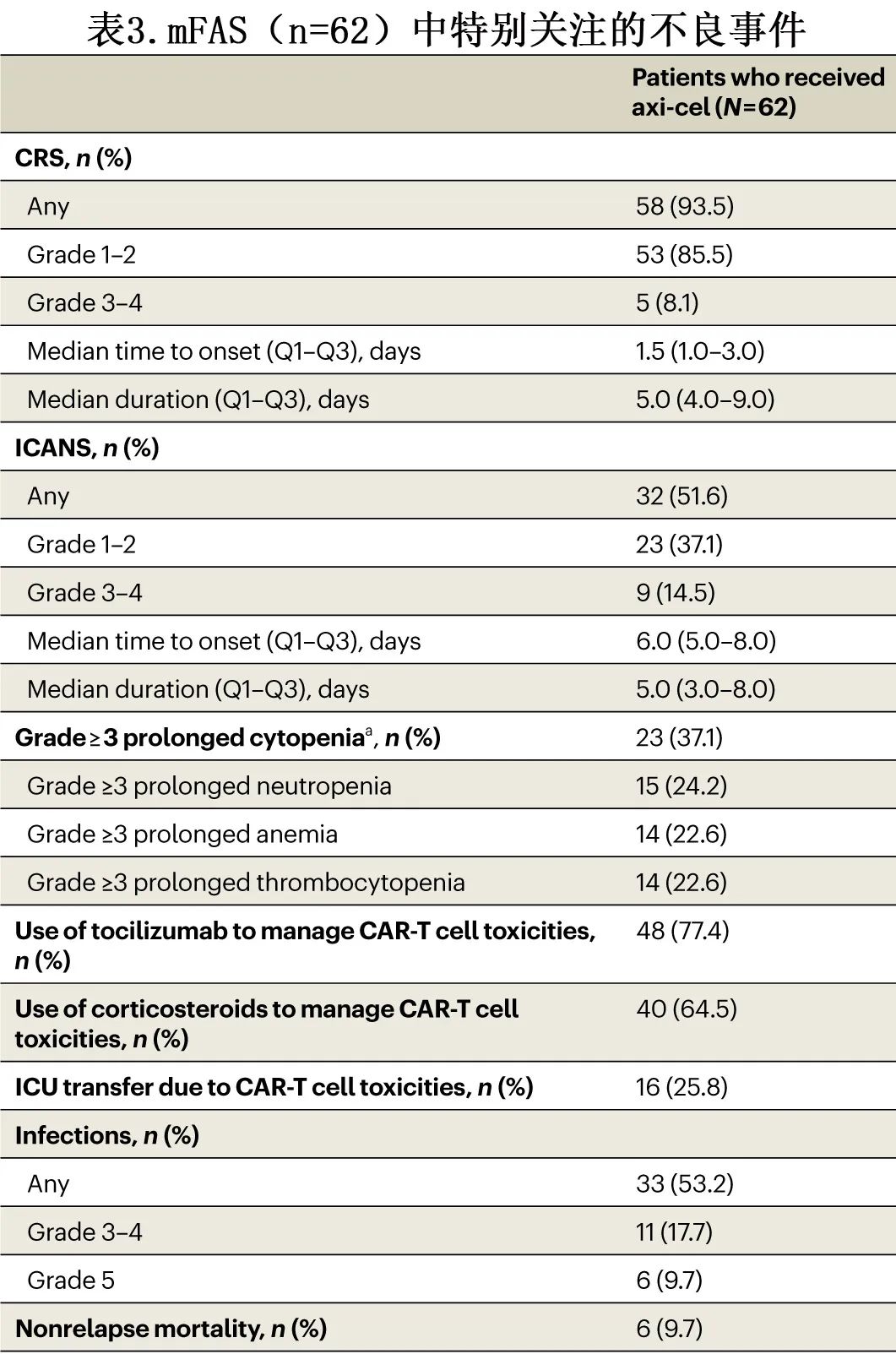
数据截止时12例患者死亡,其中5例死于淋巴瘤,1例死因不明;6例患者 (9.7%)为非复发死亡 (NRM)。所有致死性不良反应均发生较晚(axi-cel输注后超过2个月)且为感染:2例COVID-19、1例曲霉病、1例毛霉菌病、1例脓毒症和1例会阴感染。
亚组分析
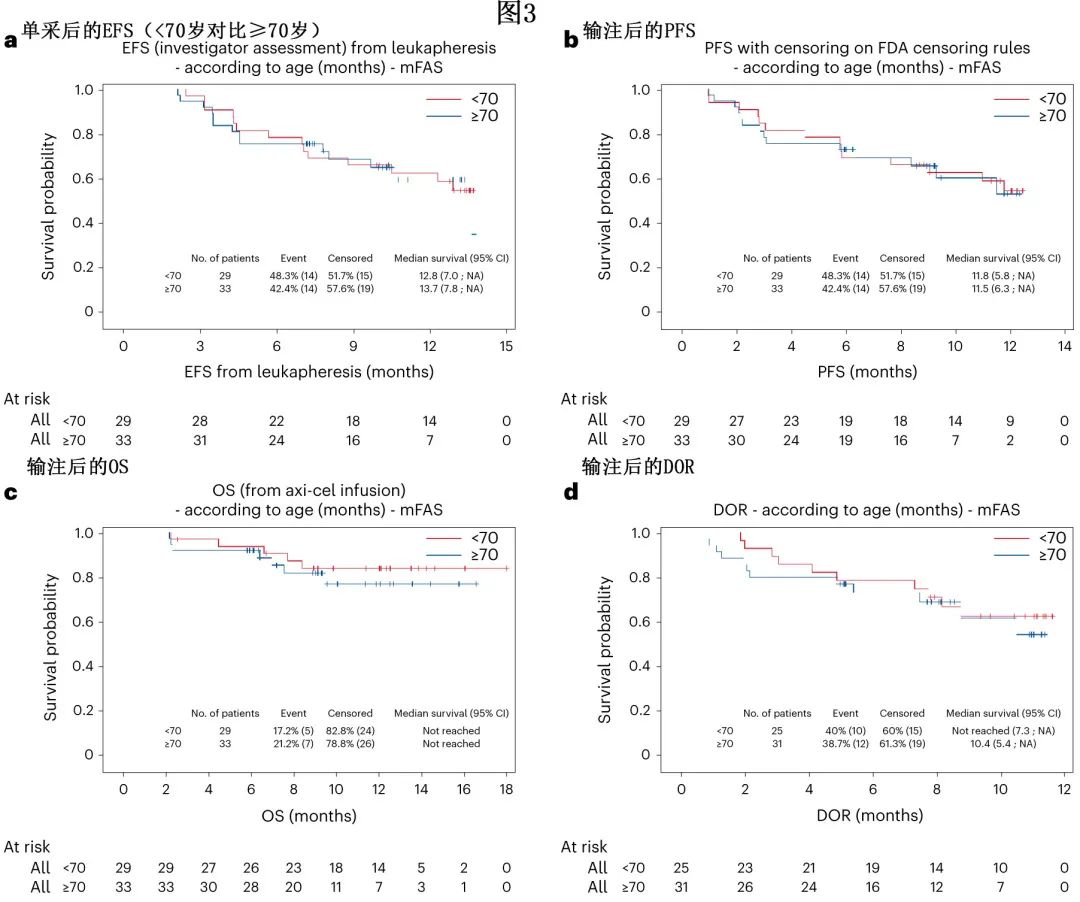
作者研究了axi-cel在不同患者人群中的疗效和安全性是否一致,尤其是在年龄≥70岁且伴有 HCT-CI 评分≥3定义的合并症的患者中。在年龄≥70岁的患者 (n=33) 中,3个月 CMR 为72.7%,而在年龄<70岁的患者 (n=29) 中为69.0%。年龄<70岁和≥70岁患者的生存结局和DOR相当(图3);与年龄<70岁的患者相比,年龄≥70岁的患者未显示毒性增加,CRS、ICANS和 ICU 转诊率也相似。同样,HCT-CI评分≥3的患者 (n=20) 报告3个月 CMR 为80.0%,与 HCT-CI 评分<3的患者 (n=42) 相比生存期相似且毒性未增加。除一个亚组外,在所有评价的亚组中均观察到相似的研究者评估的3个月CMR,唯一的例外为总代谢性肿瘤体积 (TMTV),因为入组时高TMTV>80mL与3个月时 CMR 降低相关。
总结
ALYCANTE 研究是一项开放标签、2期研究,在62例不适合 ASCT 的 R/R LBCL 患者中评价了axi-cel作为二线治疗,其主要终点是研究者评估的axi-cel输注后3个月的完全代谢缓解,关键次要终点包括无进展生存期、总生存期和安全性。该研究符合其主要终点,3个月时完全代谢缓解率为71.0%。中位随访12.0个月,中位无进展生存期11.8个月,未达到总生存期。无非预期毒性,3-4级细胞因子释放综合征和神经系统事件的发生率分别为8.1%和14.5%。此外,尽管患者年龄较大且存在合并症,但在不适合 HDCT/ASCT 的人群中axi-cel的安全性特征可接受。该结果支持axi-cel作为不适合 ASCT 的 R/R LBCL 患者的二线治疗。
参考文献
Houot R,et al. Axicabtagene ciloleucel in large B cell lymphoma ineligible for autologous stem cell transplantation the phase 2 ALYCANTE trial. 2023 Sep 14. doi: 10.1038/s41591-023-02572-5.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







