专家论坛|林炳亮:间充质干细胞治疗终末期肝病的临床研究进展
2023-08-06 临床肝胆病杂志 临床肝胆病杂志 发表于上海
肝移植是治愈此阶段患者唯一的方法,但肝源短缺、移植后免疫排斥、费用昂贵等问题极大限制了其在临床上的应用。近年来兴起的细胞疗法得到了广泛关注,其中的干细胞疗法更被认为是有极大前景的肝移植替代疗法。
肝脏具有消化、解毒、内分泌等多种功能,并且有强大的自我再生能力。终末期肝病(ESLD)是指各种损伤引起的肝脏结构和功能不可逆改变已经到了晚期阶段,包括各种类型的肝衰竭、失代偿期肝硬化,预后通常很差。肝移植是治愈此阶段患者唯一的方法,但肝源短缺、移植后免疫排斥、费用昂贵等问题极大限制了其在临床上的应用。近年来兴起的细胞疗法得到了广泛关注,其中的干细胞疗法更被认为是有极大前景的肝移植替代疗法[1]。
1间充质干细胞(MSC)是肝病治疗领域应用最广的干细胞
干细胞是一组具有多向分化潜能的细胞群,在体外适宜条件下可以被诱导分化为肝细胞样细胞(HLC),具有完整的肝细胞功能。此外,它还可以旁分泌很多细胞因子,改变受损肝脏的局部微环境,调节免疫功能减轻肝脏炎症损伤,刺激肝细胞再生。临床上常用的干细胞包括:MSC、胚胎干细胞(ESC)和造血干细胞(HSC)等。ESC受限于免疫排斥问题,而HSC体外增殖能力有限,故应用MSC治疗肝病的研究最为广泛。
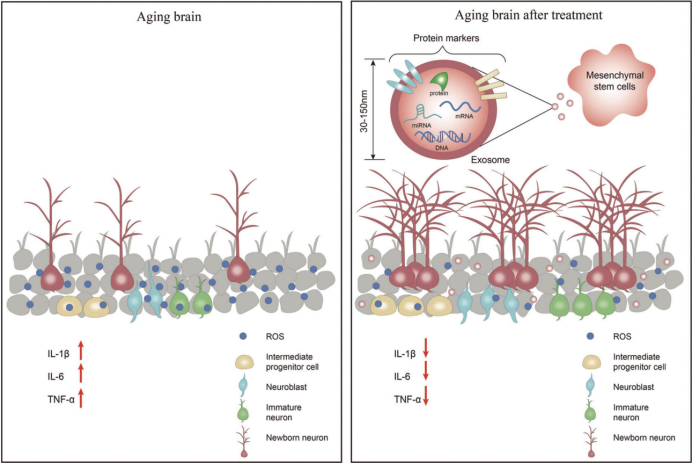
MSC主要集中在人的骨髓和脐带血,从来源上可将MSC分为骨髓间充质干细胞(BM-MSC)、脐带间充质干细胞(UC-MSC)、脂肪间充质干细胞(AMSC)等。因其不表达MHCⅡ类抗原,很少表达MHCⅠ类抗原,故免疫原性很低,MSC移植具有较高的安全性。BM-MSC迁移能力最强,旁分泌功能强大[2],是当下研究的热点。其分泌的外泌体(Exo)是一种细胞外囊泡,携带了多种生物活性物质,包括蛋白质、miRNA和DNA等[3]。它可以代替“母细胞”通过调节不同靶细胞的信号通路发挥作用,是很有前景的“无细胞”治疗方案。
2干细胞治疗肝病的机制
2.1 干细胞可以分化为HLC发挥功能并向受损肝脏归巢
20世纪初,Yan等[4]通过体外培养从肝硬化失代偿期患者外周血中分离BM-MSC,发现重组人肝细胞生长因子可以诱导干细胞转分化为HLC。进一步在动物实验中借助示踪蛋白发现移植的BM-MSC首先向肺部累积,之后才向损伤的肝脏归巢[5]。Yu等[6]将人的UC-MSC移植入肝脏受损的小鼠体内,小鼠肝脏HE染色显示坏死肝脏面积缩小,且人白蛋白、细胞角蛋白-18染色呈阳性,说明人UC-MSC可以归巢到受损组织并分化为有功能的肝细胞。但到目前为止,MSC归巢的机制还未完全阐明,干细胞分化程度不足、效率低下的问题仍需更多实验来探索解决。
2.2 干细胞通过旁分泌机制调节免疫、抑制纤维化修复受损肝脏
随着研究的深入,人们认识到MSC通过旁分泌机制改变肝脏局部微环境比向HLC转分化对于肝脏的修复更重要[7],这种机制主要通过MSC旁分泌细胞因子的方式调节机体的免疫,进而改善肝脏的纤维化,这些细胞因子包括吲哚胺2, 3-双加氧酶(IDO)、前列腺素E2(PGE2)、转化生长因子β(TGF-β)等[8]。对固有免疫来说,MSC可以诱导巨噬细胞向M2亚型极化,分泌IL-10并清除坏死的肝细胞,缓解肝脏炎症损伤[9]。NK细胞的功能也不同程度受到MSC影响,表现为功能激活或功能抑制。对适应性免疫来说,T淋巴细胞和B淋巴细胞功能均被抑制。已有研究[10]表明,MSC释放的TGF-β可以抑制ERK1/2的磷酸化,影响细胞周期蛋白使之停止在G1期,进而减少T淋巴细胞的增殖。还有临床研究结果[11]表明T淋巴细胞的分化亦受MSC影响,自体BM-MSC移植治疗HBV相关性肝硬化患者的外周血中Th17细胞向肝脏流入减少,调节性T淋巴细胞(Treg)数量增加。与MSC共培养的B淋巴细胞的增殖能力和分泌抗体能力也出现大幅下降,其表面CXCR4等趋化因子受体表达减少[12]。
MSC可以通过下调TGF-β1受体和平滑肌α肌动蛋白(α-SMA)等的表达间接减轻肝脏纤维化[13]。MSC分泌乳脂小球-EGF因子8(MFGE8)减少星状细胞表面的TGF-β1受体表达,还可以通过激活Notch通路下调星状细胞的α-SMA表达,从而抑制星状细胞的活化[14]。除Treg和Th17细胞比例失调外,IL-17水平也有显著下降,两者共同抑制了星状细胞活化并促进其凋亡,进而影响了Ⅰ型胶原的沉积及胞外基质的合成[15],相关动物实验结果表明这可能和TGF-β/Smad通路、NADPH氧化酶通路被抑制有关[16]。此外,MSC还可以分泌基质金属蛋白酶(MMP)-9、MMP-14等直接降解胞外基质[17]。直接和间接两种途径协同减轻了肝脏纤维化的程度。
2.3 Exo通过多种机制减少肝脏损伤并助其再生
Exo是一种携带多种生物活性物质的细胞外囊泡,从MSC分泌的Exo由于其无细胞特性日益受到重视。和细胞相比,Exo体积更小,结构更简单,更容易合成和保存,形成肿瘤的风险也更小。更重要的是,因其膜蛋白数量更少故免疫原性也远低于MSC,能避免干细胞直接移植带来的很多问题。研究[18]发现,MSC-Exo能减轻肝移植中肝的缺血再灌注程度,这可能和Exo激活鞘氨醇激酶和鞘氨醇-1-磷酸通路有关。在刀豆球蛋白-A(Con-A)诱导的肝损伤小鼠模型[19]中发现,Exo可以迁移到肝脏,增加肝组织增殖细胞核抗原(PCNA)和细胞周期蛋白D1(cyclin D1)的表达,使肝细胞从G0期进入G1期。Zhao等[20]发现Exo通过自噬途径减少肝细胞的凋亡,抗凋亡蛋白Bcl-2表达增多,促凋亡蛋白cleaved caspase-3表达减少。Lin等[21]发现Exo中let-7a-5p通过MAP4K3通路增加转录因子EB (TFEB)的核转位来增强肝脏自噬活动,最终缓解慢加急性肝衰竭(ACLF)患者的肝损伤。
Exo还可以通过抑制NLRP3炎症小体通路减轻肝细胞炎性损伤。有研究[22]发现增加Exo中miR-223的表达强度明显降低了小鼠肝组织中NLRP3的表达;急性肝损伤动物模型中也发现MSC的Exo可以阻断IL-6介导的信号通路[23]和下调NLRP3通路[24]。此外,它还可以降低血管内皮黏附分子1的表达下调免疫强度发挥抗炎作用[25]。Exo同样可以下调CCl4诱导肝纤维化大鼠的肝星状细胞中Wnt/β-catenin通路的信号强度[26],降低星状细胞的活化程度,以此减轻肝纤维化。
3干细胞治疗ESLD的临床研究
在治疗肝病方面最常用的干细胞是MSC,其次是预先用粒细胞集落刺激因子(G-CSF)动员后获得的骨髓源性干细胞(BMSC), 前者以BM-MSC和UC-MSC多见,供体干细胞来源多为自体或同种异体。
3.1 干细胞治疗肝衰竭
自体MSC移植对治疗ACLF患者是安全的,在短期内可以改善肝衰竭患者的肝功能。Salama等[27]对HCV相关肝衰竭患者的BM-MSC进行G-CSF动员后由外周静脉自体输注,随访26周后发现,移植组54%的患者转氨酶、白蛋白、胆红素等水平得到改善。该团队[28]还应用自体BM-MSC经肝动脉或门静脉移植入48例肝衰竭患者,半年后患者的凝血功能国际标准化比值(INR)恢复正常水平,肝功能和腹水有所好转。Garg等[29]亦发现BM-MSC可以明显降低ACLF患者的肝功能评分(包括Child-Pugh、MELD和SOFA评分)。有研究[30]将自体BM-MSC在体外诱导分化为HLC后回输入体内,随访6个月后发现移植组患者的下肢水肿和腹水明显改善。Peng等[31]将自体BM-MSC从肝动脉输入HBV相关肝衰竭患者体内,48周后观察到血清总胆红素下降,白蛋白升高,MELD评分降低。
一项非盲随机对照研究[32]旨在探究BM-MSC治疗肝衰竭的有效性,共有56例HBV相关ACLF患者接受注射同种异体的BM-MSC[(1~10)×105个/kg],每周1次,连续4周,随访24周后发现患者血清总胆红素水平、MELD评分改善,移植组的严重感染发生率较对照组显著下降(16.1% vs 33.3%, P=0.04),24周累积生存率移植组显著高于对照组(73.2% vs 55.6%, P=0.03)。这至少表明同种异体BM-MSC在短期内可以改善肝衰竭患者的肝功能,且安全性较好。
还有研究者[33]将UC-MSC由肝动脉注入11例HBV相关ACLF患者体内(1×108个/次),4周后发现血清中白蛋白、转氨酶、胆红素、INR水平和MELD评分较前改善,继续随访24个月,未观察到和输注相关的严重不良事件的发生。
3.2 干细胞治疗病毒性肝炎引起的失代偿期肝硬化
BM-MSC治疗病毒引起的失代偿肝硬化患者具有不错的安全性和效果。Xu等[11]将乙型肝炎肝硬化失代偿期患者的自体BM-MSC经肝动脉输入体内,随访24周,移植组20例完成随访,对照组19例完成随访。结果显示移植组的肝功能、MELD评分显著优于对照组。除乙型肝炎引起的失代偿肝硬化外,有研究[34]提示MSC治疗由HCV引起的肝硬化同样可以降低患者的Child-Pugh评分和MELD评分,同时发现MSC的注射途径和是否分化为HLC并不影响整体治疗效果。但并非所有BM-MSC移植后都呈现满意的疗效。Mohamadnejad等[35]的研究纳入了27例肝硬化失代偿期患者,15例从外周血注射自体BM-MSC,剩余对象注射生理盐水作为对照。1年后两组间肝功能评分和INR无明显差异,该结果不排除和注射途径、BM-MSC的质量有关。
G-CSF动员后的干细胞同样可以改善失代偿肝硬化患者的病情。Guo等[36]利用G-CSF先将失代偿期肝硬化患者的CD34+ BMSC动员至外周血,之后富集外周血中的干细胞并由肝动脉回输至肝脏,发现富集后回输组的治疗效果优于单纯G-CSF动员组。之后约10年的随访结果显示,患者血清白蛋白、胆碱酯酶水平提高,凝血功能改善,MELD评分下降,平均生存期由71个月延长至94个月,5年生存率由52.1%升高至71.2%。Khan等[37]针对HBV和HCV引起的肝硬化患者,从肝动脉注入G-CSF动员后的BM-MSC,6个月后结果提示白蛋白升高,转氨酶和胆红素下降,Child-Pugh评分改善。国外其他类似的研究[38-39]也发现患者移植经过或未经过动员的BMSC后未出现严重不良反应,肝功能血清学指标好转,肝功能评分明显下降,患者的临床症状和相关并发症得到缓解。G-SCF动员后,不管被移植入的是BM-MSC还是BMSC,患者都表现出了不错的耐受性,肝功能明显好转,肝脏再生活动基因表达上调[40]。在由肝动脉注射BM-MSC的研究中,HBV相关的肝硬化患者6个月的Child-Pugh评分远低于对照组[41]。
Zhang等[42]的研究将UC-MSC从外周静脉注入乙型肝炎相关失代偿期肝硬化患者体内,48周后发现患者腹水减少,肝功能和MELD评分均改善。同样的治疗方法在乙型肝炎相关ACLF患者中得到相同的结论[43]。Lin等[44]的研究探讨了UC-MSC治疗在肝硬化患者中的安全性,在移植干细胞后不同时段监测血清中血糖、总胆固醇、尿素氮、甲胎蛋白、白细胞数和凝血酶原活动度,结果表明很少有患者发生致瘤或其他严重不良反应,且UC-MSC治疗对上述血清学指标影响微乎其微,表明UC-MSC可以提高患者的生存质量,安全性值得肯定。该团队还对HBV相关的肝硬化失代偿患者作了长达7年的预后随访研究,219例患者分为UC-MSC处理组108例和对照组111例,处理组共接受了3次MSC注射,每次间隔4周。结果显示,在13~75个月的总体生存率处理组高于对照组,但肝细胞癌患病率两组之间并无显著差异;48周内处理组的白蛋白、总胆红素、胆碱酯酶和凝血酶原活动度明显改善,且未出现治疗相关的并发症,结果表明UC-MSC在改善HBV相关肝硬化患者的长期生存率方面也有积极的作用[45]。
3.3 干细胞治疗其他原因引起的失代偿期肝硬化
BM-MSC可以减轻酒精性肝硬化患者的肝纤维化程度。有研究应用自体BM-MSC治疗酒精性肝硬化失代偿期患者,结果显示除肝功能和评分改善外,肝纤维化相关蛋白,如Ⅰ型胶原蛋白、TGF-β1等表达减少,肝脏病理也提示肝脏结构有所恢复,输注2次后肝脏组织胶原含量减少了37%[46],Jang等[47]的类似研究结果也提示患者肝组织学改善。Pai等[48]在酒精性肝硬化人群中应用BM-MSC治疗后观察到胆红素、转氨酶水平降低,Child-Pugh评分下降,以及腹水减少。这充分说明了自体干细胞治疗失代偿期肝硬化患者的有效性。
随着对干细胞治疗机制的认识加深,其免疫调节功能被越来越多应用于治疗某些自身免疫性疾病。在自身免疫性肝病患者中应用G-CSF动员后的CD34+ BMSC治疗,患者肝功能指标可以恢复正常[28];某些自身免疫性疾病(如类风湿性关节炎、原发性干燥综合征等)引起的肝硬化患者移植UC-MSC后表现出了良好的耐受性,随访2年间肝功能逐步恢复[49]。针对原发性胆汁性胆管炎(PBC)患者的两项干细胞治疗的临床研究[50]结果显示,移植BM-MSC和UC-MSC后,患者肝功能的血清学指标显著改善,包括转氨酶、γ-谷氨酰转移酶和碱性磷酸酶等,同时IL-10、CD4+/CD25+ T淋巴细胞水平都有所上升。但对于免疫性疾病导致的失代偿期肝硬化,个别利用干细胞治疗案例出现了很严重的后果。有研究[51]利用BM-MSC治疗PBC和自身免疫性肝炎(AIH)导致的肝硬化患者各1例,结果虽然显示肝功能得到了好转,但患者出现了肾衰竭及其他并发症。该团队之后用骨髓干细胞由外周静脉输入2例PBC和4例AIH患者体内治疗,患者的肝功能并未好转甚至出现了2例死亡[36]。以上结果提示利用干细胞治疗免疫相关ESLD还需谨慎。
最后,针对其他原因(如药物性肝炎、遗传性肝病、特发性肝病等)导致的ESLD,干细胞疗法亦有可喜的成效。通过将自体BM-MSC或G-CSF动员后的干细胞直接经肝脏注射治疗后,患者未出现明显不良反应,肝功能和相关评分均得到改善[52]。对于非病毒性肝炎引起的肝硬化失代偿期患者而言,自体BM-MSC移植后血清白蛋白水平和MELD评分改善显著[53]。而对BM-MSC-Exo的治疗作用仍处在基础研究阶段,暂时没有相关临床研究报道。
4干细胞治疗ESLD的问题
尽管干细胞治疗ESLD取得了不错的成果,细胞治疗肝病是一条新的极有前景的道路,但仍有太多问题亟待解决。
4.1 干细胞转分化为HLC及肝脏归巢机制不明
干细胞治疗机制不明一定程度上是由于缺乏对移植细胞的有效定位手段,无法得知干细胞肝脏归巢及向HLC详细转化的过程。此外,长期培养MSC会降低其分化能力[54]。由于BM-MSC在肝脏受损时会自发向肝脏归巢,如果清楚其归巢的条件及促进肝脏内源性再生的机制就能避免BM-MSC移植的弊端,这是今后极具挑战和富有意义的研究方向。
4.2 干细胞移植的安全性无法完全保证
2019年的一项评估MSC致瘤性的研究[55]并未发现对照组和BM-MSC输注组肿瘤发病率存在差异,但之前有研究[56]观察到BM-MSC在体外培养时会发生染色体畸变。除致瘤可能导致移植风险外,由于干细胞移植是有创操作,在此过程中就存在传播病毒的风险,如巨细胞病毒、单纯疱疹病毒和细小病毒B19等。
4.3 不同来源干细胞质量无法保证
每种来源的干细胞都有各自的优势和不足,如何选择哪种干细胞适合用作移植?首先要建立一套统一的干细胞质量评价体系。其次,如何通过对干细胞预处理来优化待移植干细胞的总体质量?有必要对干细胞的分离钝化流程进行标准化,并借用相关技术来提升干细胞活性,如基因编辑、G-CSF动员或选用相关细胞因子诱导,这些都有赖于基础实验的突破来为临床提供正确的指导。
4.4 干细胞使用缺乏标准化导致临床研究质量参差不齐
干细胞在临床试验中的使用未经标准化,包括适应证和禁忌证、最佳注射途径、注射剂量、注射次数等。从现有的临床研究中总结来看:纳入对象包括各种病因引起的ESLD,缺乏同质性;单次注射干细胞数量跨度太大,范围在105~109,部分研究按体质量计算单次注射量;随访时间多为2~12个月;输注途径主要有外周静脉和肝脏注射(肝动脉或门静脉),部分研究通过脾脏注射。相关动物研究[57]提示由外周静脉输注的MSC相当一部分都滞留在肺部,远不如由门静脉注射的疗效好。而通过门静脉和肝动脉输注干细胞的归巢效率分别为小于5%和20%~30%,所以可能肝动脉是最佳的输注途径[58],但也有研究[29]显示不同注射方式之间的疗效没有显著差异。以上现象导致大多数的临床实验质量参差不齐,难以获得足够的高质量研究得出可靠的结论。同时,缺乏横向对比,如探究不同注射方式、注射剂量的疗效有无差别,且其长期疗效缺乏足够的临床事实肯定。
5展望
当前,肝移植是治愈ELSD的唯一手段,但由于肝源缺乏等问题导致等待肝移植患者的死亡率逐年升高。在此形势下,众多的临床研究结果表明,干细胞治疗已经展现出了极大的潜力。其中,关于MSC的研究最多,大多数结果均肯定了其短期改善肝功能的疗效,表现为肝脏血清学指标的改善、临床症状的缓解、肝脏相关评分的好转、肝脏病理表现有所恢复,且很少发现和其相关的严重不良反应。UC-MSC在HBV相关肝硬化人群中的长期疗效已经得到证实,但其他种类的干细胞在各类ELSD患者中的长期疗效还未有充足的临床证据;对于少数由于注射干细胞出现的不良事件,提示未来需要更加谨慎地评估相关人群的干细胞治疗条件。这不仅依赖于临床研究中对MSC使用过程进行标准化来增加研究结论的可靠性,还需基础实验领域对MSC治疗肝病的作用机制研究有进一步的突破,包括体内归巢、实现抗纤维化和免疫调节的具体通路和调控方式。
目前关于BM-MSC的研究主要集中在如何提高其治疗ESLD的效果,可以增加MSC本身的数量或功能,包括用细胞因子对MSC预处理,或进行基因编辑、富集分选等。值得一提的是,有学者[59]发现某些中药可以增强BM-MSC的分化能力,相比于其他处理手段更加安全和廉价,有望成为MSC移植的潜在辅助手段。相比之下,Exo由于体积更小,更易获取,膜蛋白数量更少所以免疫排斥性要小于BM-MSC;且其本身为膜结构,致瘤可能性比MSC更小,安全性更高;还可以直接跨膜传递信息,调控损伤肝细胞的修复和再生过程,是非常好的药物治疗载体,所以通过提高MSC-Exo的分泌数量达到可观的治疗效果是今后针对ELSD极有前景的治疗方法之一。目前已有一些方法可以提高Exo的分泌数量,如正切流动过滤法(TFF)可以比单纯的超速离心大大增加Exo的数量,超声降解更是可以将其产量提高到20倍[60],还有3D培养、利用特殊介质如海藻酸水凝胶对MSC进行培养等[61]。早在2015年我国就颁布了《干细胞临床研究管理办法(试行)》[62],在制度的规范下,还需开展大规模的多中心临床随访研究保证其用于人体的安全性和有效性,相信不远的未来干细胞治疗会给更多的ESLD患者带来福音。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.05.003
引证本文
冯宇, 陈俊峰, 林炳亮. 间充质干细胞治疗终末期肝病的临床研究进展[J]. 临床肝胆病杂志, 2023, 39(5): 1010-1018
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言