一文尽览:国内干细胞药物注册申报进展
2023-03-22 干细胞者说 网络 发表于上海
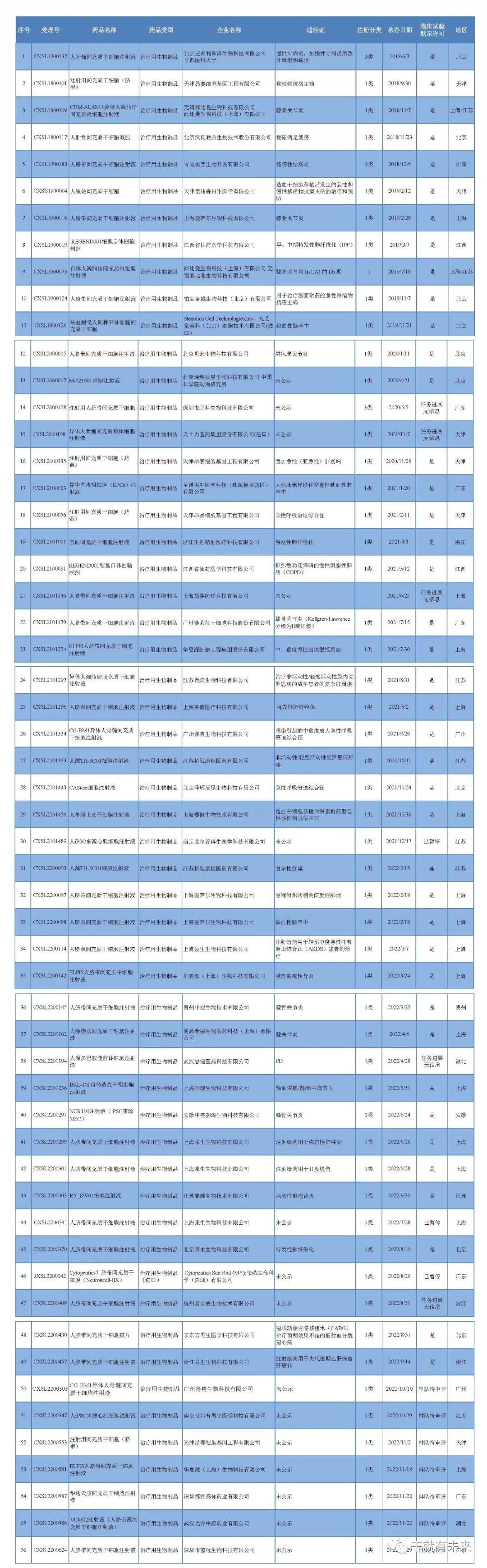
国内共有42家企业(不含子公司)的62款干细胞药物临床试验申请(IND)获得受理,共有30家企业(不含子公司)的47款获准默许进入临床试验(临床试验默示许可)
截至2023年2月28日,国内共有42家企业(不含子公司)的62款干细胞药物临床试验申请(IND)获得受理,共有30家企业(不含子公司)的47款获准默许进入临床试验(临床试验默示许可)。62款受理干细胞药物中有8款已无法查到IND评审信息或评审暂停,7款正在评审中。
2月份,新增3家企业的4种干细胞药物临床试验申请获得受理,新增3款干细胞药物通过默示许可,新增受理及默示许可均为间充质干细胞。
2023年2月1日与2023年2月7日,北京泽辉辰星生物科技有限公司“CAStem细胞注射液”(人胚干细胞分化而来的类间充质干细胞)的2项药物临床试验申请获受理(受理号分别为:CXSL2300072、CXSL2300091)。这是该干细胞注射液的第2和第3种适应证,此前急性呼吸窘迫综合征的临床试验申请已于2021年11月24日获得受理(受理号:CXSL2101443),目前处于CDE审评阶段。
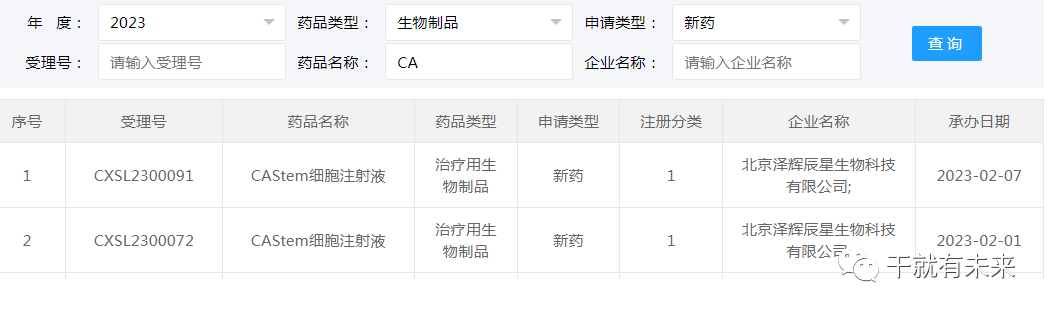 ▲图片来源:CDE官网
▲图片来源:CDE官网2023年2月15日,北京贝来生物科技有限公司“人脐带间充质干细胞注射液”的药物临床试验申请获受理(受理号:XSL2300129)。这是该干细胞注射液的第3种适应证,此前已获得默示许可用于类风湿关节炎(受理号:CXSL2000005)和特发性肺纤维化(受理号:CXSL2200370),目前处于CDE审评阶段。
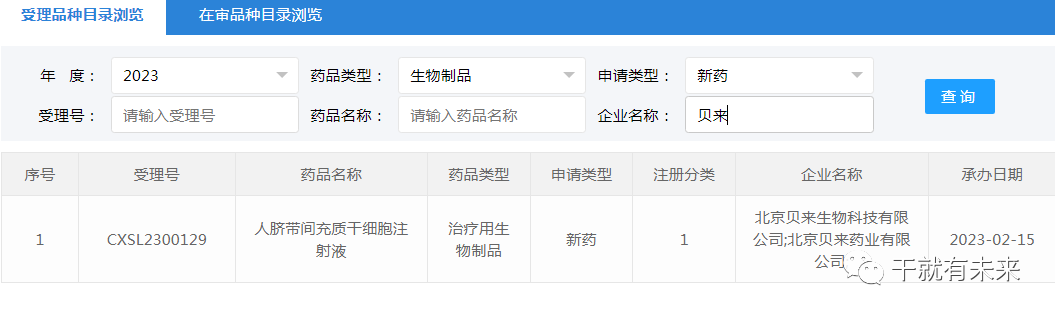 ▲图片来源:CDE官网
▲图片来源:CDE官网2023年2月23日,苏州拓华生物科技有限公司“人脐带间充质干细胞注射液”的药物临床试验申请获受理(受理号:CXSL2300152)。这是该干细胞注射液的第1种适应证,目前处于CDE审评阶段。
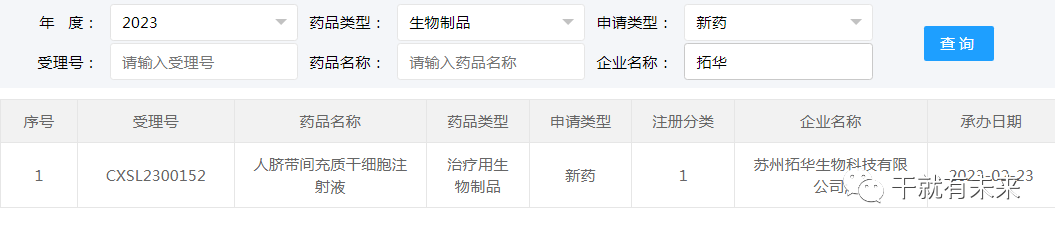 ▲图片来源:CDE官网
▲图片来源:CDE官网▉ 干细胞药物新增默示许可
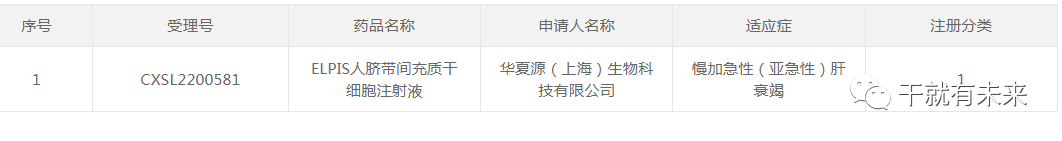 ▲图片来源:CDE官网
▲图片来源:CDE官网
 ▲图片来源:CDE官网
▲图片来源:CDE官网

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言