临床试验中的人类遗传资源优化流程第二版
2019-03-21 木木君 临床研发资讯微信号
在2016年10月发布了一期临床试验的遗传办及其操作流程之后,对各位小伙伴提供了少许帮助,本来以为这个申报流程不会成为常态或维持不久。但2017年12月1日起,科技部优化了一个遗传办的申报流程,那么基本上可以肯定遗传办的申报工作会在相当长的一段时间内,为推动临床试验事业的发展有着积极正面的影响。定位清晰了,我们就认真对待,@木木君根据人类遗传办的优化流程来更新一下人类遗传资源的申报。 人类遗
在2016年10月发布了一期临床试验的遗传办及其操作流程之后,对各位小伙伴提供了少许帮助,本来以为这个申报流程不会成为常态或维持不久。但2017年12月1日起,科技部优化了一个遗传办的申报流程,那么基本上可以肯定遗传办的申报工作会在相当长的一段时间内,为推动临床试验事业的发展有着积极正面的影响。定位清晰了,我们就认真对待,@木木君根据人类遗传办的优化流程来更新一下人类遗传资源的申报。
人类遗传办的概括
其实人类遗传资源不是一个新鲜事物,我们第一版的时候也有解说过,在1998年的《人类遗传资源管理暂行办法》国办发[1998]36号有定义过:人类遗传资源是指含有人体基因组、基因及其产物的器官、组织、细胞、血液、制备物、重组脱氧核糖核酸(DNA)构建体等遗传材料及相关的信息资料。
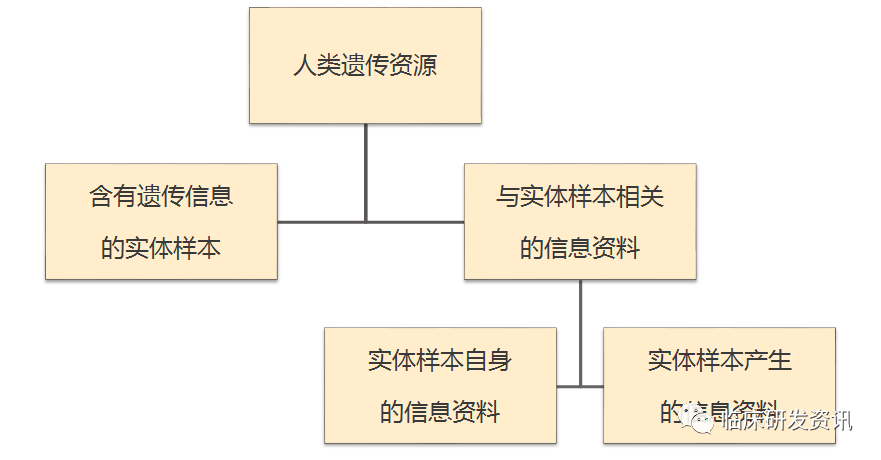
上图是在各大遗传办培训论坛中都会出现的,但的确很能标明遗传信息与实体样本及实体样本相关信息的关系。
《人类遗传资源管理暂行办法》国办发[1998]36号适用于对在中国境内从事的中国人类遗传资源采集、收集、买卖、出口、出境等事项的规范和管理。

与我们临床试验项目相关的,就是收集行为,当然也有涉及转移到境外的出口出境的项目,但估计这个大环境下能免则免,少之又少了。需要注意的是以临床诊疗、采供血(浆)服务、司法鉴定、侦查犯罪、兴奋剂检测和殡葬等为目的的人类遗传资源采集、收集、出口、出境活动,按照国家相关法律法规管理,不在该许可的适用范围内。
但2017年12月1日起,为获得相关药品和医疗器械在我国上市许可,利用我国人类遗传资源开展国际合作的临床试验按优化流程审批。其中药品临床试验包括I期、II期、III期以及生物等效性临床试验。
优化流程和原流程(下文称原流程,以区分优化流程)有什么区别呢?
从申报主体上,优化流程做了细化,哪些项目需要申报遗传办批件呢?这个问题得到了解决:非中国大陆的组织、企业、个人设立的境内外机构属于外方单位,其参与的临床试验项目是需要涉及遗传办申报,申报主体由其与临床中心机构协商谁来申报。

在审批条件上,优化流程鼓励由组长单位一次性申报,一来是简化伦理审批时间,二来是减少遗传办审批的工作量。但@木木君认为对于鼓励的认可组长单位伦理审批不用重复审查的实际意义不大。为啥?伦理审查时需要收取费用,另外放弃审查的话,长期以往如何保持研究机构的审查能力及存在必要性呢。

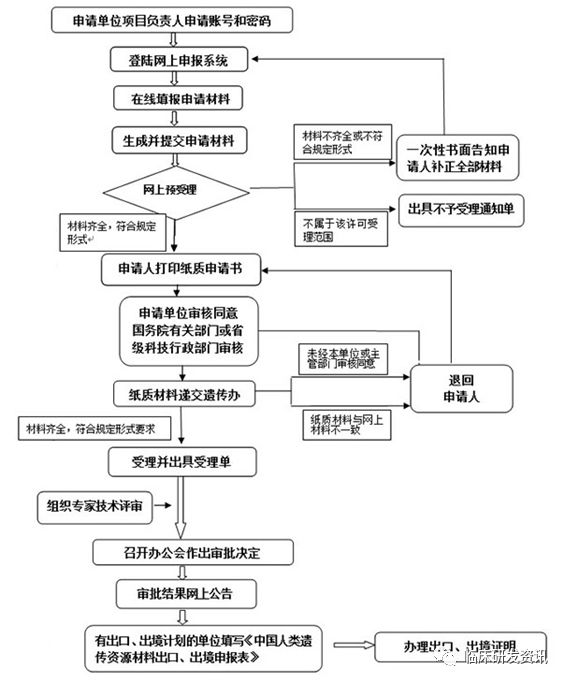
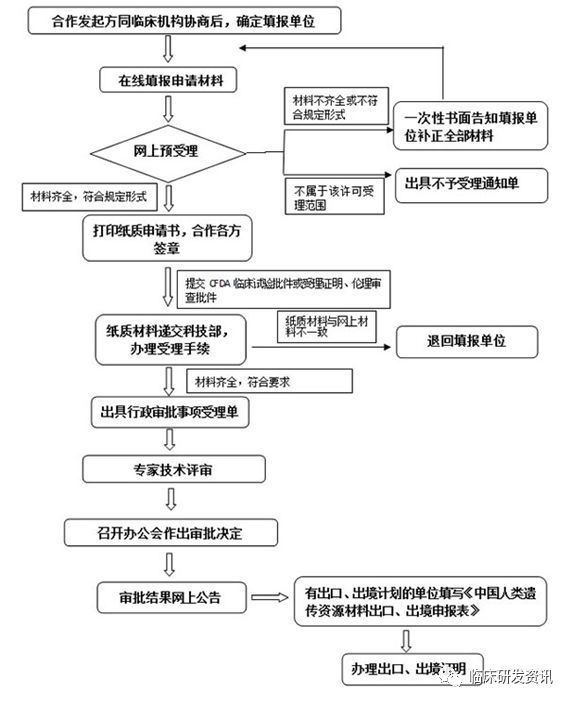
申报流程
在申报的总体流程上,其实变化不大,减少了主管单位的盖章。是否走优化流程,就要看这个研究是否以注册上市为目的,无论医疗器械还是药品,但如果涉及探索性为目的的部分,就需要具体分析了,一般是以是否以注册上市的原则来考虑。
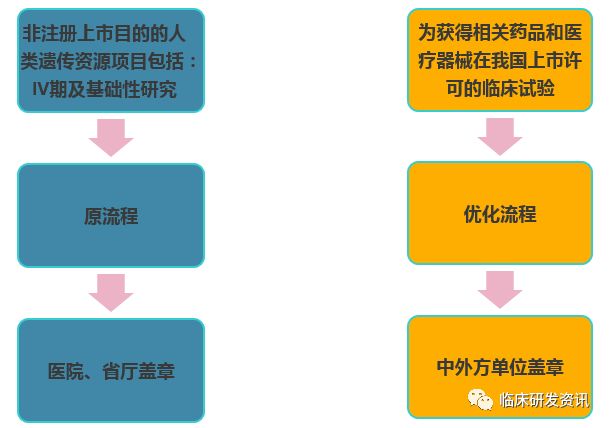
在细节流程上可以看到,在文件递交的先后上,优化流程是有所改变,为了就是让批件的申请可以放在纸质材料递交的时候再递交,这样网上形审可以提前进行。↓↓↓
| 原流程 | 优化流程 |
|
|
|
我们看文件的递交清单会更清楚:
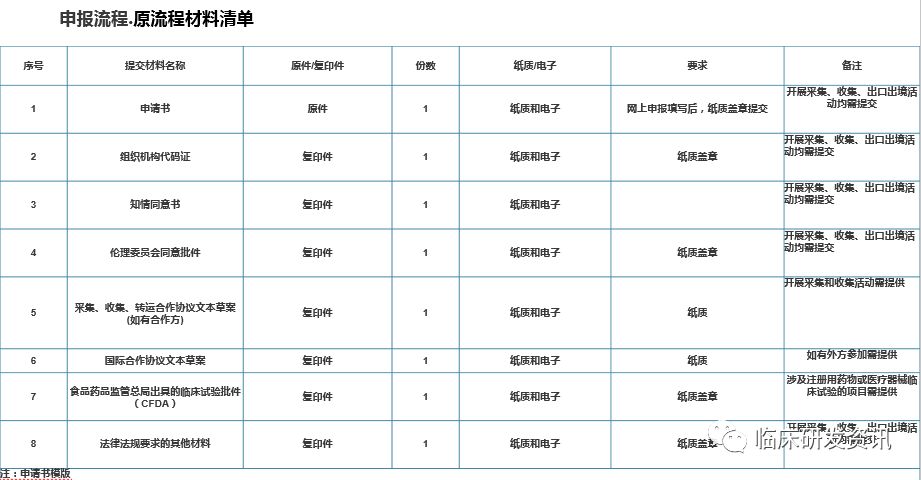
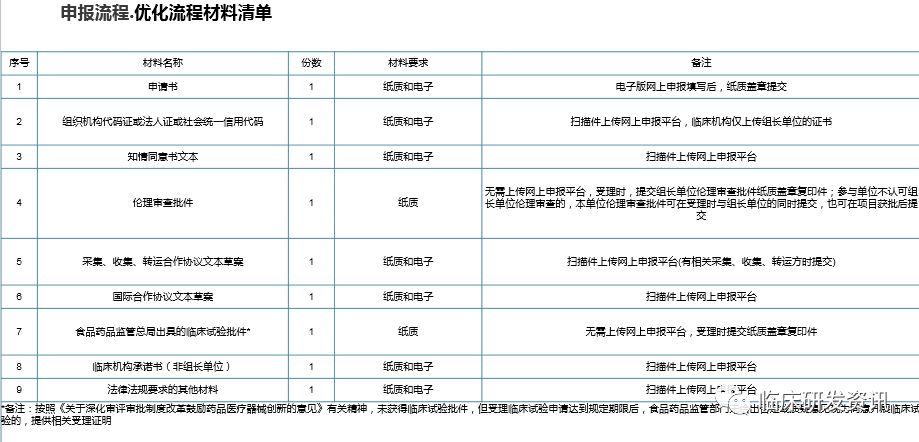
需要递交电子版即是需要网上形审,食药总局批件和伦理批件是可以在纸质递交时候再递交,但这不一定意味着可以先走网上审批,我们下面会讲到。
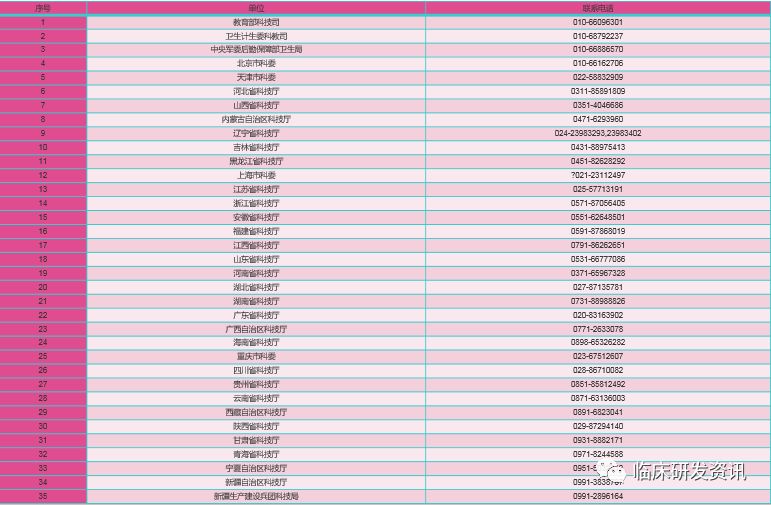
下面是各主管部门的联系方式:↓↓↓
申请人通过网上申请平台提交电子版申请材料,纸质材料可通过窗口报送或邮寄方式提交:
1.网上申请系统链接:https://168.160.10.149/;
2.窗口报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心);
3.邮寄报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心;邮编:100039;电话:010-88225151)。
办理时间:工作日8:30-11:30,13:30-16:30。
电话咨询:010-88225151,010-58881396;010-88659000(信息中心)
电话投诉:科技部政策法规与监督司 010-58881765
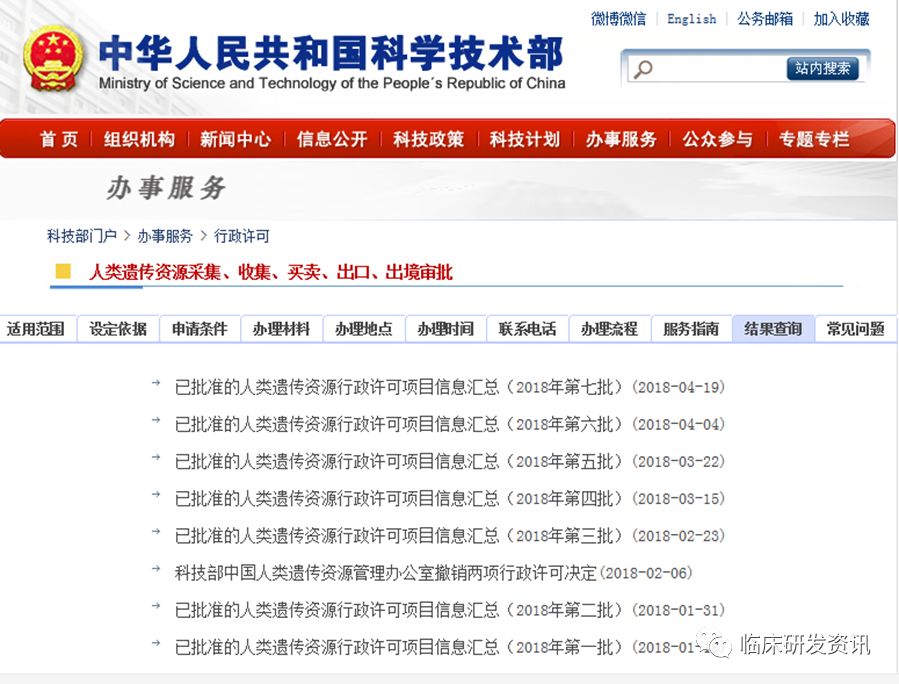
这里可以在技术部的结果查询一栏可以查得到:↓↓↓
好了,讲到这里,我们就可以开始实操动手来申报了,首先我们得有个账号,但是遗传办申报的账号分两类,两个账号的权限均不一样。
先登录http://program.most.gov.cn/ 申请账号↓↓↓
注册账号的时候,如果框没有公司名称,可能还涉及添加操作,具体致电010-88225151,需要提供工商资料;↓↓↓
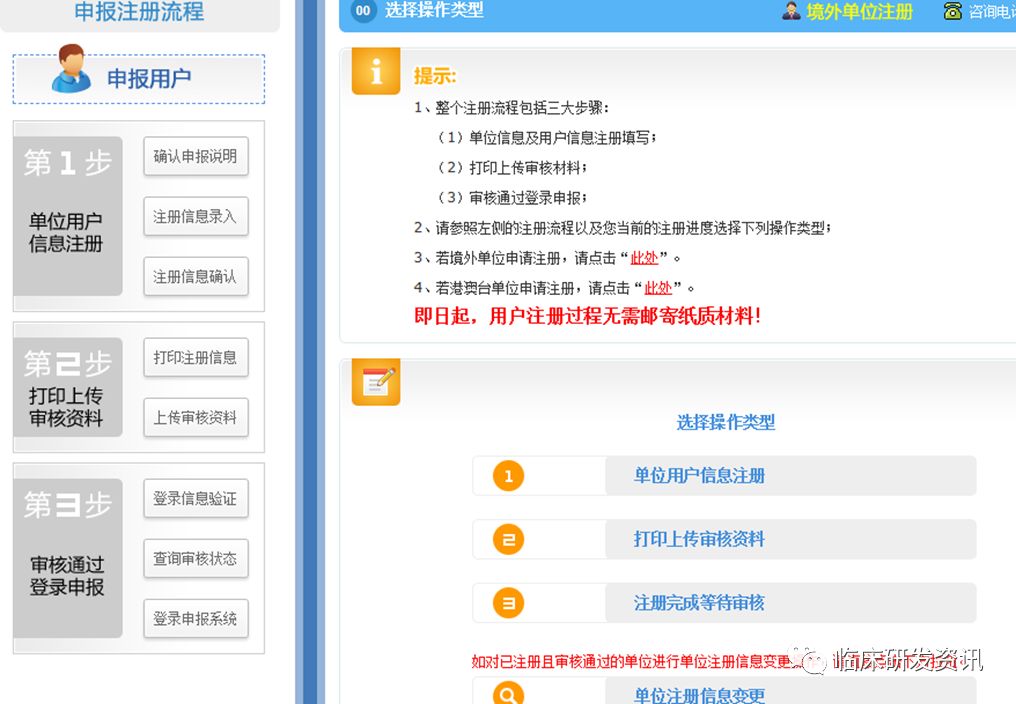
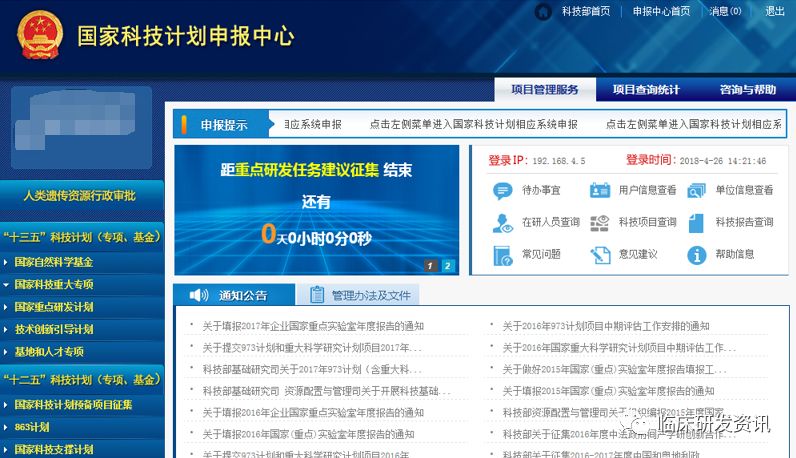
账号是分单位管理员角色和申报人角色,单位管理员负责授权申报人和创建提交项目;申报人负责填写项目申请信息,提交给单位管理员,由单位管理员提交给遗传办。
完成账号申请之后,进入https://168.160.10.149/进行项目申报信息填写。↓↓↓
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#遗传资源#
82