Cell Stem Cell:关键酶揭开骨骼衰老背后的秘密
2021-02-18 网络 网络
来自加州大学洛杉矶分校牙科学院的研究人员已经确定了一种在骨骼老化和骨骼丢失中扮演重要角色的关键酶,这使他们在了解导致骨质疏松症的复杂生物学机制方面又迈进了一步。
骨质疏松症是一种折磨着全世界约2亿人的骨骼疾病。骨骼老化是一个复杂的过程,其特征是骨形成减少,骨髓脂肪增加,干细胞衰竭。
近日,有研究人员发现了一种与骨骼老化和骨骼丢失有关的关键酶,他们在老鼠上进行的研究结果发表在《细胞干细胞》(Cell Stem Cell)杂志上,他们说,这一发现可能对开发更有效的骨质疏松症治疗方法和改善老龄人口的生活具有重要意义。

骨髓中被称为间充质干细胞的细胞是人体骨骼组织的组成部分,但这些干细胞最终是发育成骨组织还是脂肪组织,在一定程度上受表观遗传因素的控制,即调节基因的分子,使一些基因沉默,另一些基因激活。
这项加州大学洛杉矶分校的研究人员由著名教授、牙科学院口腔生物学系主任Cun-Yu Wang博士领导,他们证明,当间充质干细胞缺少表观遗传因子KDM4B时,这些细胞分化为脂肪细胞的可能性远远大于骨细胞,从而导致不健康的失衡,加重骨骼肌的损伤随着时间的推移,老化会导致骨骼变脆和骨折。
虽然科学家们很早就知道骨组织形成的细胞途径,但表观遗传因素的作用却不太清楚。Wang等人之前的研究发现,KDM4B酶在骨形成过程中发挥着重要的表观遗传学作用,但他们不确定它的缺失会如何影响骨形成和骨丢失的过程。
为了验证这一点,研究团队创建了一个小鼠模型,其中KDM4B在几个不同的场景中不存在或被删除。他们发现,去除这种酶促使间充质干细胞产生更多的脂肪而不是骨组织,随着时间的推移导致骨骼丢失,从而模拟骨骼老化。
在一个重要的场景中,科学家们研究了干细胞的衰老、退化和衰竭,这是间充质干细胞随着时间的推移停止再生或自我复制的自然过程。研究小组意外地发现,导致骨骼自然老化的衰老以KDM4B的缺失为特征。
除了年龄,其他环境因素被认为会降低骨骼质量,加剧骨质流失,包括高脂肪饮食。研究小组证明,KDM4B的缺失显著促进了高脂饮食小鼠的骨丢失和骨髓脂肪的积累。
最后,研究小组发现甲状旁腺激素——一种被美国食品和药物管理局批准用于治疗衰老相关骨丢失的合成代谢药物,有助于以KDM4B依赖的方式维持衰老小鼠的间充质干细胞库。
在本研究中,研究人员报道间充质基质细胞(MSCs)中KDM4B的丢失通过增加H3K9me3减少骨形成和增加骨髓脂肪而加重骨骼老化和骨质疏松。KDM4B表观遗传协同β-连环蛋白/Smad1通过去除抑制性H3K9me3介导转录。
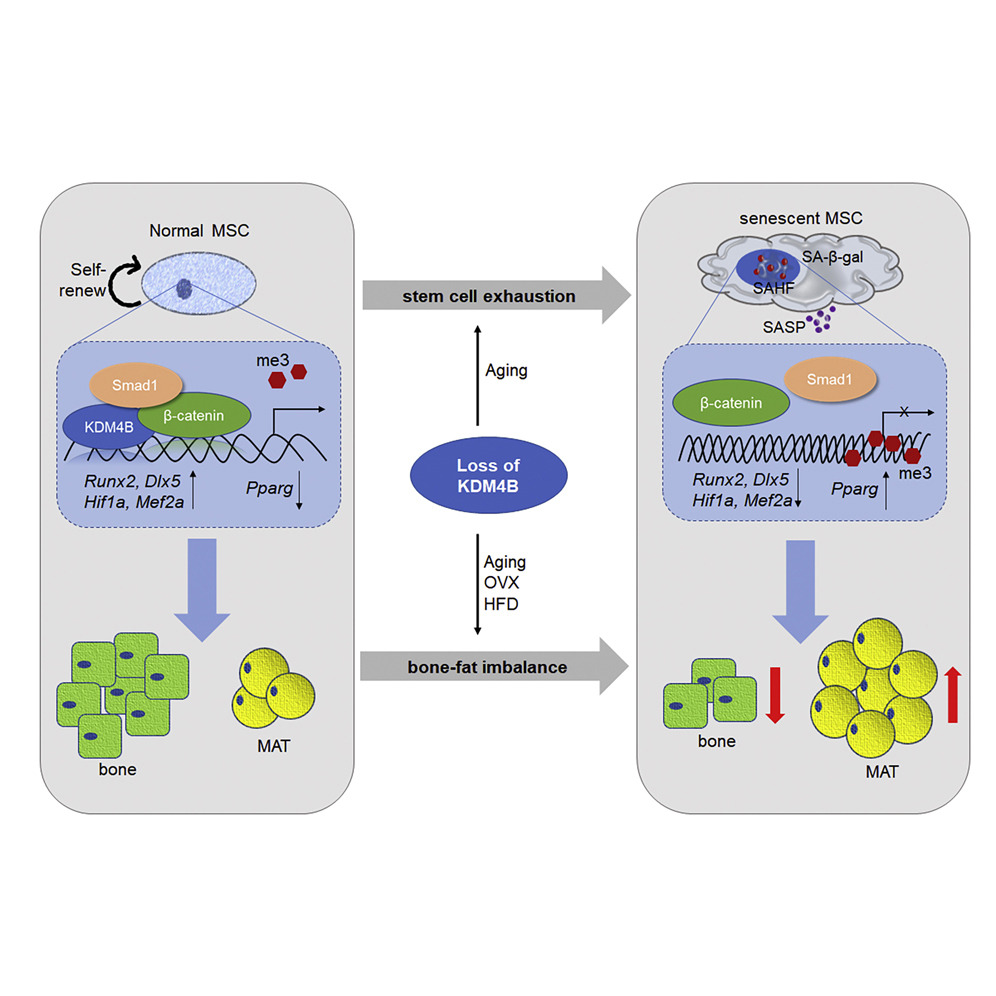
原理示意图
研究结果不仅证实了KDM4B在间充质干细胞命运决定、骨骼衰老和骨质疏松症中发挥的关键作用,而且还表明在许多情况下KDM4B的缺失会加剧骨丢失,更令人惊讶的是,KDM4B控制间充质干细胞的自我更新能力。本研究是首次在体内研究,证明表观遗传因子的丢失促进骨骼衰老中的成体干细胞退化和衰竭。
参考文献:Peng Deng, Quan Yuan, Yingduan Cheng, Jiong Li, Zhenqing Liu, Yan Liu, Ye Li, Trent Su, Jing Wang, Mari Ekimyan Salvo, Weiguang Wang, Guoping Fan, Karen Lyons, Bo Yu, Cun-Yu Wang. Loss of KDM4B exacerbates bone-fat imbalance and mesenchymal stromal cell exhaustion in skeletal aging. Cell Stem Cell, 2021; DOI: 10.1016/j.stem.2021.01.010
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#Cell#
68
#stem cell#
81
#骨骼衰老#
94
骨骼衰老
105
#CEL#
61
#STEM#
66