CIRCULATION:MDM2调节HIF信号导致肥厚性心肌病的微血管功能障碍
2023-10-28 Jenny Ou MedSci原创 发表于上海
本文结果表明,肉瘤突变在疾病的早期阶段诱导心肌细胞MDM2信号传导,这导致心肌微环境的长期变化。
肥厚性心肌病(HCM)是一种以左心室(LV)心肌病理性增厚为特征的疾病 人类的心脏衰竭和猝死HCM在人类中的患病率约为1:500,并且已证明肌瘤蛋白基因突变可引起该病。HCM中最常见的突变基因是MYBPC3(心肌肌球蛋白结合蛋白C)和β -肌球蛋白重链 (MYH7)和这两个基因的突变约占突变阳性HCM病例的80%。

HCM引起心肌肥大的原因是人类在童年或成年时期心肌细胞生长增加。然而,HCM的病理性心室重构也与非心肌细胞心肌细胞群的变化有关。微血管功能障碍(MVD)是如何继发于多个不同器官(如脑、肾、视网膜、皮肤、肺和心脏)的毛细血管床异常的,目前尚不完全清楚。MVD已经在许多不同形式的继发于缺血性和非缺血性病因的人类心肌病中得到了一致的鉴定。从机制上讲,MVD通常涉及促血管生成和抗血管生成因子的不平衡,这对毛细血管的形成和维持至关重要。
例如,促血管生成因子(如VegfA(血管内皮生长因子A)和血管生成素)的表达减少以及抗血管生成因子血管生成素和血栓反应素的产生增加,诱导继发于压力过载的毛细血管稀疏。然而,调控HCM中MVD发展的分子机制仍不明确。 肥厚前病变间期是HCM发展的关键时期。研究人员假设MVD的发生是继发于心肌细胞信号的改变,而心肌细胞信号的改变是在肥厚发生之前发生的。
为了探索这些问题,2023年10月27日发表在CIRCULATION的文章,使用HCM的多个肉瘤基因突变动物模型来评估微血管生长和功能障碍,同时探索调节这些表型的关键分子机制。然后,研究人员研究了靶向这些途径是否足以阻止临床前HCM模型中MVD的发展。
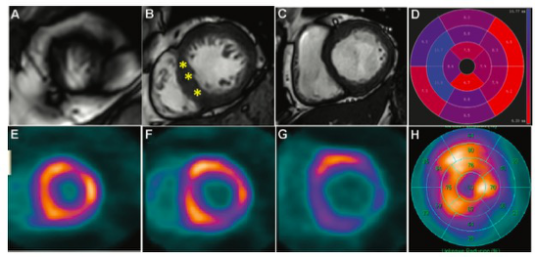
研究人员使用多模态成像方法来追踪肌瘤基因Mybpc3(心肌肌球蛋白结合蛋白3)或Myh6(肌球蛋白重链6)突变的HCM小鼠模型微血管功能障碍的时间。研究人员采用互补的分子方法来评估蛋白质数量、相互作用和翻译后修饰,以确定调节这种反应的机制。研究人员使用遗传和药理学方法在体内操纵选择的分子途径来验证这些机制。

MDM2的化学抑制可以防止2个不同HCM模型中的微血管功能障碍
研究结果显示,发现HCM模型的微血管功能障碍继发于产后早期心肌毛细血管生长减少,可能发生在心肌肥厚发生之前。本文发现E3泛素蛋白连接酶MDM2(小鼠双分钟2)通过典型和非典型机制动态调节HIF1α(缺氧诱导因子1α)和HIF2α(缺氧诱导因子2α)/EPAS1(内皮PAS结构域蛋白1)的蛋白稳定性。在心肌毛细血管生长的关键时期,HIF失衡导致促血管生成基因表达减少。在两种HCM模型中,通过遗传或药理学方法降低MDM2蛋白水平可使HIF蛋白水平正常化,并阻止微血管功能障碍的发展。
综上所述,本研究结果表明,肌瘤突变引起心肌细胞MDM2信号异常,甚至在心肌细胞肥大发生之前就可能发生。重要的是,出生后心肌细胞MDM2信号的早期病理改变导致成年动物心肌微环境的持续变化。本研究强调了在疾病发展的早期阶段靶向HCM的重要性,以成功预防该疾病中心肌的长期病理性重构。
原文出处
Shridhar P, Glennon MS, Pal S, Waldron CJ, Chetkof EJ, Basak P, Clavere NG, Banerjee D, Gingras S, Becker JR. MDM2 Regulation of HIF Signaling Causes Microvascular Dysfunction in Hypertrophic Cardiomyopathy. Circulation. 2023 Oct 27. doi: 10.1161/CIRCULATIONAHA.123.064332. Epub ahead of print.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言