首例:KHDRBS1-NTRK3融合儿童血管肉瘤拉罗替尼治疗获持久完全缓解
2024-01-30 苏州绘真医学 苏州绘真医学 发表于陕西省
本文首次描述了携带可靶向NTRK3融合的儿童血管肉瘤病例,并首次在儿童血管肉瘤中靶向该变异。
在过去十年中,由于治疗和诊断策略的进展,儿童癌症的生存率有了显著提高。然而,疾病进展和复发仍然是儿童血管肉瘤临床管理的重大挑战。使用高通量测序技术对这些罕见肿瘤进行全面的基因组分析可以改善患者分层,识别可操作的生物标志物,进行治疗干预。本文描述了一例精准治疗病例,展现了患者的临床、组织病理学、免疫组化和分子特征,患者使用NGS检出 KHDRBS1-NTRK3 融合,导致持久完全缓解(临床和影像学反应)。这是文献中首个携带可靶向 NTRK3 融合的儿童血管肉瘤,以及首个使用拉罗替尼(一种 NTRK 抑制剂)靶向血管肉瘤中该变异的病例。患者在不到2个月的治疗中实现了临床和影像学缓解,目前拉罗替尼治疗已结束 4 个月,仍处于完全缓解状态。在超过 17 个月的拉罗替尼治疗期间,仅报告了轻微的副作用。这一独特的儿童血管肉瘤病例将传统病理学与为什么、何时、如何检测罕见致癌驱动基因变异和泛癌种生物标志物相结合,体现了精准治疗。
背 景
软组织肉瘤是一组具有异质性的间叶源性恶性肿瘤,约占所有儿童恶性肿瘤的 8-10%,其中 0.3% 为血管肉瘤。儿童血管肉瘤是高度侵袭性的恶性肿瘤,对常规治疗缺乏反应,与预后不良相关。由于原发性血管肉瘤的异质性分子特征,Angiosarcoma Project等合作研究在该肿瘤实体的分类和新型靶向疗法的应用方面发挥着不可或缺的作用。然而,该项目关注成人血管肉瘤,对儿童血管肉瘤分子检测和靶向治疗应用的了解较少。原肌球蛋白受体激酶(Trk)家族由 TrkA、TrKB 和 TrKC 跨膜受体组成,其分别由 NTRK1、NTRK2 和 NTRK3 基因编码。NTRK基因融合是泛癌种生物标志物,与几种成人和儿童实体瘤相关。2018 年,FDA 批准了 TRK 激酶小分子抑制剂,无论肿瘤实体、患者年龄和体能状态,均表现出疗效。此外,由于下一代测序(NGS)成本降低及其在临床中的常规应用,关于携带 NTRK 融合的肿瘤(可使用 TRK 抑制剂靶向)的信息不断增多,增加了对罕见肿瘤的了解,能够对临床上具有挑战性的肿瘤进行精准治疗。本文首次描述了携带可靶向NTRK3融合的儿童血管肉瘤病例,并首次在儿童血管肉瘤中靶向该变异。
病 例
临床表现
一名 8 个月大的女童因危及生命的呼吸道症状看家庭医生。1周后,双侧胸腔积液和随后的肺不张引起低氧血症和呼吸困难,住进 ICU。放置双侧胸腔引流管,从双侧引流200ml液体。每2-3天出现大量胸腔积液,需要多次引流。2021年1月22日,MRI显示气管、咽部、上纵隔、胸膜、胸壁和双侧胸腔积液周围存在浸润性病变。对颈部软组织活检和胸腔积液抽吸样本进行组织学、细胞学和免疫组化检查,诊断为儿童血管肉瘤,形态学 2 级。诊断时,治疗策略有限。从临床角度来看,患者病情危重,由于疾病的程度和儿童的年龄,局部治疗后没有治愈选择。基于常规病理诊断和肿瘤的侵袭性行为,2021年2月4日至2021年4月8日期间,采用 Cooperative Weichteilsarkom Studiengruppe(CWS)-2012 化疗方案;考虑到患者的年龄,最初未使用紫杉醇,接受了 2 个疗程的长春新碱-阿霉素-环磷酰胺(VAC)。然而,由于临床状况和液体量增加,根据肿瘤委员会的决定,迅速启动了 4 个周期的紫杉醇治疗。紫杉醇治疗仅观察到中度临床和影像学反应,患者需要长期引流和重症监护。
细胞学和组织病理学检查
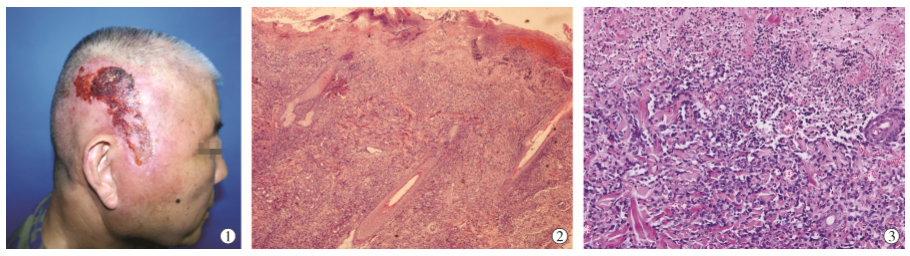
胸腔积液标本:观察到分离的非典型肿瘤细胞,有时呈小簇状排列。免疫组化显示Vimentin和ERG阳性,WT1和CAMTA1阴性。INI1(SMARCB1)保留。这些结果提示血管肉瘤(图1)。组织学(颈部/胸膜区域活检):观察到吻合血管间隙,有非典型扁平多层内皮细胞内衬,浸润脂肪和横纹肌。免疫组化显示强ERG核阳性和CD31细胞质阳性(图1)。细胞角蛋白(AE1-AE3)和CD34阴性,未观察到WT1和CAMTA1核阳性。Ki-67增殖指数为20%。INI1(SMARCB1)保留,排除了横纹肌样肿瘤(该年龄段最常见的儿童软组织恶性肿瘤之一)的可能性。缺乏特征性胞浆内空泡和 CAMTA1 核免疫阳性,排除了上皮样血管内皮瘤。诊断为血管肉瘤(2 级)。
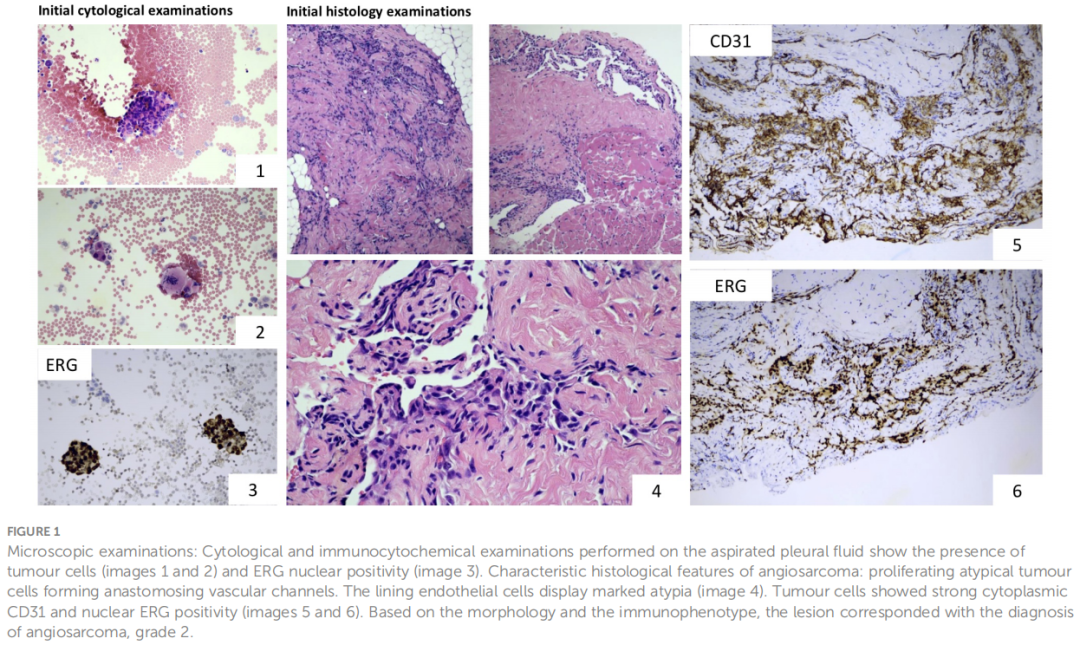
图1
全面基因检测
从福尔马林固定石蜡包埋样本中提取DNA和RNA,进行全面的NGS检测。发现BRCA1(c.3700_3704delGTAAA,p.V1234fs*8)和RNF43(c.1976delG,p.G659fs*41)基因小片段插入/缺失(InDel)或单核苷酸变异(SNV)。检测到ALK、RET、FGF3、FGF6、EGFR、FGF4、BRCA2和MYCL基因低水平(<5倍)扩增。检测到未在血管肉瘤中报道过的框内 KHDRBS1-NTRK3 基因融合,提供 TRK 抑制剂的治疗选择(图 2)。该融合通过荧光原位杂交得到验证(图 2)。
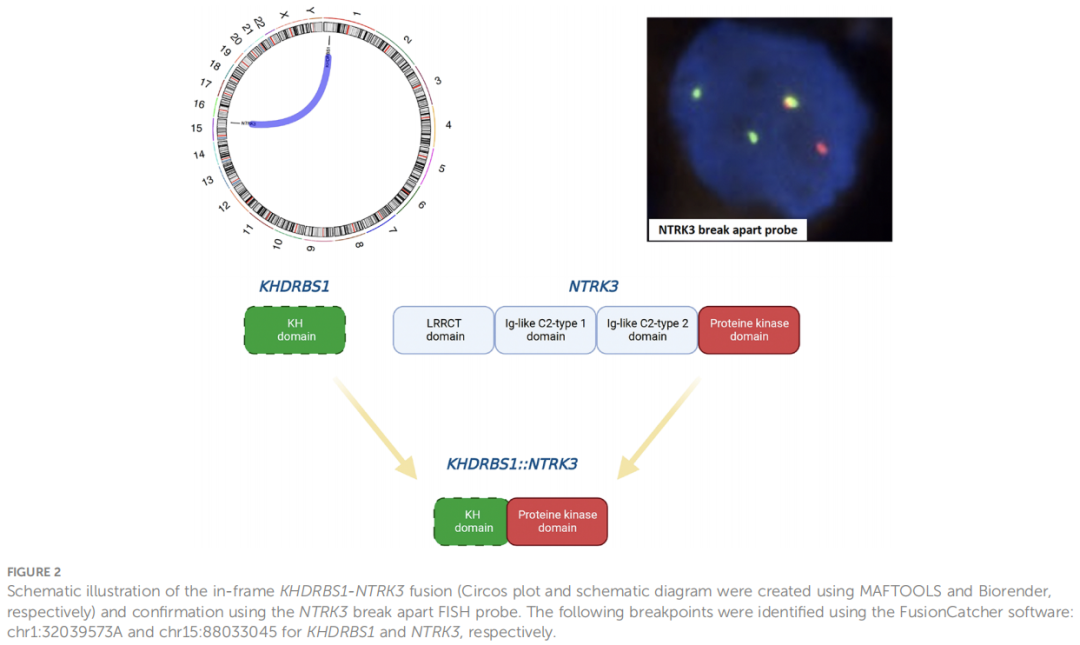
图2
分子靶向治疗和临床随访
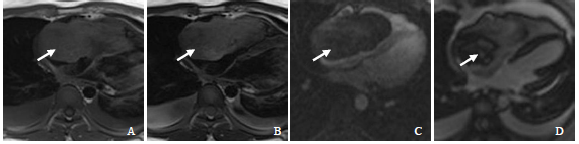
基于 KHDRBS1-NTRK3 融合,2021年4月21日,开始使用拉罗替尼(VITRAKVI)(口服 100 mg/m2,每日两次)。通过临床、神经学和影像学评估对患者进行监测。在常规随访检查中,对拉罗替尼治疗的临床反应很明显。就诊时,患者的 Karnofsky 体能状态评分较低,为 20,需要频繁引流广泛的双侧胸腔积液。治疗期间,Karnofsky 评分显著改善,化疗后为40,开始拉罗替尼治疗后1周内为90,出院回家,无需进一步引流。目前,患者已接受 17 个月的拉罗替尼治疗,体能状态为 100。报告了轻微副作用,发育正常,平均身高,体重增加。2022 年 5 月,观察到唯一的拉罗替尼副作用:2 级肝毒性。遵循CTCAE 4.03版方案,减少药物剂量,肝毒性得到解决。2022 年 7 月 12 日,患者再次接受全剂量。2022 年 9 月 19 日,完成拉罗替尼治疗,目前仍处于完全缓解(2023 年 1 月)。总体而言,对拉罗替尼有显著和持久的临床和影像学反应(图 3)。
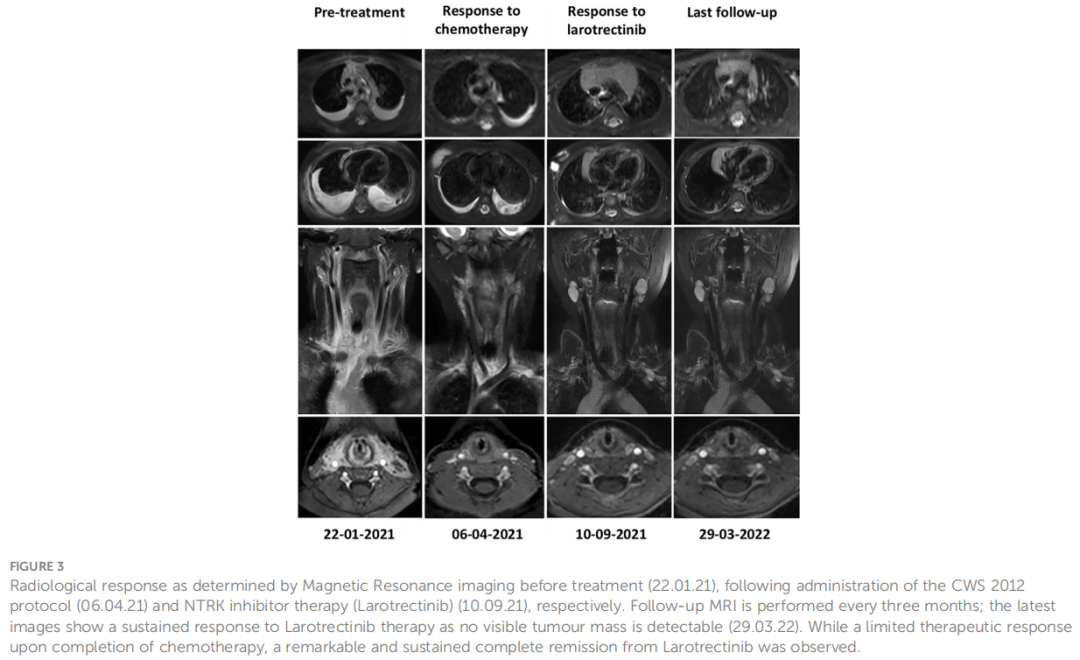
图3
讨 论
与成人血管肉瘤相比,儿童血管肉瘤极为罕见,行为具有侵袭性。CWS-2012 国际方案明确了治疗(化疗、局部手术和/或放疗)、诊断步骤、分期分类和随访方案。本病例中,由于肿瘤的范围和位置,局部治疗被排除;使用 CWS-2012 方案仅对化疗有中度反应。于是,进行基因检测,以识别可操作的变异,扩大治疗可能性。鉴于基因检测或靶向治疗在儿童血管肉瘤中的应用匮乏,这是一个前所未有的具有挑战性的病例,患者基于NGS基因检测结果进行了TRK抑制剂(拉罗替尼)精准治疗,获得持久临床反应。
在正常生理学中,神经营养因子是TRK配体,配体结合在几个关键功能中起着不可或缺的作用;神经元细胞的增殖和存活,中枢和周围神经系统的维持,以及行为、感觉、运动和认知的调节。NTRK基因融合是成人和儿童癌症中最常见的TRK致癌激活机制。根据经验,关于NTRK融合在儿童肿瘤中的发生率,在罕见肿瘤中常见,在常见肿瘤中罕见。尽管 2018 年 FDA 批准了 TRK 抑制剂治疗,但尚无已发表的关于 TRK 抑制剂在儿童血管肉瘤中的应用数据。此外,TRK抑制剂的临床成功、长期副作用和对这些抑制剂的持久反应,特别是在婴儿和儿童中,仅限于病例报道。幸运的是,仅有少数接受拉罗替尼治疗的患者报告了继发性耐药。大型队列临床试验显示,拉罗替尼在携带 NTRK 融合的成人和儿童肿瘤(局部晚期或转移性实体瘤,无论患者年龄、体能状态或肿瘤实体如何)中具有显著且持久的抗肿瘤活性。最近的证据表明,拉罗替尼在成人和儿童中耐受性良好,不良反应主要为 1-2 级。越来越多的研究探索了NTRK融合在儿童软组织肉瘤中的发生率和伴侣基因谱。在一例病例报道中,先天性 CD34+ 皮肤肿瘤检出 KHDRBS1-NTRK3 重排。然而,该患者未进行TRK抑制治疗。总体而言,这些不同的研究显示不同的发生率,很可能是由于可及诊断和转诊偏倚的差异。根据这些研究结果,这些临床上具有挑战性的罕见肿瘤进行基因检测对于识别可靶向用药生物标志物、改善患者分层和扩大治疗选择至关重要。
本病例展示了 TRK 抑制剂在儿童血管肉瘤中的首次应用。关于接受TRK抑制剂治疗的儿童患者的治疗持续时间或随访方案,没有相关指南,需要进一步的大规模试验。密切的临床和影像学评估,加上连续液体活检进行特异性微滴式数字PCR检测,可以监测残留病灶,评估所达到的缓解深度并识别复发或耐药突变。
儿童血管肉瘤是一种罕见的软组织肉瘤亚型,与预后不良和治疗选择有限相关。据我们所知,这是首例基于KHDRBS1-NTRK3 融合基因进行 NTRK 抑制剂精准治疗的儿童血管肉瘤病例,患者对治疗有反应。预后不良相关罕见儿童恶性肿瘤的常规NGS应用扩大了靶向治疗的形态学范围和临床相关性,尤其是在对常规治疗无反应的患者中。此外,这一独特的儿童血管肉瘤病例将传统病理学与为什么、何时、如何检测罕见致癌驱动基因变异和泛癌种生物标志物相结合,体现了精准治疗。
参考文献:
Cervi C, Sápi Z, Bedics G, Zajta E, Hegyi L, Pápay J, Dezső K, Varga E, Mudra K, Bödör C, Csóka M. Case report: Complete and durable response to larotrectinib (TRK inhibitor) in an infant diagnosed with angiosarcoma harbouring a KHDRBS1-NTRK3 fusion gene. Front Oncol. 2023 Feb 23;13:999810. doi: 10.3389/fonc.2023.999810. PMID: 36910630; PMCID: PMC9997097.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#血管肉瘤# #拉罗替尼#
68