病理干货 I 深度解读林奇综合征筛查与诊断
2023-11-07 上海阿克曼病理 上海阿克曼病理 发表于上海
林奇综合征是一种常染色体显性遗传的肿瘤综合征,其大大增加了结直肠癌、子宫内膜癌、卵巢癌、胃癌、小肠癌、泌尿肿瘤、胆道癌、脑癌等疾病的患病风险,其中结直肠癌、子宫内膜癌和卵巢癌更为常见。
林奇综合征(Lynch syndrome,LS)是一种常染色体显性遗传的肿瘤综合征,其大大增加了结直肠癌、子宫内膜癌、卵巢癌、胃癌、小肠癌、泌尿肿瘤、胆道癌、脑癌(通常是胶质母细胞瘤)等疾病的患病风险,其中结直肠癌、子宫内膜癌和卵巢癌更为常见。
LS由MMR(mismatch repair,错配修复)基因和EPCAM的杂合胚系致病变异引起。MMR基因主要包括 MLH1、MSH2、MSH6、PMS2,负责修复DNA复制过程中出现的错配变异。当MMR基因发生突变,修复功能容易缺失,使得DNA复制错误无法修复,DNA复制错误不断地累积,最终导致癌症的发生。MMR相关基因EPCAM缺失会导致MSH2启动子高度甲基化,引起MSH2基因沉默,进而引起LS。
LS既往的诊断主要依赖于家族史,国际上通用的Amsterdam诊断标准要求家系中需有3例以上确诊的LS相关肿瘤患者,但该标准在国内应用有一定的局限性,因此我国遗传性大肠癌协作组基于本国国情和研究结果,提出了中国人群LS家系标准用于临床诊断。
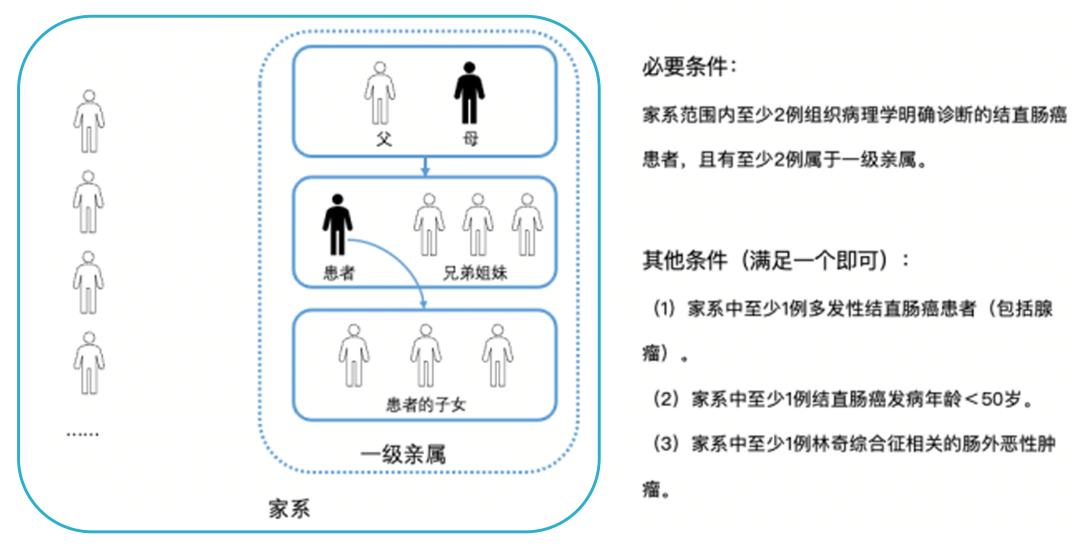
中国人群林奇综合征家系诊断标准[1]
对于符合以上临床诊断标准的个人均应进行LS相关的基因筛查,以便进一步明确遗传风险或病因,同时更好的指导疾病风险管理。此外,患LS相关肿瘤的患者,即使不满足上述临床诊断标准,但被检测出携带有胚系MMR基因致病突变,也可诊断为LS。
01 林奇综合征(LS)的筛查手段与路径
MMR蛋白表达检测及MSI(微卫星不稳定性)检测是LS的常用筛查手段。如果MMR蛋白表达缺失(dMMR)或微卫星不稳定性高(MSI-H)时,再进行诊断“金标准”—LS胚系基因检测做出诊断。此外,LS患者家族成员也推荐通过胚系突变检测进行筛查,以实现尽早预防。

图1 Lynch综合征家系遗传基因筛查方案
(引自CSCO指南[2])
02 MMR蛋白表达IHC检测
DNA错配修复蛋白(MMR蛋白)是指DNA在复制过程中整合错误的核苷酸,错配修复系统的功能是纠正DNA复制过程出现的错误。错配修复蛋白包括MutS和MutL两大家族,前者包括MSH2、MSH3和MSH6等,后者包括MLH1、MLH3、PMS1和PMS2。MSH2分别与MSH6、MSH3组成二聚体MutSα、MutSβ。MLH1则分别与PMS2、PMS1或MLH3形成二聚体MutLα、MutLβ或MutLγ。MLH1和MSH2是形成异源二聚体所必需的主体蛋白,PMS2和MSH6是配体蛋白,且PMS2只能与MLH1形成异源二聚体,MSH6只能与MSH2形成异源二聚体。
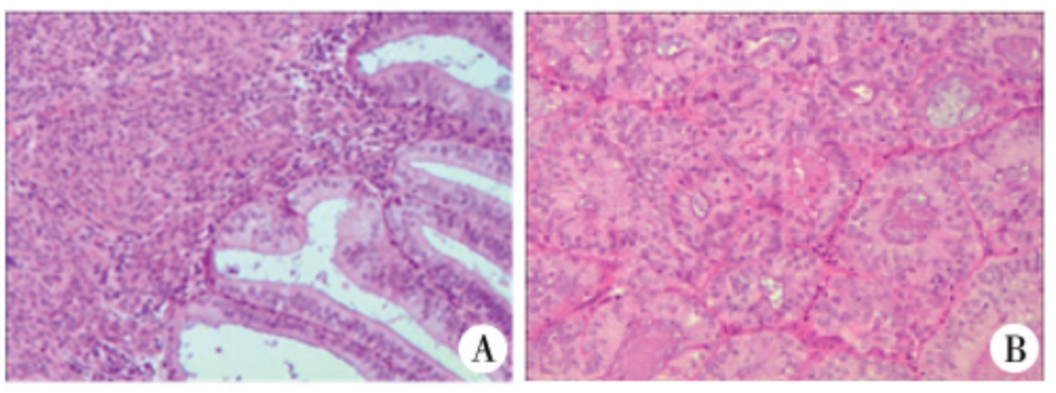
MMR基因中的大多数突变都会干扰蛋白二聚化,从而导致异源二聚体中主体蛋白和/或配体蛋白的降解。通常,MLH1突变导致的主体蛋白自身的降解会伴随配体蛋白PMS2的继发性降解;MSH2突变导致的主体蛋白自身的降解会伴随配体蛋白MSH6的表达缺失。相反,PMS2或MSH6突变可能不会导致配对主体蛋白的降解,因为在异源二聚体中,MSH6可被MSH3替代,而PMS2可被PMS1或MLH3替代。因此,IHC检测MMR蛋白表达时通常表现为MLH1和PMS2同时缺失,MSH2和MSH6同时缺失;而PMS2或MSH6可单独缺失。通过IHC结果中MMR蛋白的缺失模式可以推测异常的基因,但通常dMMR患者需进一步检测MMR基因是否存在胚系突变,除非MLH1蛋白缺失且伴有BRAF突变和(或)MLH1甲基化。
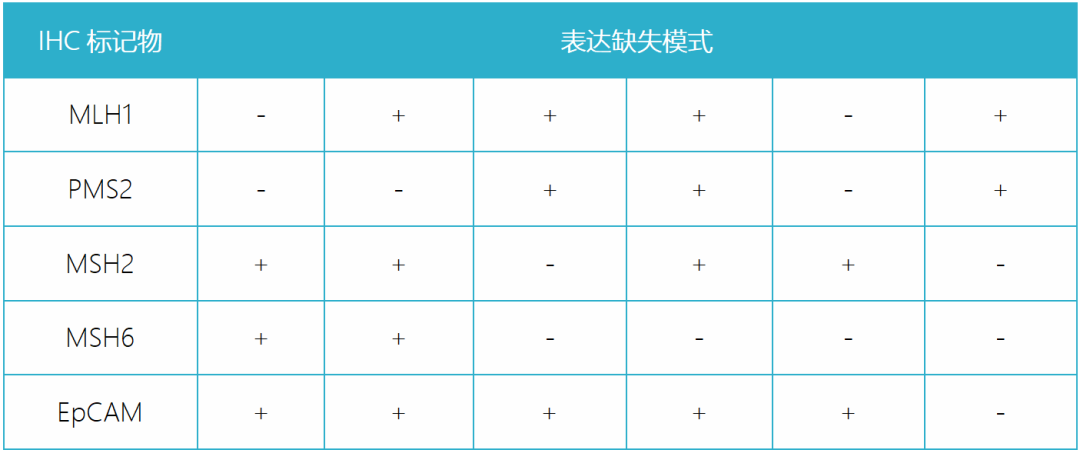

表1 dMMR-IHC结果提示
03 微卫星不稳定性(MSI) 检测
微卫星(MS)是指细胞基因组中以少数几个核苷酸(多为1-6个)单位串联重复的DNA序列,又称短串联重复(short tandem repeat,STR)。DNA错配修复(MMR)功能出现异常时,微卫星出现的复制错误得不到纠正并不断累积,使得微卫星序列长度或碱基组成发生改变,称为微卫星不稳定性(microsatellite instability, MSI),同时导致基因组呈现高突变表型。
MSI多由MMR蛋白表达缺失导致的MMR功能缺陷所致,故可通过检测蛋白缺失来间接反映MSI状态,根据结果可分为三种表型,分别为MSS(稳定),MSS-L(低度不稳定)及MSI-H(高度不稳定)。一般而言,dMMR相当于MSI-H表型,pMMR相当于MSI-L/MSS表型,根据报道,其中在结直肠癌两者的一致性约为92%,在子宫内膜癌两者的一致性是高达94%。
需要注意的是,以MMR 蛋白/MSI 检测作为初筛手段,有可能漏诊部分林奇综合征患者,有报道指出,MMR 蛋白表达及MSI 对林奇综合征的检测敏感度分别为83% 和77%-89%,存在高达10% 的漏诊率,但MSI和MMR蛋白同时检测可以提高准确率。
04 BRAF V600E突变和MLH1启动子甲基化检测
根据报道,80%的MLH1及PMS2蛋白缺失的患者是MLH1启动子甲基化引起,在约15%~20%的散发性结直肠癌和子宫内膜癌中,由于MLH1基因启动子的表观遗传甲基化而导致MLH1表达缺失。当MLH1(伴或不伴PMS2表达异常)表达异常时,需进一步行MLH1的启动子甲基化检测以排除散发性结直肠癌。由于BRAF V600E突变常见于MLH1基因启动子甲基化引起的散发性结直肠癌患者,所以也可先进行BRAF V600E检测,BRAF V600E突变阳性的患者可基本排除LS,如突变阴性再进行MLH1基因启动子甲基化检测。但需要注意的是[3]:约1%的LS同时伴有BRAF突变,同样有体细胞MSH1启动子甲基化的LS患者的报道,所以BRAF V600E突变和MSH1启动子甲基化均不能完全排除LS的可能性。
05 林奇综合征胚系突变筛查及解读
综上筛查检测方法的解读,结合目前国内外多项共识和指南在确诊林奇综合征的流程中均将MMR基因胚系突变检测作为最终确诊依据,是林奇综合征的金标准诊断方法,且应忽略癌种类型和家族史情况。对于临床患者,当出现dMMR或(和)MSI-H,建议行MLH1、MSH2、MSH6、PMS2和EPCAM 5个基因的胚系突变检测,在LS中胚系突变中,MSH2基因突变频率为50%,最为常见。其余MLH1基因突变频率为30-40%,MSH6基因突变频率7-10%,PMS2基因突变频率<5%,EPCAM基因突变频率1-3%,组成性MLH1表突变频率1-3%。
对于患者家属的预防性筛查,不同MMR基因突变患林奇综合征相关肿瘤的发病年龄和疾病风险各不相同(表2),其中MLH1/MSH2比MSH6/PMS2突变携带者患相关肿瘤的发病年龄更早,疾病风险也更高。因此对于疑似林奇综合征的个体或者患者家属,需要明确具体的基因变异,以个体化的评估疾病风险。
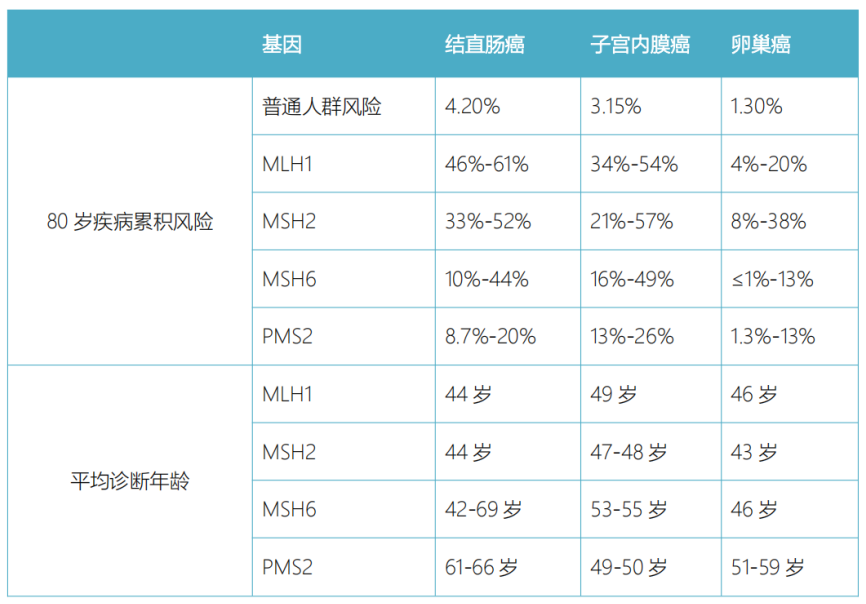
表2 不同MMR基因致病突变携带者的常见疾病
累积风险及平均诊断年龄[4]
06 总 结
随着生物技术及信息科学的发展,林奇综合征筛查准确率越来越高和筛选方案更多样和精细化,方便更好地指导患者制定下一步治疗方案、评估预后等,对于风险人群的精准识别,及其个体化定制的早期疾病监测和干预随访方案也在不断地与时俱进,相信未来通过奇综合征精准筛查与诊断,可以让很多的患者从中受益。
参考文献
1. 遗传性结直肠癌临床诊治和家系管理中国专家共识[2018年].
2. 结直肠癌诊疗指南[2023年]
3. Parsons MT, et al. (2012). Correlation of tumour BRAF mutations and MLH1 methylation with germline mismatch repair (MMR) gene mutation status: a literature review assessing utility of tumour features for MMR variant classification. J Med Genet.
4. Genetic/Familial High-Risk Assessment: Colorectal 2021 V1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言