Cell:首次利用CRISPR/Cas9系统鉴定出寄生虫必需基因
2016-09-03 佚名 生物谷
在一项新的研究中,来自美国怀特海德研究所的研究人员在顶复门(Apicomplexa)---导致疟疾、巴贝西虫病、隐孢子虫病和弓形虫病的单细胞寄生虫门---中进行首次全基因组筛选。这一筛选有助认识大量的未被研究过的寄生虫基因组,并且揭示为所有顶复门寄生虫所共有的一种蛋白。相关研究结果于2016年9月1日在线发表在Cell期刊上,论文标题为“A Genome-wide CRISPR Screen
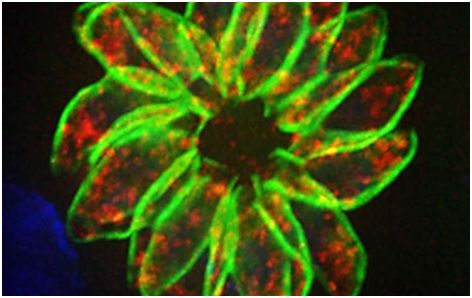
论文通信作者、怀特海德研究所研究员Sebastian Lourido说,“从没有一种真正好的方法来研究任何一种顶复门寄生虫中所有基因的功能。我们引入一种方法来评估整个基因组的功能。这种技术能够被用来研究各种各样的课题,如营养获取、对免疫压力作出的反应、上位性(epistasis)和遗传相互作用等等。这是在这些寄生虫中开展研究成为可能所取得的重要一步。”
美国疾病控制与预防中心(CDC)估计在美国有6000万多人感染上刚地弓形虫(Toxoplasma gondii)。通过摄入来自被感染的猫粪便的弓形虫卵子或者吃含有弓形虫包囊的未煮熟的肉,它的传播就能够发生。在感染后,一些健康的人经历一个月或以上的流感状症状,但是这种疾病也能够导致免疫受损的病人---包括接受移植的病人、HIV/AIDS病人、癌症病人、老年人和年幼小孩---产生癫痫和潜在致命的脑炎。如果妈妈在怀孕期间被感染的话,她能够将这种寄生虫传播给她的胎儿,这能够导致流产、死产、她的小孩大脑或眼睛损伤或者听力丧失。
尽管弓形虫病是一种严重性疾病,但是根据世界卫生组织(WHO)的统计,另一种顶复门寄生虫,即导致疟疾的恶性疟原虫(Plasmodium falciparum),2015年杀死了40多万人。鉴于刚地弓形虫与恶性疟原虫的亲缘关系比较接近,刚地弓形虫能够作为研究它的致命性更强的表亲(即恶性疟原虫)的模式生物。然而,对刚地弓形虫的研究因科学们不能够快速地和高效地敲降基因(或者说抑制基因)而一直受到阻碍。作为一种评估很多有机体中基因功能的有效工具,RNA干扰(RNAi)很大程度上不能够在顶复门中发挥作用,与此同时,随机突变的结果很难理解,这是因为发生突变的基因很难鉴定出。遗传杂交也很难执行,这是因为这种寄生虫的有性繁殖阶段仅在猫体内发生。
再者,利用CRISPR/Cas9基因编辑系统改变刚地弓形虫的基因组也因Cas9酶的毒性而受到限制。为了克服这个障碍,Lourido团队构建出“诱饵”单向导RNA(gRNA)从而有效地降低Cas9在基因组上的过强活性。利用这种“削弱的”CRISPR/Cas9系统,他们能够破坏刚地弓形虫的8158个基因,并研究它们每个的功能。这种方法鉴定出大约200个基因存在于所有的顶复门寄生虫中,并且这些基因在这些寄生虫感染人类细胞期间促进它们保持适应性中起着重要的作用。
在这些基因中,有一个基因编码一种被称作紧密连接蛋白样顶复门微线蛋白(claudin-like apicomplexan microneme protein, CLAMP)的蛋白,它在这种寄生虫侵入宿主细胞中发挥强大的影响。为了进一步分析这种蛋白的作用,和证实它是另一种顶复门寄生虫所必需的,Lourido团队与来自美国麻省理工学院的Jacquin Niles团队合作在恶性疟原虫对这种蛋白的表达进行抑制。在没有功能性CLAMP的存在下,这些疟疾寄生虫不能够在红细胞中生长。
尽管这种全基因组CRISPR/Cas9系统在刚地弓形虫中很好地工作,但是一种等价的策略仍然在恶性疟原虫是不存在的。
论文共同第一作者、Lourido实验室博士后研究员Diego Huet说,“疟原虫真地很难以相同的方式进行操纵。这是因为它的基因组富含A和T,所以很难在你想要的地方进行切割。疟原虫也缺乏DNA修复的非同源末端连接途径,因而当利用CRISPR/Cas9进行切割时,需要一种修复模板。这些问题代表着在这种寄生虫中开展类似的全基因组测试时所面临的技术障碍,使得弓形虫成为一种疟原虫的一种更加重要的模式生物。我们能够研究的就这么多了。”
论文共同第一作者、Lourido实验室研究助理Saima Sidik对此表示赞同,并且补充道,“如今,我们能够开始改变这些寄生虫所在的环境,并且观察它们如何作出反应。我们能够通过加入药物、加入免疫压力,或者尝试使用这些寄生虫侵入的不同细胞类型,改变环境。我们能够在一周内敲降整个基因组,然而,在之前,我们一个月内可能仅仅敲降一个基因。利用CRISPR筛选,这些可能性是无穷无尽的。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#RISPR/Cas9#
52
#Cell#
42
#CEL#
47
#CRISPR#
35
#CRISPR/Cas9#
0
#Cas9#
43
#Cas#
42
学习了,张丽珠教授成就了多少家庭危机,成就了多少病患的梦~
81
学习一下,好
77
阅读了谢谢。
87