EBioMedicine:新冠候选疫苗初见成效,即将进入临床试验阶段!
2020-04-04 佚名 转化医学网
近日,匹兹堡大学医学院的一项新研究成果给我们带来了希望的曙光
虽然目前国内疫情趋于稳定,各个省的病人增涨也多日保持零增涨,抗疫前线连连报捷,但是国际疫情不断蔓延,SARS-CoV-2现在更是造成了全球大流行,不禁让人担忧。迫切需要能够快速诱导针对这些感染因子的有效且持久的病毒特异性免疫反应的安全疫苗。在如此紧张的形式下,近日,匹兹堡大学医学院的一项新研究成果给我们带来了希望的曙光:在小鼠模型实验中,一种针对COVID-19的疫苗通过指尖大小的贴片传播,产生了针对SARS-CoV-2的抗体,其量被认为足以中和病毒。不仅如此,相关研究已通过了同行评议且发表在《柳叶刀》旗下的《电子医学》杂志上。
冠状病毒刺突(S)蛋白是病毒包膜的特征性结构成分,被认为是预防冠状病毒感染的疫苗的主要靶标。与刚刚进入临床试验的实验性mRNA疫苗候选者相比,本文描述的疫苗——匹兹堡冠状病毒疫苗的简称——采用了更成熟的方法,模仿了流感疫苗的制作方法,使用实验室制造的病毒蛋白片段来建立免疫。
研究人员使用一种称为微针阵列(MNA)的新颖方法来递送药物,以提高药效。这种阵列是指尖大小的400小针的贴片,可将刺突蛋白碎片传递到皮肤,免疫反应最强的地方。皮肤是免疫的理想靶标。它包含大量抗原呈递和免疫辅助细胞,能够诱导促炎性微环境,有利于诱导有效和持久的适应性免疫。在几种新兴的针对皮肤的药物递送方法中,溶解性MNA已作为一种微创的皮内注射方法出现。此处使用的MNA由机械强度高的水溶性聚合物开发而成,可物理破坏皮肤的最外层(角质层),然后迅速溶解在下面的可行表皮和真皮中,以将货物运送至皮肤微环境。这个贴片就像创可贴一样,针头完全由糖和蛋白质组成,只需溶解到皮肤中。
重要的是,MNA的递送导致局部皮肤微环境中疫苗成分的高浓度,从而有助于降低剂量,从而可以降低有效免疫所需的疫苗剂量,并显着降低成本和毒性。尽管每种疫苗候选物在MNA中的稳定性都需要在不同的温度下验证不同的存储时间,但现有文献表明,MNA嵌入式疫苗有可能在更长的时间内保持稳定,一旦制造出来,疫苗就可以在室温下保存,直到需要的时候为止,这样就不需要在运输或储存期间冷藏了。此外,先前的动物和临床研究表明MNA可以为有效的免疫策略提供安全且耐受良好的递送平台。这也为疫苗的大批量制作奠定了基础。
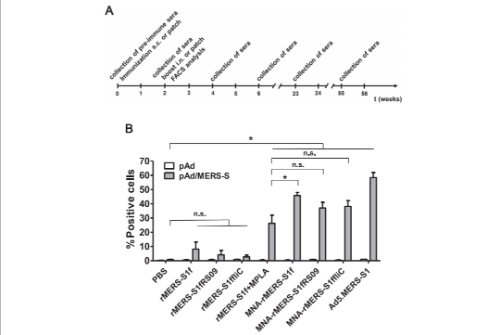
MNA传递的亚单位疫苗诱导识别细胞表面结合的MERS-S蛋白的抗体
在本次研究中,研究人员通过常规针头注射皮下注射或通过溶解微针阵列(MNA)皮内注射,通过ELISA评估接种疫苗的小鼠血清中病毒特异性IgG抗体并使用病毒中和后,全面测试了MERS-CoV疫苗在小鼠中的临床前免疫原性分析。结果发现,小鼠两周内产生了抗SARS-CoV-2抗体。接种MERS-CoV疫苗的小鼠产生的抗体水平足以中和病毒至少一年。到目前为止,SARS-CoV-2免疫动物的抗体水平似乎也遵循同样的趋势。
重要的是,SARS-CoV-2微针疫苗即使在用伽玛射线彻底消毒后仍能保持其效力,这是制造适合人类使用的产品的关键步骤。
综上所述,研究表明,可以使用重组DNA技术的最新进展来设计和生产针对新兴感染的疫苗。将新兴的生物技术方法与生物工程学在疫苗递送策略方面的进步相结合,可以快速生产针对新型病原体的临床可翻译疫苗,以供人体测试,然后及时在全球范围内分发,从而进一步影响疾病的传播。目前,该研究团队正在向美国食品和药物管理局申请新药研究批准,以期待在接下来的几个月内开始第一阶段的人体临床试验。让我们拭目以待。早日打赢抗疫攻坚战。
原始出处:Eun Kim, Geza Erdos, Shaohua Huang et al, Microneedle array delivered recombinant coronavirus vaccines: Immunogenicity and rapid translational development, EBioMedicine (2020).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#EBI#
67
#DIC#
64
#Bio#
94
#CIN#
58
#候选疫苗#
85
#Medicine#
56
#Med#
91
新冠肺炎,疫情何时才能消失
66