Nature综述:癌症免疫疗法是“牛”,那安全性呢?
2016-08-01 佚名 生物探索
近几年,免疫疗法飞速发展,给癌症患者带来了前所未有的希望。其中,免疫检查点抑制剂已经获批用于治疗多种癌症类型。然而,这些新型疗法其实也带来了一些独特的不良反应。近期,Nature子刊上发表的一篇综述聚焦了这些毒性作用。作者们希望能够为新疗法的应用提供一些指导。

检查点抑制剂的成功是癌症治疗领域一项重大的进步,因为它与化疗或靶向疗法截然不同。PD-1和CTLA-4抗体是癌症免疫疗法中的重要成员,为晚期黑色素瘤患者带来了前所未有的希望,并且在其它癌症类型中也显示出了巨大的潜力。
然而,这种疗法也导致了一些独特的、通常与免疫相关的不良反应(adverse events that are mostly immune-related,irAEs)。患者免疫系统的激活有时会导致严重的、甚至致命的毒副作用。早期识别和管理这些irAEs对临床医生至关重要,这将有助于更加成功、安全的使用这些新型免疫疗法药物。
今年5月,Nature Reviews Clinical Oncology杂志上发表了题为“Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination”的综述文章。作者们概括了靶向PD-1和CTLA-4的检查点抑制剂相关的不良反应,旨在为癌症免疫疗法更好的应用提供一些通用准则。
CTLA-4及PD-1抗体
在过去的十年里,科学家们开发了2个靶向CTLA-4的全人源化单克隆抗体,分别为ipilimumab和 tremelimumab,最初主要是在晚期黑色素瘤患者中进行测试。初步调查中,这两个抗体的响应率是相似的,但在两个随机临床试验中,只有ipilimumab治疗带来了重要的生存益处。
Ipilimumab分别在2011年3月、7月获得了FDA和EMEA的批准,作为单一用药,治疗转移性黑色素瘤。文章表示,ipilimumab和 tremelimumab正被积极开发用于治疗其它类型的癌症,如非小细胞肺癌、前列腺癌和间皮瘤。
值得注意的是,今年2月29日,tremelimumab目前的开发商阿斯利康宣布,该药作为二线或三线疗法治疗不可切除的恶性间皮瘤的IIb期临床试验没能达到总生存期的主要终点(primary endpoint of overall survival)。尽管这一试验宣告失败,但公司认为tremelimumab依然是Immuno-Oncology产品线联合治疗策略中的关键组成部分。
另一种已经成功实现临床转化的免疫检查点是PD-1。目前,有两个PD-1抗体获批,分别为Nivolumab和Pembrolizumab。前者已“拿下”4个适应症,包括黑色素瘤、肺癌、肾癌以及经典型霍奇金淋巴瘤,后者获批的适应症包括黑色素瘤和肺癌。
调节机制
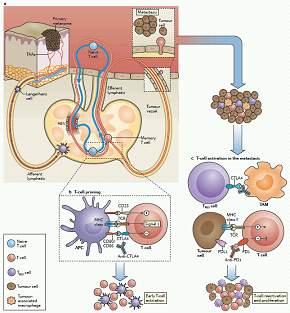
图1:Immune checkpoints and control of T cell activation in melanoma.(来源:Nature Reviews Clinical Oncology)
CTLA-4 和PD-1受体的作用都是调节T细胞活性,但是机制不同。因此,对应的抗体调节T细胞免疫响应的程度也不同(图1)。
CTLA-4是在T细胞上表达的免疫检查点受体。它的激活主要会抑制淋巴组织中T细胞活化早期阶段的免疫响应。此外,CTLA-4还在调节性T细胞(TREG)中表达。这是一种在肿瘤微环境中抑制免疫响应的T细胞。因此,阻断CTLA-4会导致广泛的、非特异性的免疫响应激活。这种对免疫系统广泛的激活作用解释了CTLA-4抗体为何会引发多种不良反应。
与CTLA-4不同,PD-1主要在周围组织(peripheral tissues)和肿瘤微环境中与它的配体相互作用。PD-1有两个配体:PD-L1和 PD-L2。PD-1抑制剂在肿瘤微环境和组织中靶向T细胞更具特异性。因此,相比阻断CTLA-4,PD-1抗体带来的不良反应更有限。
不良反应
通过对免疫检查点抑制剂临床试验的研究,作者们发现,它们可能会在任何组织、器官或系统中导致免疫介导的不良反应。PD-1和CTLA-4抑制剂的副作用通常发生在皮肤、胃肠道、肝脏和内分泌系统,包括瘙痒、皮疹、恶心、腹泻和甲状腺疾病。
这一综述详细汇总了CTLA-4抗体的毒性反应,重点介绍了小肠结肠炎和/或腹泻、皮肤和内分泌相关反应。此外,还分别介绍了PD-1抗体pembrolizumab、nivolumab以及ipilimumab与nivolumab联合疗法的毒性作用(图2、图3)。
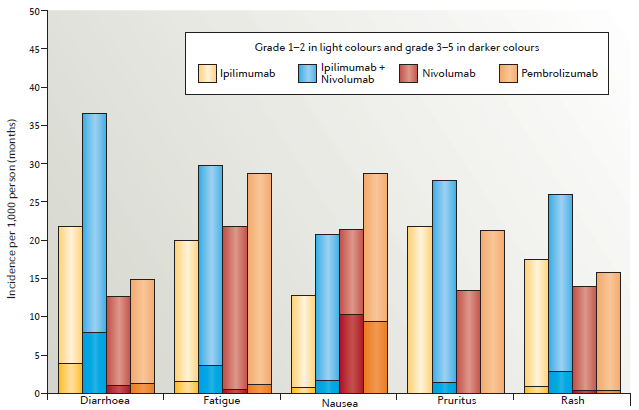
图2:The most common adverse events in patients treated with ipilimumab, pembrolizumab, nivolumab, or ipilimumab plus nivolumab.(来源:Nature Reviews Clinical Oncology)
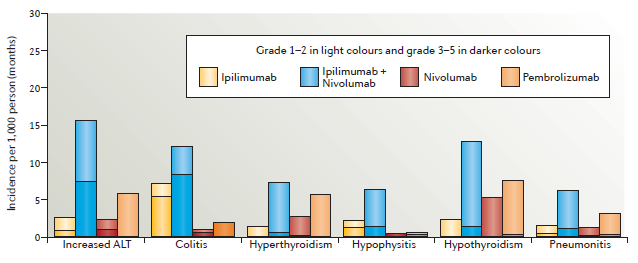
图3:Adverse events of special interest noted with immune-checkpoint inhibitors. (来源:Nature Reviews Clinical Oncology)
如何管理
与其它抗癌药不同的是,检查点抑制剂靶向的是免疫系统,而不是肿瘤。文章表示,这些由免疫检查点抑制剂治疗带来的irAEs通常可以根据经验进行管理,且教育和沟通是成功管理患者的关键因素。
肿瘤专家们需要对这些毒性作用背后的潜在机制有很好的了解。此外,借助一些其它领域的专家(如胃肠病学家、肝脏病学家、内分泌学家、神经学家或皮肤科医生)来管理这些特殊的副作用也是可以考虑的。当然,病人教育也是必不可少的。
据悉,FDA Risk Evaluation and Mitigation Strategy已经提出了ipilimumab引发的irAEs的管理指导方针。作者们认为,pembrolizumab、nivolumab以及联合治疗的副作用的管理也需要相似的指导方针。
一般来说,不干扰日常生活能力的1-2级不良反应是进行对症管理,通常不需要降低剂量或停止治疗(图4)。文章重点介绍了皮肤疾病、胃肠道功能紊乱以及内分泌失调的管理策略。
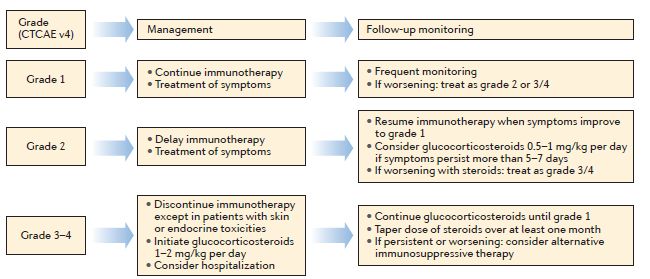
图4:Management of immune-related adverse events excluding skin and endocrine toxicities.(来源:Nature Reviews Clinical Oncology)
附注:靶向CTLA‑4和PD‑1的检查点抑制剂引发的免疫相关不良事件管理指导方针。
结论
检查点抑制剂的使用带来的不良反应与它们的抗肿瘤机制有关。医生应该认识到这一类革命性药物的安全性概况。目前,还有很多问题需要进一步探索,比如,如何实现对这些不良反应的最佳管理。未来的研究应该聚焦如何通过鉴定生物标志物(用于预测治疗响应或者严重的自体免疫毒性风险)优化这些新药的使用。
原始出处:
Boutros C1, Tarhini A2, Routier E1, Lambotte O3,4,5, Ladurie FL6, Carbonnel F4,7, Izzeddine H8, Marabelle A9, Champiat S10, Berdelou A11, Lanoy E12, Texier M12, Libenciuc C1, Eggermont AM1,4, Soria JC4,9,10, Mateus C1, Robert C1,4,10..Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination.Nature.2016 May 4.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Nat#
68
收藏
109
要有大数据
123
值得研究
114