Cell:美发现强力HIV药物制造方法
2015-02-04 叶予 生物通
美国加州理工学院Caltech的研究人员根据艾滋病毒(HIV)躲避抗体的机制,开发了中和能力比天然抗体强一百倍的免疫分子,为人们提供了设计HIV药物的新途径。这项研究发表在一月二十九日的Cell杂志上。 “我们现在可以制造真正强力的HIV药物,这些药物不仅可以在低浓度下起作用,还可以迫使病毒突变使其更容易被消灭,”Pamela Bjorkman教授说。“给HIV患者使用这种药物
美国加州理工学院Caltech的研究人员根据艾滋病毒(HIV)躲避抗体的机制,开发了中和能力比天然抗体强一百倍的免疫分子,为人们提供了设计HIV药物的新途径。这项研究发表在一月二十九日的Cell杂志上。
“我们现在可以制造真正强力的HIV药物,这些药物不仅可以在低浓度下起作用,还可以迫使病毒突变使其更容易被消灭,”Pamela Bjorkman教授说。“给HIV患者使用这种药物有望清除他们体内的病毒。”
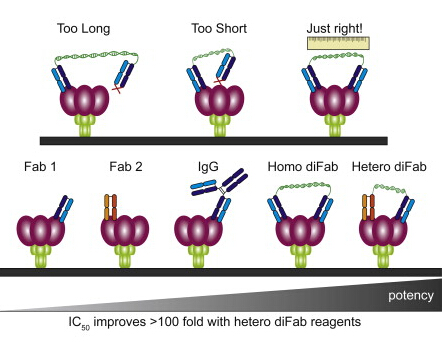
人体免疫系统能够成功应对大多数病毒,但对HIV没什么效果。研究人员认为,这主要是因为HIV表面的spike太少密度太低。从病毒表面刺出的每个spike由三个蛋白亚基组成,是中和性抗体的作用靶标。绝大多数病毒拥有数以百计的spike,但HIV只有10-20个,spike之间的平均距离特别长。
对于捕捉病毒的天然抗体而言,上述距离是很重要的。抗体是用双臂抓住目标的Y形蛋白,如果spike过于稀疏,抗体就只能有一个臂与之结合。这样的连接比较弱,spike突变很容易让抗体无效。
为此,Bjorkman等人用广谱综合性抗体的病毒结合部分(Fab),构建了能用双臂抓紧一个spike的分子。他们并没有构建Y形抗体,而是用DNA把广谱综合性抗体的Fab连接起来。
研究人员用不同长度的DNA连接Fab,并筛选出中和效果最好的分子,然后根据DNA的长度推算Fab之间的最佳距离。此外,他们还测试了不同的Fab组合。研究显示,两个不同抗体的Fab连接起来效果最好,中和HIV的能力比天然抗体高10到1,000倍,连接DNA的最佳长度在40到62bp之间。
随后,研究人员将DNA链换成长度相当的蛋白链(12个拷贝的TPR结构域),得到完全由蛋白组成的试剂。这些试剂可以在低浓度下起作用,成本低副作用小。研究人员正在大量制造这种试剂,以便在人源化小鼠模型里进行测试。
原始出处:
Galimidi RP1, Klein JS1, Politzer MS1, Bai S1, Seaman MS2, Nussenzweig MC3, West AP Jr1, Bjorkman PJ4.Intra-Spike Crosslinking Overcomes Antibody Evasion by HIV-1.Cell. 2015 Jan 29;160(3):433-46. doi: 10.1016/j.cell.2015.01.016.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CEL#
31
#Cell#
29