复旦大学俞麟教授《Biomaterials》: 一种可注射的活性水凝胶,诱导协同增强的轻度磁热效应和铁死亡!
2023-05-11 BioMed科技 BioMed科技 发表于上海
该研究开发了一种新型的可注射NPs/RSL3@AAGel系统,将温和的MHT和铁下垂结合在一起,以突破MHT的主要瓶颈。
磁热疗法(MHT)是一种很有前途的治疗实体瘤的新方式,但磁热转换效率低、磁共振成像(MRI)伪影、磁性纳米粒子容易泄漏和热阻是扩大其临床应用的主要障碍。在此, 复旦大学俞麟等人提出了一种基于新型可注射的磁性和铁性水凝胶的协同策略,以克服这些瓶颈,提高MHT的抗肿瘤疗效。这种可注射的水凝胶(AAGel)在加热时表现出溶胶-凝胶的转变,由花生四烯酸(AA)修饰的两亲性共聚物制成。具有高效磁滞损耗机制的铁磁性Zn0.4Fe2.6O4纳米立方体被合成并与RSL3(一种有效的铁诱导剂)共同加载到AAGel中。纳米立方体的高磁热转换效率加上回声限制效应的应用,避免了MHT过程中的MRI伪影。除了磁加热的功能,Zn0.4Fe2.6O4纳米立方体结合多重MHT可以持续供应氧化还原活性铁,以产生活性氧和脂质过氧化物,加速RLS3从AAGel中的释放,从而增强铁素体的抗肿瘤功效。反过来,强化的铁吞噬作用可以通过损害保护性热休克蛋白70来缓解MHT引发的肿瘤热抵抗。该协同策略实现了小鼠CT-26肿瘤的完全消除,而不会引起局部肿瘤复发和其他严重的副作用。该研究以题为“An injectable and active hydrogel induces mutually enhanced mild magnetic hyperthermia and ferroptosis”的论文发表在《Biomaterials》上。

与其他热疗方式相比,MHT具有无限的穿透深度,因此备受关注。然而,在MHT的临床应用中遇到了四个主要问题:(1)磁性纳米颗粒的ILP值低,(2)MRI伪影,(3)磁性纳米颗粒的泄漏,(4)热阻。为了解决这些问题,该研究研究开发了一种新型的NPs/RSL3@AAGel体系,该体系采用可活化的温敏水凝胶来共包裹纳米立方体和RSL3。
为此,开发了一种含有铁磁性Zn0.4Fe2.6O4纳米立方体的活性热敏水凝胶,以磁滞损耗为主要加热机制,以及RSL3,一种通过GPX4抑制的强效铁蛋白诱导剂(方案1)。引入内源性AA或AA修饰的聚合物可以促进脂质过氧化物的产生,增强RSL3诱导的铁死亡,所以AA被共价连接到热敏聚(D,L-乳酸-共-乙二醇)-b-聚(D,L-PLGA-PEG-PLGA)三嵌段共聚物,以获得由原始PLGA-PEG-PLGA和AA封端的PLGA-PEG-PLGA(AA-PLGA-PEG-PLGA-AA)组成的可活化热敏水凝胶(AAGel),该凝胶在加热时表现出溶胶-凝胶转变。
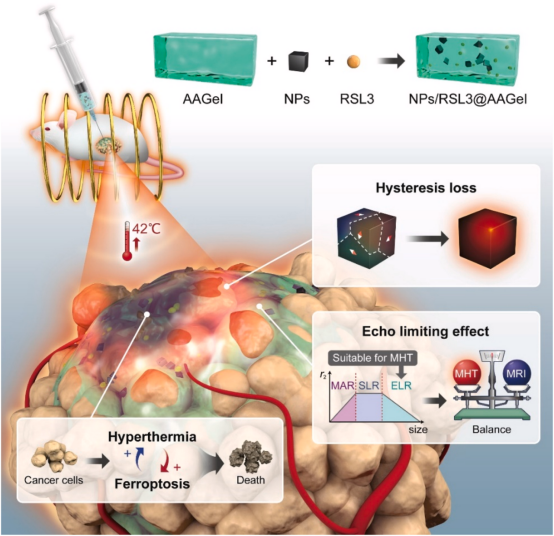
方案1.NPs/RSL3@AAGEL系统用于MHT和下垂联合治疗的示意图
【温敏性PLGA-PEG-PLGA和AA-PLGA-PEG-PLGA-AA
的合成与表征】
以聚乙二醇1500(PEG1500)为大分子引发剂,锡(辛酸)2为催化剂,通过LA和GA的共聚反应,首次合成了温敏性PLGA-PEG-PLGA。然后,通过酯化反应将AA固定在三嵌段共聚物的两端,得到AA-PLGA-PEG-PLGA-AA。
【纳米锌铁氧体的合成与表征】
以Zn(acac)2和Fe(acac)3为反应物,通过高温固相反应合成了锌铁磁性纳米锌铁氧体。锌铁纳米立方体中锌和铁的质量分数分别为14%和86%。在外加磁铁的存在下,纳米锌铁氧体的快速聚集也显示出其优异的磁性。
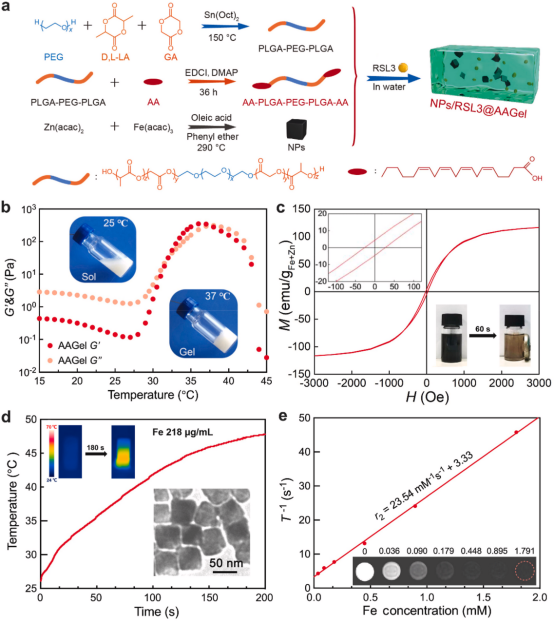
图1.AAGel和NPs的制备方案和表征
【协同抗癌药效的体外评价】
体外抗癌实验表明,与RSL3@BLKGel系统相比,引入AA修饰的聚合物载体确实增强了RSL3对CT-26肿瘤细胞的抗癌活性。这一特点归因于PE-AA-OOH的形成和细胞内GSH的耗竭,它可以与RSL3诱导的铁中毒协同作用。磁性NPs的加入促进了ROS和脂质过氧化物的生成,这进一步提高了NPs/RSL3@AAGel系统的抗癌效果。NPs/RSL3@AAGel系统与热疗相结合,对肿瘤细胞的杀伤力最强。
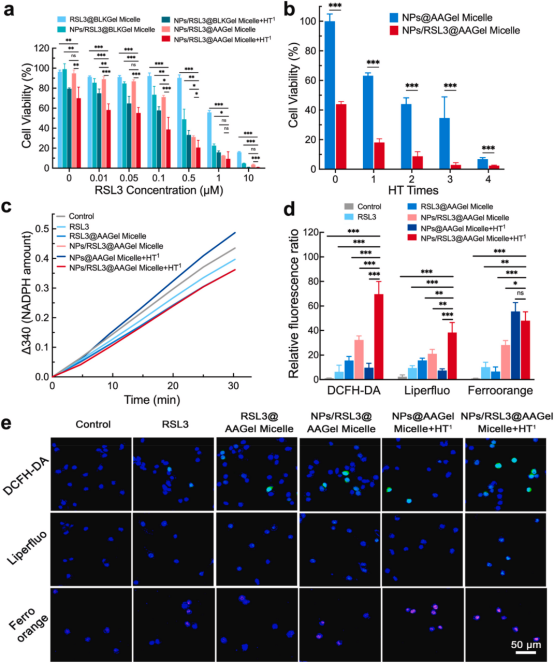
图2.体外细胞分析
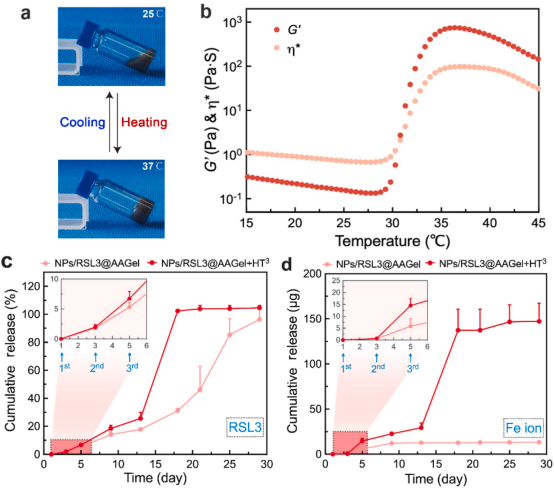
图3. NPs/RSL3@AAGel的温度反应性凝胶行为和体外药物释放曲线
【AAGel的体内降解】
体外释放试验表明,多次热疗不仅促进了RSL3从凝胶基质中的释放,而且还加速了磁性NPs的降解,这是因为热疗驱动AAGel的降解增加,导致释放环境更加酸性。
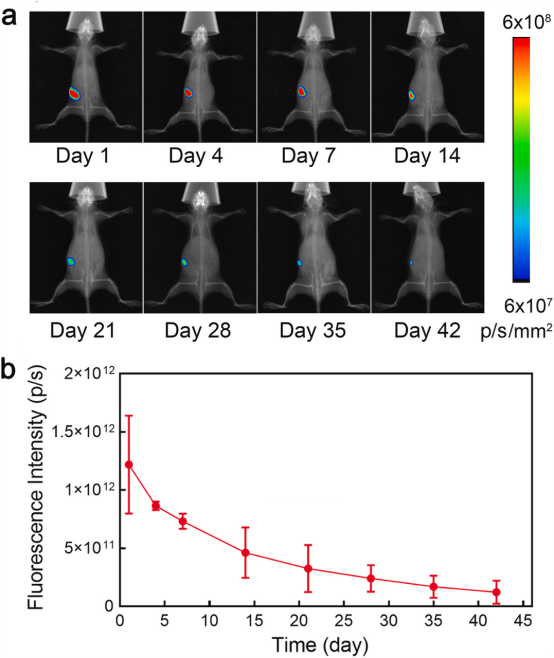
图4.AAGel在体内的降解
【体内抗癌作用】
考虑到多次热疗可以加速AAGel的降解,降低介质的pH值,从而加速NPs的降解,NPs的Fe浓度最终被设定为800μg/mL。这样的凝胶系统不仅通过锚定在AAGel中防止了磁性NPs的泄漏,而且还提供了在一次注射后进行多次和准确的温和MHT的能力。

图5.注射NPs/RSL3@AAGel后的三圈MHT
与RSL3溶液、RSL3@AAGel和NPs/RSL3@AAGel相比,单次注射NPs@AAGel加三种温和的MHT(NPs@AAGel+MHT3)可有效抑制肿瘤生长长达11天,并在3周内取得较好的抗癌效果。用NPs/RSL3@AAGel+MHT3治疗表现出最强的肿瘤抑制效果,小鼠的肿瘤在21天内被完全根除,表明多种MHT与NPs/RSL3@AAGel系统的结合在体内具有良好的协同抗癌效果。且所有治疗组都没有发现明显的系统毒性。
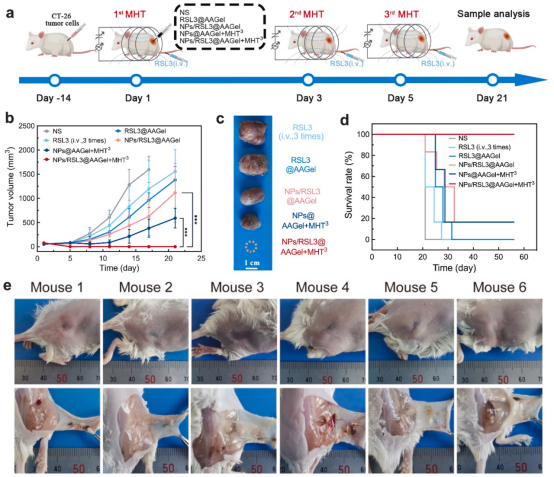
图6.体内治疗效果
在存活试验中,各组小鼠死亡/牺牲后,也对其主要器官进行了解剖和收集。与NPs/RSL3@AAGel+MHT3组完全消灭肿瘤不同,其他治疗方法只能在一定程度上抑制肿瘤生长。因此,目前的研究结果表明,仅仅抑制肿瘤的生长,而不是完全消除肿瘤,并不能防止与癌相关的副作用和转移的发生。
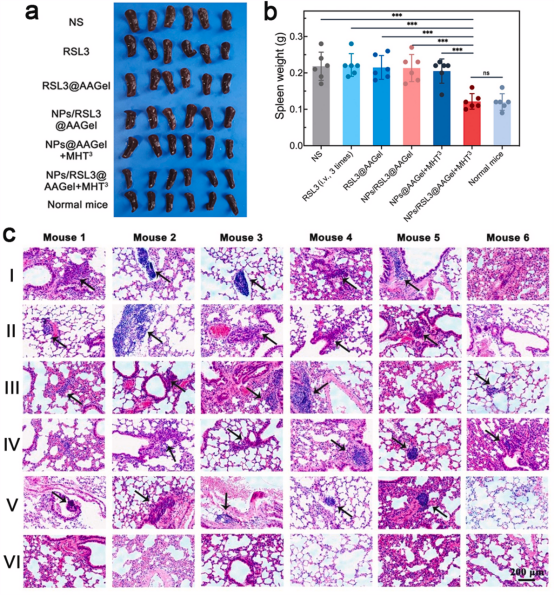
图7.癌症相关副作用和转移的评估
为了揭示MHT和RSL3诱导的铁下垂的体内协同作用机制,用免疫印迹法和逆转录定量聚合酶链式反应(RT-qPCR)检测肿瘤组织中HSP70和Gpx4的表达。结果表明,NPs/RSL3@AAGel与MHT联合使用不仅通过减少HSPs的保护增加了MHT的抗癌效力,而且通过利用MHT加速RSL3在体内的释放而增强了RSL3诱导的铁下垂的抗癌作用,它们的协同作用导致了CT-26肿瘤在体内的完全消除。
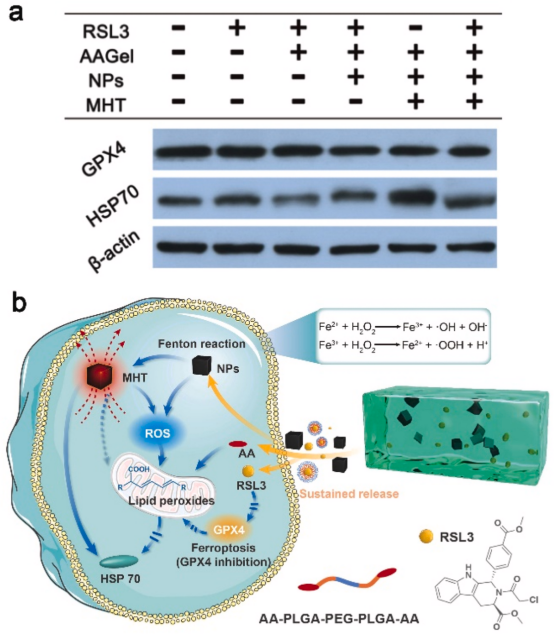
图8. a) 各种处理后48小时,肿瘤组织中HSP70和GPX4蛋白的表达。b) NPs/RSL3@AAGel系统中MHT和铁蛋白的潜在协同机制的示意图。
【活体MRI观察】
在体内抗癌实验中,治疗装置/肿瘤随时间的变化也通过MRI进行无创性监测。MRI观察显示AAGel在体内逐渐降解。且NPs的引入不会产生严重的磁共振伪影。更重要的是,MRI观察明显显示NPs/RSL3@AAGel+MHT3组CT-26肿瘤逐渐缩小,第21天MRI未检测到肿瘤组织,这有力地支持了体内抗癌和生存评估实验的结果。相反,与对照组相比,其他治疗只在不同程度上抑制了肿瘤的生长。
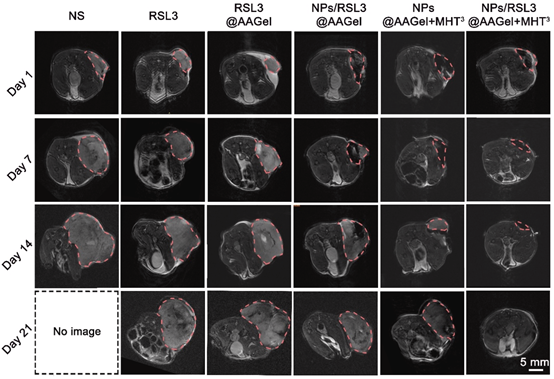
图9. 各组小鼠在治疗后第1、7、14和21天的代表性T2加权图像
【小结】
该研究开发了一种新型的可注射NPs/RSL3@AAGel系统,将温和的MHT和铁下垂结合在一起,以突破MHT的主要瓶颈。该系统不仅具有一次注射多次MHT的能力,而且首次平衡了磁性纳米粒子的T2对比度,从而避免了MHT应用过程中严重的MRI伪影。同时,磁性纳米粒的存在与高温结合可通过加速RSL3的释放以及Fenton反应诱导的ROS和过氧化脂质的积累来增强铁下垂的效力,而增强的铁下垂又通过损害保护性HSP70而提高MHT的疗效。结果,一次给予NPs/RSL3@AAGel系统加三个周期的轻度MHT可完全消除小鼠模型中的CT-26肿瘤,且没有复发、转移或其他严重副作用。因此,这项工作不仅为解决目前MHT临床应用中的主要问题提供了技术平台,而且为更安全、更准确地协同治疗实体瘤开辟了一种新的策略。同时,考虑到这项研究也证明了MHT和铁下垂的有效结合,这样的概念验证可能有助于扩大这两种疗法在其他生物医学领域的发现和应用。
然而,MHT和铁下垂之间的协同作用机制是复杂的,还不完全清楚。此外,目前的动物模型并不是一个主要的肿瘤模型。因此,今后还需要对这一课题进行进一步的研究。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961223001473
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言