Neuron:活化的小胶质细胞以非细胞自主的方式抑制神经元自噬,参与神经退行性病变
2023-05-12 brainnew神内神外 brainnew神内神外 发表于上海
近日,英国剑桥CB2 0XY剑桥医学研究所David C. Rubinsztein教授团队在Neuron发表研究,主要发现活化的小胶质细胞以非细胞自主的方式抑制神经元自噬。
神经退行性疾病,包括tau病和亨廷顿舞蹈症,其特征是神经元细胞质中易聚集蛋白的积累。神经元具有防止毒性聚集倾向蛋白积累的保护机制,如大自噬(以下简称自噬),这是一种主要的细胞质内蛋白降解途径。在自噬中,双层膜结构的自噬体吞噬细胞质的一部分,并将其输送到溶酶体进行降解。自噬对于去除导致神经退行性病变的易聚集蛋白(如亨廷顿蛋白和tau蛋白)至关重要,而削弱自噬会触发其积聚并促进其毒性。
大多数研究神经元自噬缺陷的机制都集中在细胞自主机制上(cell-autonomous),而忽略了来自其他脑细胞类型的异常旁分泌信号在调节神经元自噬方面可能产生的潜在影响。
近日,英国剑桥CB2 0XY剑桥医学研究所David C. Rubinsztein教授团队在Neuron发表研究,主要发现活化的小胶质细胞以非细胞自主的方式抑制神经元自噬。

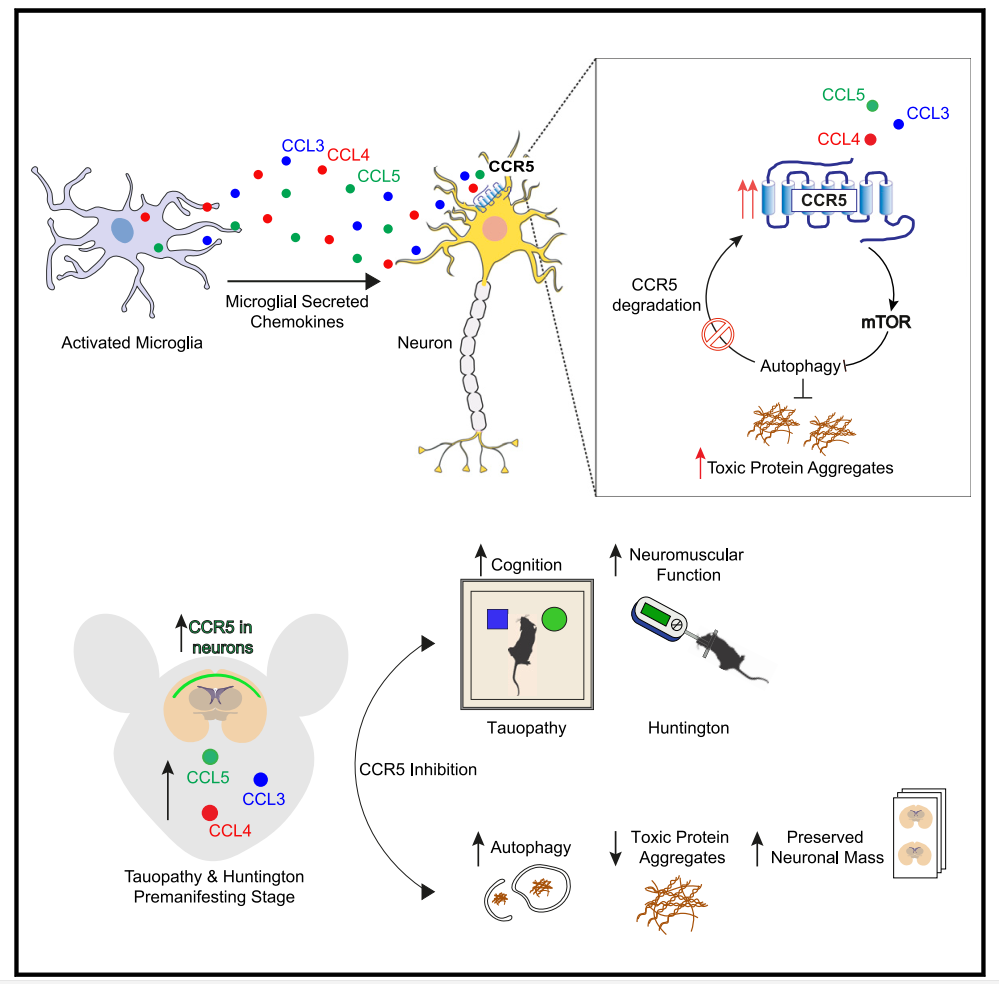
活化的小胶质细胞通过分泌CCL3、CCL4和CCL5调节神经元自噬
研究人员首先利用来自活化小胶质细胞的条件培养基培养神经元,结果发现LC3-II形成显著减少[Fig.1B],表明小胶质细胞可以分泌抑制神经元自噬的因子。为了确定这一过程的潜在因子,对已发表的老年小鼠小胶质细胞RNA测序进行分析,发现CCL3、CCL4和CCL5是趋化因子和细胞因子中上调最高的三个因子[Fig.1C]。
另外,研究人员还利用CCR5敲除(KO)原代神经元或CCR5沉默的HeLa细胞,证明了CCL-3/-4/-5主要是通过CCR5损害自噬。同时mTORC1的激活也是这些趋化因子引起的自噬缺陷的基础,并且CCL5暴露后PI3K-AKT-TSC2轴的激活对于促进mTORC1信号传导至关重要。

Figure 1 活化的小胶质细胞通过分泌CCL3、CCL4和CCL5使神经元自噬紊乱
CCR5在神经退行性疾病小鼠大脑中的表达改变
接下来,研究人员在动物实验中观察到,与对照组相比,表现前期HD和PS19 tau病小鼠的脑裂解物中CCR5蛋白水平升高[Fig.2A,E],这种增加特别发生在神经元中。同时,在这两种疾病小鼠模型的大脑中,小胶质细胞活化显著增加[Fig.2C,G]。
此外,CCR5-KO使HD和PS19小鼠大脑中mTORC1信号传导和LC3-II水平正常化,并降低了模型小鼠中HTT聚集体和不溶性tau的数量,这可能是源于自噬激活。

Figure 2 神经退行性疾病前期小鼠大脑中的小胶质细胞IBA1、神经元CCR5蛋白水平及其趋化因子配体增加
maraviroc(MVC)对CCR5的抑制使HD小鼠模型中mTORC1自噬轴和HTT病理重新平衡
Maraviroc(马拉韦罗)是美国FDA批准的一种选择性阻断CCR5活性的药物。实验发现CCL5处理的神经元表现出自噬溶酶体的显著减少,这表明自噬流量减少。而MVC显著挽救了自噬溶酶体的数量,并防止了神经元中CCL5处理引起的polyQ聚集体的异常增加[Fig.3A-C]。同时也验证了MVC在两种小鼠模型中的作用,也都起到了改善效果。总之,在HD和PS19小鼠模型中,CCR5信号传导的抑制重新平衡了mTORC1的激活和自噬清除,并改善了这些疾病的临床表现。

Figure 3 马拉韦罗对CCR5的抑制挽救了mTORC1自噬缺陷,并减少了神经元和HD小鼠大脑中的蛋白质聚集体
CCR5是自噬的底物
最后,为了研究CCR5是否是神经元中的自噬底物,研究人员用SBI-0206965(SBI通过抑制激酶ULK1来损害自噬体的生物发生)或阻断自噬体降解的BAF(V-ATP酶抑制剂)处理原代神经元。结果发现神经元CCR5水平在SBI和BAF处理后显著增加,表明自噬调节神经元中CCR5的降解[Fig.4C,D]。
此外,还发现在饥饿细胞中CCL5处理并不影响CCR5运输到再循环内体中,但降低了该区室中的LC3-II,从而阻碍了自噬体的形成和CCR5的降解[Fig.4F,G]。

Figure 4 CCR5通过自噬调节自身表达
总结与展望
在这项研究中,研究人员确定CCL3、CCL4和CCL5及其同源受体CCR5是小胶质细胞和神经元之间新的有害串扰的介质,该串扰通过mTORC1激活抑制神经元自噬,并损害易聚集蛋白的清除。
重要的是,MVC能够逆转CCR5-KO或CCR5药理学抑制中自噬介导的神经毒性蛋白降解缺陷以及HD和tau病理小鼠模型相关的功能障碍——这一结果可能具有重大的临床意义。
总之,该研究结果为活化的小胶质细胞在神经元自噬的非细胞自主下调中的作用提供了见解。
参考文献
Rubinsztein, D., Festa, B. P., Siddiqi, F., Jimenez-Sanchez, M., Won, H., Rob, M., Djajadikerta, A., & Stamatakou, E. (2023). Microglial-to-neuronal CCR5 signalling regulates autophagy in neurodegeneration.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言