特别关注|胰源性糖尿病的发病机制与诊治进展
2024-06-18 临床肝胆病杂志 临床肝胆病杂志 发表于上海
国内关于胰源性糖尿病的研究尚少,充分了解、正确识别并诊断胰源型糖尿对提高患者的生存及生活质量具有重要意义。
2014年,美国糖尿病学会将由胰腺外分泌疾病导致的糖尿病命名为胰源性糖尿病或3c型糖尿病。胰源性糖尿病的综合发病率约6/100 000例,约占所有糖尿病的8%。胰源性糖尿最常见的病因是慢性胰腺炎,约占79%;其次是胰导管腺癌,约占8%。据统计,胰源性糖尿病的患病率显著高于1型糖尿病,但仍显著低于2型糖尿病。胰源性糖尿病患者因各种原因导致的β细胞或α细胞缺乏,其血糖水平难以控制,故更易发生低血糖相关并发症,甚至死亡。研究表明,胰源性糖尿病患者相较于2型糖尿病患者的死亡和再入院风险更高。作为一种由胰腺外分泌疾病引起的糖尿病,胰源性糖尿病常被误诊为2型糖尿病。研究显示,45%~90%的胰源性糖尿病患者被误归为2型糖尿病。目前,国内关于胰源性糖尿病的研究尚少,充分了解、正确识别并诊断胰源型糖尿对提高患者的生存及生活质量具有重要意义。
1发病机制
1.1 胰岛功能障碍,胰岛素分泌不足
免疫介导下的胰岛功能障碍是胰源性糖尿病发生的关键机制。在胰腺炎早期,高水平的细胞因子和应激性炎症环境导致β细胞功能障碍。胰腺实质因严重纤维化,胰腺腺泡、导管和神经束等有功能的胰腺组织最终被结缔组织取代,从而失去血管及分泌功能。而继发于胰腺癌的糖尿病不同于其他原因引起的糖尿病,并非因纤维炎症破坏或胰腺切除引起,而是由癌症释放的介质引起的副肿瘤效应。研究表明,胰腺癌术后患者胰岛素抵抗和β细胞功能障碍均有所改善。加权基因共表达网络分析研究证实,巨噬细胞活化和Toll样受体信号通路是胰源性糖尿病的重要病理生理学特征,胰源性糖尿病患者巨噬细胞活化时,胰岛中ITGAM(整合素αM)、ITGB2(整合素β2)、PTPRC(蛋白酪氨酸磷酸酶受体C)和CSF-1R(集落刺激因子-1受体)的表达均显著上调,上述生物标志物可能有助于胰源性糖尿病的辅助诊断。
胰腺炎相关糖尿病的发生发展与巨噬细胞的募集和活化引发炎症细胞大量释放进而导致胰岛功能改变相关。研究表明,巨噬细胞的早期募集和活化是加重胰腺细胞损坏的重要环节之一。巨噬细胞是慢性胰腺炎发展过程中浸润胰腺的主要炎症细胞,在胰腺纤维化的进展中发挥重要作用(图1)。在巨噬细胞和慢性胰腺炎的发病机制中,核因子κB(NF-κB)是巨噬细胞募集到胰腺的主要参与者之一,受损的腺泡细胞可释放激活巨噬细胞的趋化因子和炎症因子,促进NF-κB亚基P65和IL-6、TNF-α、单核细胞趋化蛋白-1等促炎细胞因子活化,引起强烈的炎症反应。促炎细胞因子如IL-10、TNF-α、IFN-γ可抑制受葡萄糖刺激的胰岛素释放。高浓度IL-1受体和IL-1β可诱导β细胞凋亡,而高浓度的IFN-γ可导致胰十二指肠同源盒1(PDX-1)或胰岛素启动子因子1的转录因子易位减少。研究表明,PDX-1对于胰腺细胞的发育至关重要,其参与β细胞的成熟和十二指肠的分化。在慢性胰腺炎患者中,由于PDX-1水平的降低,β细胞的分化和存活率也随之降低,进而导致胰岛素的产生受损。另有研究发现肾上腺髓质素和泛酰巯基乙胺水解酶也是炎症产生的结果,可能改变胰源性糖尿病患者的胰岛细胞功能。此外,巨噬细胞与胰腺星状细胞(PSC)相互作用可促进慢性胰腺炎的进展,巨噬细胞产生的转化生长因子-β和血小板源性生长因子(PDGF)是PSC的有效激活剂,活化的PSC释放的细胞因子可能诱导胰腺巨噬细胞极化为M2表型,同时活化的M2巨噬细胞转化生长因子-β和PDGF高表达,直接与PSC相互作用,促进PSC的增殖和活化,最终引起胰腺纤维化。
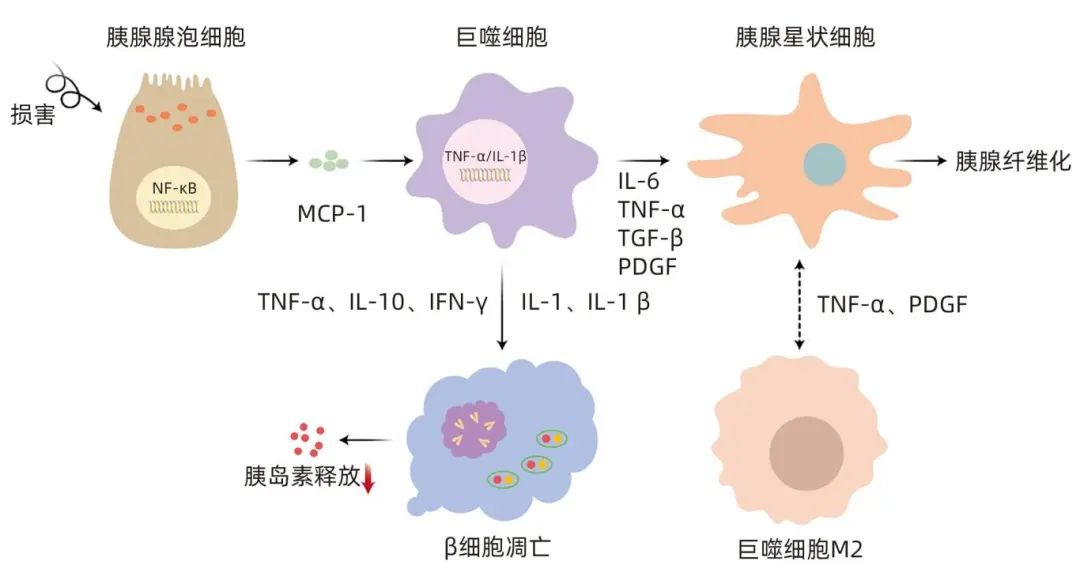
图1 巨噬细胞促进胰腺纤维化的作用机制
胰腺癌相关糖尿病患者的胰腺组织中存在高水平的钙卫蛋白(S100A6/A8/A9)和连接蛋白。上述蛋白在胰腺导管癌患者的胰岛中过度表达,在中性粒细胞和活化的巨噬细胞中可见大量S100A6/A8/A9,原因可能在于胰腺癌早期单核细胞、巨噬细胞、中性粒细胞等细胞聚集。研究发现,与健康人相比,胰腺癌合并糖尿病患者的胰腺组织中S100A6的表达上调。有学者提出,半乳糖凝集素-3、基质金属蛋白酶-9、脂联素和IL-1受体拮抗剂可作为鉴别2型糖尿病和胰腺癌相关糖尿病的生物标志物。
1.2 胰岛素抵抗
胰岛素抵抗是糖尿病的一个突出特征,同时也可能是胰腺炎后继发糖尿病的一个因素。研究证实,胰源性糖尿病患者均存在肝胰岛素抵抗,胰多肽应答不足在其中起着关键作用。目前,胰多肽已被证实是一种调节肝脏胰岛素敏感性的血糖调节激素,可以逆转胰腺炎中胰岛素受体的减少,对胰多肽缺乏的胰腺炎患者给予胰多肽可逆转肝胰岛素抵抗。除了胰岛素受体可用性改变外,慢性胰腺炎患者肝胰岛素功能的改变也与肝细胞IκBβ和NF-κB的炎症激活有关,阻止NF-κB活化可改善肝脏的胰岛素敏感性。
1.3 促胰岛素效应减少——肠促胰岛素激素的减少
胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)是肠道消化和吸收营养物质时释放的一种激素。GLP-1具有调节胰岛素分泌、延缓胃排空等功能,能够刺激胰岛素的释放,抑制胰高血糖素的分泌,降低食欲,并减缓胃排空。研究发现,GLP-1还可促进胰腺β细胞的生长和分化,保护β细胞的作用。GIP可促进胰岛素释放而抑制α细胞分泌胰高血糖素。这2种激素均可被二肽基肽酶-4迅速灭活。胰腺功能不全时营养物质吸收障碍,肠促胰岛素激素释放减少,餐后胰岛素也相应减少,血糖相应升高。
1.4 肠道菌群紊乱
肠道菌群在促进2型糖尿病的发生中发挥独特作用。肠道微生物群对人体的代谢和炎症反应具有调节功能。菌群紊乱与免疫细胞失调以及炎性细胞因子的水平有关,因此被认为是不同炎症介导疾病的重要因素。慢性胰腺炎发生时的胰腺损伤和炎症反应可导致肠黏膜屏障完整性受损,进而导致肠道微生物群发生变化。肠道生态系统和细菌代谢的变化反之导致糖尿病和代谢异常。因此,肠道微生物群有可能在胰源性糖尿病的发生发展中发挥作用。印度一项研究招募的健康对照、1型糖尿病患者、2型糖尿病患者和继发于慢性胰腺炎的胰源性糖尿病患者中,某些细菌物种的丰度存在明显组间差异,包括瘤胃球菌属和粪杆菌门。另有研究在非糖尿病慢性胰腺炎患者中观察到粪杆菌丰度降低和血浆内毒素增加,这一现象在糖尿病慢性胰腺炎中表现更为明显;空腹和餐后血糖与粪杆菌丰度呈负相关,而内毒素与血糖呈正相关,与胰岛素呈负相关。上述结果提示,肠道微生物疾病与慢性胰腺炎代谢变化相关。
1.5 遗传因素
研究已经确定了慢性胰腺炎的特异性基因,如PRSS1(丝氨酸蛋白酶1),SPINK1(丝氨酸肽酶抑制因子Kazal型1)、CFTR(囊性纤维化跨膜传导调节因子)、CTRC(胰凝乳蛋白酶-C)和CASR(钙敏感受体)。PRSS1基因的突变增强了胰蛋白酶原的自身激活。研究表明,PRSS1外显子区域的突变与慢性胰腺炎继发糖尿病有关。在慢性胰腺炎患者中,外显子异常有60%的概率发展为糖尿病。胰腺癌也具有遗传异质性,早前已报道过的就包括CFTR、BRCA1、BRCA2、CDKN2A、PALB2和ATM基因。有研究表明,有胰腺癌家族史的个体患胰腺癌的风险更高。目前已鉴定出许多易感基因。BRCA2和PALB2是遗传性胰腺癌中最常见的突变基因。CFTR基因突变在年轻时发生胰腺癌的风险为中等。ATM基因突变与家族性胰腺癌易感性相关。
2诊断
目前胰源性糖尿病尚无广泛认可的诊断标准。根据2021年美国糖尿病协会的叙述符合以下标准的患者可以做出诊断:(1)符合糖尿病诊断标准,(2)胰腺分泌功能不全,(3)影像学表明胰腺病理性改变,(4)不具有1型糖尿病相关的自身免疫标志物。
3治疗与管理
目前尚未形成系统的胰源性糖尿病的治疗指南,这使胰源性糖尿病无法得到有效管理。此外在临床中胰源性糖尿病常被误诊为2型糖尿病,这导致治疗效果常常不理想,甚至会导致部分患者预后不良。目前急需提高临床医生对胰源性糖尿病的了解以帮助他们决定使用何种方案来控制患者的症状,进而防止疾病恶化。目前可以从胰源性糖尿病发病机制入手,对该型糖尿病进行基础的控制和治疗。针对胰源性糖尿病应严格控制血糖的升高、解决外分泌功能不全、预防并降低并发症,同时还应重视饮食和营养的管理。
3.1 控制血糖
二甲双胍和胰岛素是胰源性糖尿病最常用的药物,这与近期的几项专家推荐一致。专家推荐将胰岛素作为继发于胰腺炎的糖尿病患者的一线治疗,因为这可以解决胰岛素缺乏的原发性缺陷。胰岛素可有效解决继发于慢性胰腺炎的晚期糖尿病患者胰岛素缺乏所引起的高血糖。然而,使用胰岛素治疗胰源性糖尿病有使患者发生低血糖的风险,尤其是对外周胰岛素敏感性可能增强的慢性胰腺炎患者来说,另外Wu等的研究提及继发于慢性胰腺炎的糖尿病患者使用胰岛素有增加胰腺癌患病的风险。
二甲双胍作为一种胰岛素增敏剂能降低肝葡萄糖的输出并提高外周胰岛素敏感性,常用于大多数2型糖尿病患者的一线治疗用药。Yang等的研究提及使用二甲双胍不仅可以减少每天降血糖所需的胰岛素量还具有保护β细胞的作用,同时二甲双胍的抗肿瘤作用可能降低胰腺癌的发病风险。另外Maida等的实验表明二甲双胍能增强小鼠胰腺GLP-1和GIP受体的基因表达,可对胰岛的胰岛素分泌产生有利影响。二甲双胍还被报道能够延长糖尿病合并非转移性胰腺癌患者的生存期。以上理论及研究可为二甲双胍作为胰源性糖尿病一线用药提供有力支撑。其他治疗2型糖尿病的药物如噻唑烷二酮类药物、α-葡萄糖苷酶抑制剂、磺脲类和二肽基肽酶-4抑制剂等也可用于胰源性糖尿病的治疗,但考虑其副作用一般不作为常规治疗用药。目前尚无确切的治疗指南,对于胰源性糖尿病的治疗只能在监测药物不良反应的基础上使用。
3.2 解决外分泌功能不全
胰源性糖尿病患者常因合并外分泌功能不全而导致消化吸收障碍,进而引发代谢并发症。临床上针对胰腺外分泌障碍常采用胰酶代替治疗的方法。即进食的同时给予胰酶,并持续监测其疗效。胰酶有助于改善胰源性脂肪泻患者对胰岛素的反应,并可逆转GIP反应性的下降。此外,胰腺外分泌功能不全可能导致脂溶性维生素(维生素A、D、E和K)的吸收障碍。Duggan等的研究提及慢性胰腺炎患者尤其是晚期疾病合并脂肪泻患者有极高概率会发生骨量丢失甚至骨质疏松。故应及时补充维生素D以预防代谢性骨疾病。
3.3 日常营养与管理
一旦被诊断为糖尿病后应该立即改变生活方式。在日常生活中应该有意识地调整饮食结构,应优先选择低升糖指数饮食并限制碳水类食物的摄入,以尽可能减少高血糖发生的频率,降低糖尿病并发症发生的风险。同时应避免饮用含糖饮料,除非是发生低血糖时。肥胖患者同时应积极减重、规律运动并戒烟戒酒。
3.4 预防并降低并发症的发生
胰源性糖尿病又被称为“脆性糖尿病”,因胰腺炎症导致胰岛破坏,β细胞(胰岛素)、α细胞(胰高血糖素)、δ细胞(生长抑素)和PP细胞(胰多肽)丢失导致该类糖尿病患者的血糖较难控制,也因此胰源性糖尿病更容易发生低血糖及低血糖相关并发症。故在饮食管理中应优先预防患者经常发生的低血糖事件。促进低血糖的因素还包括碳水化合物吸收不良和不规律的饮食等。针对这些问题应加强对患者进行低血糖相关方面的教育,同时患者还应进行血糖监测,并详细记录血糖水平、饮食摄入、胰酶替代疗法使用情况和运动情况,以积极调整饮食及药物的使用,进而减少患者低血糖及其并发症的发生。
4展望
现阶段由于缺乏对胰源性糖尿病系统的认识,该类型糖尿病常会被误诊为2型糖尿病。但与2型糖尿病相比,胰源性糖尿病患者的血糖控制更难,低血糖发作更频繁、胰岛素使用剂量多、方案更复杂,发生癌症的风险更高,死亡年龄更早,死亡风险更大。所以及时正确地诊断胰源性糖尿病的影响是深远的,能大大提高此类型糖尿病患者的生存和生活质量并大大降低致残率和死亡率。遗憾的是目前胰源性糖尿病完整的发病机制尚不明确,国内尚缺乏有关的流行病学数据,尚无系统高效的用药安全性评估,更未形成得到广泛认可的诊断、治疗和管理指南,这无疑给临床工作带来了巨大的挑战,给胰源性糖尿病患者带来巨大的伤痛,给社会带来巨大的经济损失。期待未来能有更多相关方向的研究来解决目前临床存在的问题。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240532

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















感谢您的分享
24
#发病机制# #胰源性糖尿病#
49