【综述】| 溶瘤病毒联合免疫治疗在恶性肿瘤治疗中的应用进展
2024-08-31 中国癌症杂志 中国癌症杂志 发表于上海
本文从临床获批的OV以及处于研究阶段的天然的或经基因编辑的OV种类、特点及抗肿瘤机制方面展开,同时对处于临床试验阶段的OV治疗进行梳理,总结OV联合治疗策略。
[摘要] 溶瘤病毒(oncolytic virus,OV)疗法通过溶瘤病毒在感染的肿瘤细胞内复制、裂解杀死肿瘤细胞,并促进 “冷”-“热”肿瘤转换重塑肿瘤免疫微环境,诱导机体免疫系统对肿瘤细胞展开攻击从而达到抗肿瘤治疗的目的。病毒种类、病毒自身特征、宿主免疫力、给药途径及瘤种选择是OV高效发挥抗肿瘤作用的关键。随着基因工程技术的发展,OV可以经过基因编辑改造提高其针对肿瘤细胞的靶向性,增强其复制和裂解细胞的潜能并增强宿主抗肿瘤免疫水平,同时通过联合其他治疗方式可以增强抗肿瘤疗效。肿瘤的异质性是提升肿瘤治疗效果需要突破的瓶颈。鉴于目前临床上单一应用OV疗法的疗效有限,而OV疗法与免疫治疗在抗肿瘤作用机制上存在互补,其联合应用可能为肿瘤治疗提供新的策略。本文从临床获批的OV以及处于研究阶段的天然的或经基因编辑的OV种类、特点及抗肿瘤机制方面展开,同时对处于临床试验阶段的OV治疗进行梳理,总结OV联合治疗策略,尤其是联合以免疫检查点抑制剂(immune checkpoint inhibitor,ICI)和过继细胞疗法(adoptive cell therapy,ACT)为代表的肿瘤免疫治疗进行深入阐述,结合本项目组在OV研究中积累的经验提出OV在抗肿瘤治疗中的思考和展望。
[关键词] 溶瘤病毒;免疫治疗;恶性肿瘤;免疫检查点抑制剂;过继细胞疗法
[Abstract] The oncolytic virus (OV) therapy utilizes natural or genetically modified viruses to specifically target and infect tumor cells, leading to the destruction of cancer cells by the replication of the virus itself. This process also alters the immune microenvironment of the tumor transforming “cold” into “hot”, and mobilizes the body's immune system. The effectiveness of oncolytic viruses in anti-tumor therapy depends on factors such as the type of virus, host immunity and route of administration. Immunotherapy aims to activate the immune system and exert anti-tumor effect by relying on autoimmune function. With the development of genetic engineering technology, oncolytic viruses can enhance the anti-tumor effect through gene editing reconstruction, and can be used to treat tumors alone or in combination with other therapies. In view of the limited efficacy of single application of oncolytic virus therapy in clinic, the combination of oncolytic virus therapy and immunotherapy provides a new strategy for tumor treatment. This review started from the types of oncolytic viruses approved in the clinic, characteristics and its anti-tumor mechanisms. At the same time, it combed through the treatment of oncolytic viruses in the clinical trial stage, summarized the combined treatment strategies of oncolytic viruses, especially the combination of tumor immunotherapy represented by immune checkpoint inhibitor (ICI) and adoptive cell therapy (ACT), and put forward some thoughts and prospects of oncolytic viruses in the anti-tumor treatment in combination with the experience accumulated by the project team in the research of oncolytic viruses
[Key words] Oncolytic virus; Immunotherapy; Malignant tumor; Immune checkpoint inhibitor; Adoptive cell therapy
近年来,肿瘤治疗研究发展迅猛,除了传统的手术治疗、放疗、化疗及靶向治疗外,免疫治疗改变了抗肿瘤治疗模式。随着对溶瘤病毒(oncolytic virus,OV)疗法抗肿瘤作用机制认识的进一步加深,OV抗肿瘤治疗成为目前研发的热点之一,OV联合免疫治疗引起了临床上的广泛关注。OV是一类天然的或经基因工程改造的病毒,可选择性地在肿瘤组织内复制并导致肿瘤细胞裂解,并可刺激人体免疫系统激活抗肿瘤免疫,成为肿瘤治疗可选择的方式之一。然而,单一药物的肿瘤治疗策略往往由于肿瘤基因突变及肿瘤微环境(tumor microenvironment,TME)复杂导致疗效不理想。但由于基因工程技术的迅速发展及OV平台的高度灵活,可以直接将影响肿瘤免疫的关键分子引入病毒载体并重塑TME。因此OV联合免疫治疗可能有助于克服实体瘤免疫治疗中的障碍。本文从常见OV作用机制、使用途径、联合包括免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、过继细胞疗法(adoptive cell therapy,ACT)等其他疗法的临床试验方面展开。多项采用改良的OV联合免疫治疗的临床前研究数据展示了良好的发展潜力。
1 OV概述
OV能够在不损害正常细胞的前提下,使用天然或转基因病毒特异性地感染和溶解肿瘤细胞从而发挥抗肿瘤作用[1]。20世纪50年代,使用野生型和非修饰体外传代的病毒株和疫苗株(第1代OV)进行了早期临床试验,随着生物技术和病毒学的发展,病毒治疗领域迅速发展,基因重组技术增强了病毒能力(第2代OV),如腺病毒(adenovirus,Ad)、单纯疱疹病毒(herpes simplex virus,HSV)等可以通过基因工程编辑实现在癌细胞内选择性复制。第3代OV则是在第2代OV的基础上添加治疗性基因修饰病毒,以增强抗肿瘤能力或激活肿瘤免疫的能力。
1.1 临床获批的OV
国内OV研发较早,2005年H101获得中国国家食品药品监督管理局批准用于临床。国际上,2004年Rigvir在拉脱维亚获批用于治疗黑色素瘤,2015年T-VEC获得美国食品药品管理局(Food and Drug Administration,FDA)批准用于治疗恶性黑色素瘤,2021年Delytact (teserpaturev/G47∆)在日本获批用于治疗恶性胶质瘤。
Rigvir是由拉脱维亚Latima公司研发的一种未经过基因改造的ECHO-7肠道病毒,在应用Rigvir的临床前研究和临床试验中,观察到肿瘤边缘及内部形成大簇淋巴细胞,组成肿瘤和正常组织之间的屏障,因此在肿瘤切除前给予Rigvir被认为有利于患者预后[2]。国内于1999年开始研发的OV产品Oncorine(H101)属于重组人5型Ad,于2005年获批用于对常规放疗或放化疗无效并以5-氟尿嘧啶(5-fluorouracil,5-FU)、顺铂方案进行姑息治疗的晚期鼻咽癌患者。本课题组前期研究[3]表明,H101瘤内注射能够诱导肿瘤内CD8+ T淋巴细胞浸润增加,降低调节性T (regulatory T,Treg)淋巴细胞比例,进而增强程序性死亡蛋白-1(programmed death-1,PD-1)单抗的抗肿瘤疗效。T-VEC是源自HSV-1的减毒OV,经过基因编辑增加了其肿瘤选择性并刺激抗肿瘤免疫反应。T-VEC是唯一获得美国FDA批准的针对黑色素瘤的OV,目前正在头颈部肿瘤、膀胱癌、皮肤鳞状细胞癌、软组织肉瘤及三阴性乳腺癌等患者中应用T-VEC进行研究以探索更多适应证。Delytact(teserpaturev/G47∆)是在第2代HSV-1的基础上,对ICP6进行基因改造的第3代HSV-1[4]。G47Δ用于治疗前列腺癌(Ⅱ期)、嗅神经母细胞瘤(Ⅰ期)和恶性胸膜间皮瘤(Ⅰ期)的临床研究正在进行中。
1.2 处于研究阶段的OV种类及特点
目前,有多种病毒的临床前和临床研究正在进行中,常见病毒包括以Ad、HSV和痘苗病毒(vaccinia virus,VACV)等为代表的DNA病毒,以及以柯萨奇病毒(coxsackievirus,CV)和新城疫病毒(newcastle disease virus,NDV)等为代表的RNA病毒。由于病毒的固有特性, CV和NDV等天然病毒可直接裂解肿瘤细胞并引发免疫反应。转基因病毒株通常经过基因修饰提高病毒的溶瘤效果。
1.2.1 CV
CV是一种单正链RNA病毒,属于小核糖核酸病毒科肠道病毒属。它是最小的RNA病毒,包裹于没有包膜的二十面体衣壳中。其中, CVA21已被广泛研究用于抗肿瘤治疗。CVA21通过与细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)的N末端结构域和衰变加速因子(decay accelerating factor,DAF)的第1个短共有重复序列结合而侵入细胞,因而可对抗一系列高表达ICAM-1和DAF的实体瘤,如非肌层浸润性膀胱癌[5]。此外,CVA21被证明可以上调干扰素(interferon,IFN)诱导基因,包括与免疫检查点抑制相关的基因,表明CVA21有希望与ICI联合治疗。
1.2.2 NDV
NDV是副粘病毒科禽副黏病毒属的成员,是一种具有包膜和螺旋对称性的单负链RNA病毒。NDV通过神经氨酸酶受体或唾液糖结合物与宿主细胞表面结合,随后通过内吞作用或非pH依赖性融合侵入细胞[6]。由于IFN信号转导通路的缺陷,NDV对肿瘤细胞具有选择性破坏作用,并使肿瘤细胞对NDV的感染和复制敏感,使NDV有希望用于肿瘤治疗。
1.2.3 Ad
Ad属于Ad科Ad属,是一种双链DNA无包膜病毒,其核衣壳呈二十面体立体对称。Ad因其具有感染效率高、不整合到靶细胞基因组、可同时感染增殖和非增殖期细胞、容易获得符合治疗质量规范的高病毒滴度等特点被广泛用作基因治疗载体。多次给药后中和抗体的出现能够显著影响OV的效能,因此通过治疗基因修饰增强病毒感染、复制能力是研究的重点。
1.2.4 HSV
HSV是一种直径约为100 nm的包膜双链线性DNA病毒。近期HSV的研究热度颇高,尤其是T-VEC、G47Δ等获批用于临床后[7]。此外,与许多其他仅与单个受体结合的病毒不同,HSV具有4个细胞受体,并且具有广泛的宿主范围,使病毒能够感染和复制几乎所有细胞系[8],因此源自HSV的OV可以用于治疗不同类型的肿瘤。
1.2.5 VACV
VACV是一种双链DNA病毒,具有包膜,属于痘病毒科正痘病毒属,其基因组约190 kb。作为OV,VACV具有独特的优势,包括良好的静脉内稳定性可以全身使用、良好的免疫原性、允许插入和表达大型外源基因的能力等[9],JX-594是一款基于VACV的衍生OV,删除胸腺激酶基因并插入GM-CSF及β-半乳糖苷酶基因,多项临床试验[10-13]提示静脉或瘤内注射JX-594用于治疗肝癌、结直肠癌、膀胱癌及骨肉瘤等恶性肿瘤安全有效。
1.2.6 其他
除了以上详述的病毒外,还有呼肠弧病毒、麻疹病毒、寨卡病毒、M1天然病毒和脊髓灰质炎病毒等多种病毒[14],也具有良好的安全性和天然的肿瘤倾向性,在临床或临床前研究中展现出巨大潜力,有望成为有前途的OV候选药物。
2 OV的抗肿瘤机制新认识
OV能够直接杀伤肿瘤细胞,也能够诱导机体免疫,包括诱导先天免疫和适应性免疫,同时还需要平衡抗肿瘤免疫和机体抗病毒免疫。综合目前研究[15]可知,OV在不影响正常细胞的前提下,优先靶向肿瘤细胞,通过募集免疫细胞和激活全身抗癌免疫,诱导机体免疫,并将“冷”肿瘤转变为“热”肿瘤,从而达到抑制肿瘤生长的目的。
2.1 OV直接溶解肿瘤细胞
由于肿瘤细胞的正常抗病毒机制受损,OV得以选择性地感染肿瘤细胞而不影响正常细胞[16]。除少部分病毒对肿瘤表现出先天的趋向性外,大部分病毒必须进行基因工程改造才能选择性感染肿瘤细胞。最常见的Ad改建就是通过改变衣壳,增强病毒与肿瘤细胞特异性受体的结合,进而选择性裂解肿瘤细胞,例如,靶向病毒衣壳功能位点的Ad5-3M能够特异性抑制肺癌细胞生长并对抗抗病毒免疫[17]。OV在感染的肿瘤细胞中增殖、裂解并释放出大量具有相同感染性的复制体,进一步感染周围肿瘤细胞,从而放大其溶瘤效应[18-19]。
2.2 OV抗肿瘤免疫效应
2.2.1 OV诱导先天免疫反应
大多数肿瘤存在于免疫抑制性微环境中[20],OV可以诱导有效的抗病毒反应。OV感染后,病毒衣壳、核酸和蛋白质等病原相关分子模式(pathogen-associated molecular pattern,PAMP)暴露在宿主免疫系统中,通过诱导感染细胞的内质网应激和免疫原性细胞死亡(immunogenic cell death,ICD)激活抗肿瘤免疫,导致肿瘤细胞释放损伤相关分子模式(damage-associated molecular pattern,DAMP)[21]。有研究[22]表明,与肿瘤细胞凋亡优先诱导免疫耐受不同,肿瘤细胞ICD更倾向于促进免疫反应的激活。这些DAMP和PAMP被固有免疫细胞的模式识别受体识别后,触发细胞因子的释放以募集和激活免疫细胞。激活的免疫细胞通过触发FAS-FASL信号杀死病毒感染的细胞,并进一步刺激细胞因子的产生从而放大先天免疫反应[23]。
2.2.2 OV诱发抗肿瘤适应性免疫
OV诱发的抗肿瘤适应性免疫主要是由特异性T淋巴细胞介导的细胞免疫。肿瘤细胞裂解释放的抗原经抗原递呈细胞处理后以主要组织相容性复合体(major histocompatibility complex,MHC)形式呈现在细胞表面,并引发特异性效应T淋巴细胞应答的激活。肿瘤抗原加工和提呈途径中,MHC Ⅰ类表达及其他因子的下调是肿瘤免疫逃避的重要机制,因此许多治疗性OV已被设计为缺失编码ICP47的基因(如T-VEC),以防止抑制肿瘤相关抗原的加工和提呈。有临床前研究数据[24]表明,OV可以克服抗原加工和提呈的缺陷,进一步促进带瘤机体的T淋巴细胞活化,活化的T淋巴细胞在肿瘤引流淋巴结中克隆扩增,并以OV依赖的方式响应趋化因子迁移至肿瘤,进而表达MHC Ⅰ类分子的肿瘤细胞提呈肿瘤特异性抗原,最终被活化的CD8+ T淋巴细胞靶向并清除。此外,部分OV还通过激活体液免疫,诱导特异性B淋巴细胞的激活来产生抗病毒抗体。既往研究[25]表明,抗体对病毒清除的影响取决于病毒的类型和感染的细胞类型。
2.3 机体抗病毒免疫和抗肿瘤免疫调节
肿瘤内特异性病毒复制和诱导肿瘤特异性免疫是保证OV成功提高疗效的两个主要因素。一方面TME的变化促进免疫介导的肿瘤细胞的识别和根除,并引发肿瘤相关抗原和表位扩散,另一方面先前病毒暴露的中和抗体可能会阻止病毒复制和肿瘤细胞的持续感染。因此,治疗结果取决于病毒-肿瘤细胞-宿主之间复杂的相互作用,即在病毒能足够复制和直接杀死肿瘤细胞的前提下,诱导并启动机体的抗肿瘤免疫,例如,OV感染细胞产生的IFN和趋化因子募集并激活先天淋巴细胞,增加肿瘤细胞程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)的表达[26],使其更容易受到检查点阻断的影响,为联合ICI治疗提供了基础。
3 OV的应用途径
合适的给药途径是OV高效发挥抗肿瘤作用的关键,瘤内给药是目前较常见的给药方式,静脉给药具有操作相对简便、可同时感染肿瘤原发灶和转移灶的优势,是目前研究的热点,其他如腹腔内给药、超选动脉内给药及鼻腔内给药等途径针对不同的患者人群也存在一定的优势。
3.1 瘤内给药
瘤内给药是目前临床试验中最常见的选择,其有助于将精准剂量的病毒颗粒递送至注射的肿瘤部位,提高局部浓度,增加局部效应,减少不良反应。手术联合病灶内注射T-VEC治疗使可切除的ⅢB~ⅣM1a期黑色素瘤患者的复发风险降低25%[27]。一项针对不可切除的ⅢC~Ⅳ期黑色素瘤的Ⅰb期研究[28]直接将OrienX010注射到肿瘤病变部位后,在转移瘤内表现出抗肿瘤作用。美国FDA批准通过瘤内给药的方式应用T-VEC治疗转移性黑色素瘤,因此OV的瘤内给药已成为成熟的治疗策略。但由于实体肿瘤组织密度、瘤内压力及肿瘤位于深部或存在广泛转移,使得OV进行瘤内给药存在一定的局限性。
3.2 静脉给药
在临床试验中,静脉给药是OV的另一种给药方式,通过全身递送OV可以同时感染肿瘤的原发灶和转移灶。此外静脉注射操作方便,一定程度上能提高患者的依从性。然而,静脉注射OV后,由于宿主的免疫反应以及肝脏、肺、脾脏的非特异性聚集等使得病毒颗粒在到达感染肿瘤细胞前会被迅速清除,难以达到理想的疗效。优化OV的全身递送策略是目前研究的热点,包括基于细胞的载体、生物工程细胞模拟物包裹OV颗粒等[29]。本课题组前期通过钙磷复合磷脂OV减少中和抗体作用,实现了有效的静脉递送[30]。对OV进行基因工程改造也是实现OV静脉递送的方式之一。VACV在其生活周期中会产生胞内成熟病毒(intracellular mature virus, IMV)和胞外囊膜病毒(extracellular enveloped virus,EEV)两种感染性的病毒颗粒。IMV易因血液中的成分导致失活,EEV有一层来自于宿主细胞的外膜,外膜上携带着能抑制补体活性的补体调节蛋白,从而抵抗机体抗病毒作用,选择可能与VACV EEV释放的关键步骤相关的基因进行改造也是目前努力探索的方向。
3.3 其他给药方式
目前瘤内给药和静脉给药策略已被广泛研究,其他的给药方式仍在探索中。颈外动脉输注重组Ad-p53联合化疗可显著提高Ⅲ期口腔鳞状细胞癌患者的生存率。此外,动脉内给药显示出比瘤内或静脉输注重组Ad-p53更高的总体临床缓解率[31]。由于给药技术相对容易实施,腹腔内注射对于腹膜恶性肿瘤是理想的治疗途径,腹膜内注射溶瘤Ad治疗恶性腹水的Ⅱ期临床研究[32]发现能够显著延长重复引流间隔时间。与上述侵入性递送不同,OV的无创鼻内给药被认为是治疗恶性胶质瘤的一种更可接受和可重复的方法,过表达CXCR4的神经干细胞能够有效地将OV递送至人神经胶质瘤异种移植物中,并通过鼻内途径提高小鼠的存活率[33]。
4 OV联合免疫治疗研究的进展
肿瘤免疫疗法通过重新激活抗肿瘤免疫反应并克服肿瘤逃逸机制实现抗肿瘤作用,包括ICI、ACT等。单一应用OV难以完全克服由肿瘤异质性和免疫抑制微环境引起的T淋巴细胞功能丧失等,OV联合ICI或ACT可以重塑TME,促进T淋巴细胞向肿瘤浸润,逆转T淋巴细胞凋亡,实现更高的抗肿瘤效率。检索美国临床试验数据库(ClinicalTrials.gov)截至2023年10月31日的数据显示,共有178项不同阶段的与OV相关的临床试验正在进行中,其中45项与联合免疫治疗相关。在这些试验中,38种OV产品注册用于治疗各种实体肿瘤,包括黑色素瘤、头颈部肿瘤、宫颈癌、膀胱癌、胰腺癌、乳腺癌和肺癌等,其中大多数研究处于早期阶段。具有代表性的正在进行或已完成的OV联合ICI或ACT的临床试验见表1。
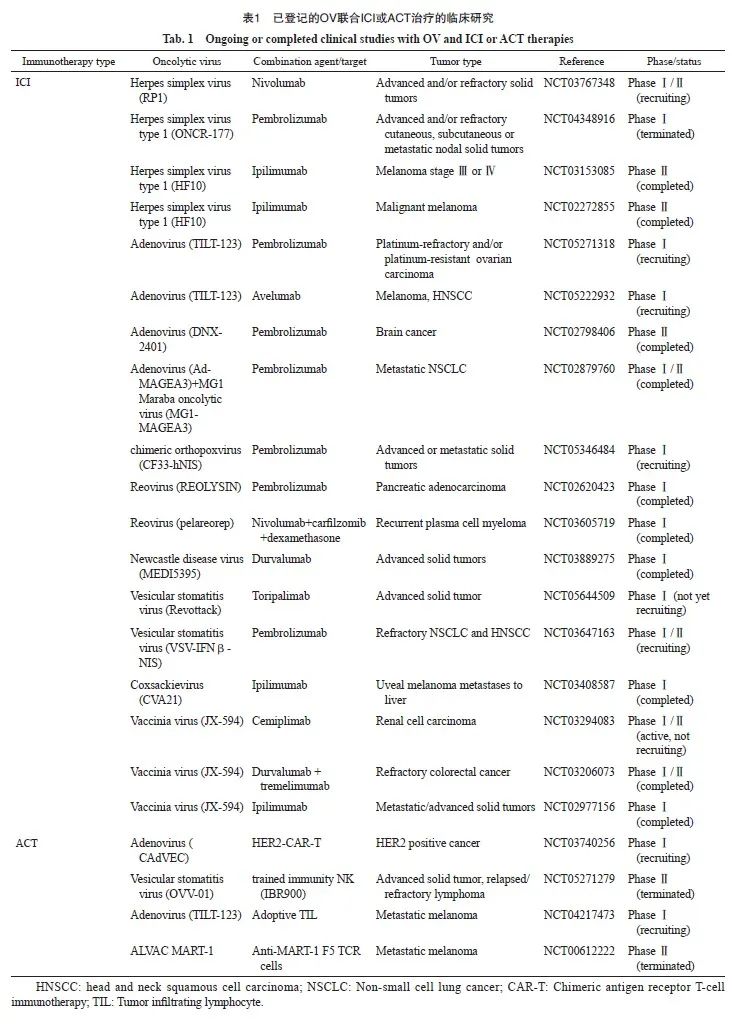
4.1 OV联合ICI治疗
ICI治疗肿瘤临床运用较广泛的包括PD-1/PD-L1单抗及细胞毒性T淋巴细胞相关抗原4 (cytotoxic T lymphocyte associated antigen-4,CTLA-4)抗体,尽管临床上ICI的应用改变了既往晚期肿瘤的治疗模式,但单药治疗的总体有效率有限,存在原发性耐药。编码携带细胞因子的OV将重塑TME为促炎状态,并诱导肿瘤PD-L1表达水平显著提高[34],有助于改善ICI治疗的临床疗效。在神经胶质瘤小鼠模型中,瘤内注射DNX-2041病毒与全身伊匹木单抗的联合治疗比单独使用病毒或伊匹木单抗治疗的存活率更高[34]。一项Ⅱ期临床试验[35]评估了T-VEC和伊匹木单抗联合治疗晚期不可切除黑色素瘤患者的疗效和安全性,与单独使用伊匹木单抗相比,联合治疗观察到更高的客观缓解率。上述研究提示OV联合ICI治疗可以改善患者的疗效。
然而,一项JX-594联合度伐利尤单抗及曲美木单抗治疗难治性转移性结直肠癌的Ⅰ/Ⅱ期试验[36]发现,与美国FDA批准的转移性结直肠癌三线治疗方案相比,联合治疗并未显著改善无进展生存期(NCT03206073)[37],阴性结果表明在选择OV和ICI的组合时应考虑肿瘤进展、OV给药的频率和剂量以及ICI给药的最佳时机等关键问题,同时需进一步探索阐明潜在的预测性生物标志物,预测潜在从各联合治疗组合中获益的人群。
此外,Kleinpeter等[38]研究证明编码抗PD-1抗体的OV比单独OV或单独抗PD-1治疗可以更好地控制肿瘤生长,因此直接将ICI编码入基因组是目前OV改建的方式之一。
4.2 OV联合过继性细胞疗法治疗肿瘤
ACT常见的治疗方式包括肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)治疗、T细胞受体工程化T(T-cell receptor engineered T,TCR-T)细胞疗法和嵌合抗原受体T(chimeric antigen receptor T,CAR-T)细胞疗法等。目前,ACT主要在治疗血液系统恶性肿瘤中取得成功,而针对实体瘤的疗效欠佳,其原因主要是T淋巴细胞在肿瘤中浸润不良及高度免疫抑制的TME[39],而经过修饰的OV可通过分泌细胞因子和提供特异性抗原克服运输障碍并逆转免疫抑制性TME以增强肿瘤清除效果。
细胞因子是逆转TME免疫抑制性并促进T细胞存活和扩增的关键。有研究[40]发现,基因修饰表达白细胞介素-21(interleukin-21,IL-21)的溶瘤牛痘病毒在肿瘤治疗中显示出与CAR-T细胞疗法的显著协同作用。另一项动物模型研究[41]将编码TNF-α和IL-2的溶瘤Ad和TIL联合治疗,联合治疗组的疗效显著优于单独用药组。趋化因子减少会影响T淋巴细胞的靶向性[39], Wang等[42]研究发现,单独应用CAR-T细胞疗法不能抑制胶质母细胞瘤小鼠模型肿瘤生长,但与CXCL11修饰的溶瘤Ad联合给药时,观察到更高水平的CAR-T细胞浸润和抗肿瘤作用。设计OV完善肿瘤抗原递送可以提高ACT治疗实体瘤的效果。Ye等[43]通过联合TIL与编码OX40L和IL12的OV有效地将肿瘤细胞原位转化为抗原提呈细胞(antigen presenting cell,APC),显著增强TIL过继疗法在各种实体瘤中的疗效。有研究[44]用表达CD19的溶瘤VACV感染肿瘤细胞,可在表面产生CD19,在与CD19-CAR-T细胞共培养时,T淋巴细胞的细胞毒性显著增加,与单一疗法相比,这种联合疗法肿瘤显著消退。联合TCR-T细胞疗法也观察到相似的结果,有研究[45]应用OV与特异性TCR-T细胞治疗黑色素瘤小鼠,在接受联合治疗的小鼠中实现了完全和持久的肿瘤消退并且生存期显著延长。
在探索优化联合治疗效果的研究中,多种OV联合ACT方案取得了突破性结果。Rosewell等[46]改造溶瘤Ad使其表达PD-L1抗体并与CAR-T细胞疗法联合应用于头颈部鳞状细胞癌模型中,结果显示,联合治疗的效果优于单一治疗,同时优于未改造的溶瘤Ad联合CAR-T细胞疗法。Zheng等[47]提出一种新型耐药肿瘤治疗模式,联合MYSV与CAR-T/TCR-T细胞疗法协同作用能够诱导一种新型的癌细胞死亡方式—自亡,高效地靶向并摧毁癌细胞。此外,欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会上公布的一项临床试验(NCT04217473)[48]数据显示了联合应用溶瘤Ad TILT-123与TIL疗法用于治疗晚期转移性黑色素瘤的安全性和可行性,并发现其对具有ICI抗性的转移性黑色素瘤也有效。
虽然OV可以提高ACT对实体瘤的疗效,但对于多发转移及深部肿瘤很难进行直接瘤内注射,而静脉注射OV虽可治疗远处转移性实体瘤,但又存在瘤内靶向效率欠佳、细胞因子风暴等风险。因此,未来需要研究如何克服上述问题以提高OV的瘤内局部浓度,并使其具有低毒性、全身递送和更高的临床效益。
5 展望
OV是利用天然或转基因病毒,选择性地感染肿瘤细胞,通过病毒自身的复制杀死并裂解癌细胞,并将“冷”肿瘤转变为“热”肿瘤,引导免疫系统对其他癌细胞甚至远端病灶展开攻击以达到抗肿瘤治疗目的。肿瘤的异质性限制了单一方法抗肿瘤治疗的效果。病毒基因组具有可编辑、修饰性强的特点,使用OV平台通过基因工程改造来增强免疫系统抗肿瘤效应用于肿瘤治疗值得期待。联合用药的策略被认为是未来肿瘤治疗的主导方向。值得注意的是,联合治疗并不是简单叠加,而是在作用机制上相互补充,此外还需同时充分考虑病毒种类、剂量、给药途径、肿瘤类型和分期、宿主免疫力等多种因素,选择合适的治疗策略。迄今为止,OV与ICI或ACT的组合已在临床前研究和部分临床试验中取得成功,应进一步努力在癌症治疗中实现改良OV单一疗法或OV与其他免疫疗法的组合以改善疗效。如何修饰OV和选择联合策略在提高安全性和疗效的同时减少不良反应,是未来肿瘤研究领域取得突破和实现肿瘤精准治疗的关键。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
梁滢昀:撰写并修改文章;
陈健华:审阅文章。
[参考文献]
[1] MA J, RAMACHANDRAN M, JIN C, et al. Characterization of virus-mediated immunogenic cancer cell death and the consequences for oncolytic virus-based immunotherapy of cancer[J]. Cell Death Dis, 2020, 11(1): 48
[2] FU Q F, CHEN N, GE C L, et al. Prognostic value of tumorinfiltrating lymphocytes in melanoma: a systematic review and meta-analysis[J]. Oncoimmunology, 2019, 8(7): 1593806
[3] HUANG L L, ZHAO H X, SHAN M Y, et al. Oncolytic adenovirus H101 ameliorate the efficacy of anti-PD-1 monotherapy in colorectal cancer[J]. Cancer Med, 2022, 11(23): 4575-4587
[4] TODO T, ITO H, INO Y, et al. Intratumoral oncolytic herpes virus G47Δ for residual or recurrent glioblastoma: a phase 2 trial[J]. Nat Med, 2022, 28(8): 1630-1639
[5] ANNELS N E, MANSFIELD D, ARIF M, et al. Phase Ⅰ trial of an ICAM-1-targeted immunotherapeutic-coxsackievirus A21 (CVA21) as an oncolytic agent against non muscle-invasive bladder cancer[J]. Clin Cancer Res, 2019, 25(19): 5818-5831
[6] BOMMAREDDY P K, SHETTIGAR M, KAUFMAN H L. Integrating oncolytic viruses in combination cancer immunotherapy[J]. Nat Rev Immunol, 2018, 18(8): 498-513
[7] FU X P, ZHANG X L. Potent systemic antitumor activity from an oncolytic herpes simplex virus of syncytial phenotype[J]. Cancer Res, 2002, 62(8): 2306-2312
[8] ZHAO J, QIN C, LIU Y Z, et al. Herpes simplex virus and pattern recognition receptors: an arms race[J]. Front Immunol, 2020, 11: 613799
[9] GUO Z S, LU B F, GUO Z B, et al. Vaccinia virus-mediated cancer immunotherapy: cancer vaccines and oncolytics[J]. J Immunother Cancer, 2019, 7(1): 6
[10] TOULMONDE M, COUSIN S, KIND M, et al. Randomized phase 2 trial of intravenous oncolytic virus JX-594 combined with low-dose cyclophosphamide in patients with advanced soft-tissue sarcoma[J]. J Hematol Oncol, 2022, 15(1): 149
[11] PORTAL D E, WEISS R E, WOJTOWICZ M, et al. Phase Ⅰ neoadjuvant study of intravesical recombinant fowlpox GMCSF (rF-GM-CSF) or fowlpox-TRICOM (rF-TRICOM) in patients with bladder carcinoma[J]. Cancer Gene Ther, 2020, 27(6): 438-447
[12] PARK S H, BREITBACH C J, LEE J, et al. Phase 1b trial of biweekly intravenous pexa-vec (JX-594), an oncolytic and immunotherapeutic vaccinia virus in colorectal cancer[J]. Mol Ther, 2015, 23(9): 1532-1540
[13] HEO J, REID T, RUO L, et al. Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer[J]. Nat Med, 2013, 19(3): 329-336
[14] PONCE S, CEDRÉS S, RICORDEL C, et al. ONCOS-102 plus pemetrexed and platinum chemotherapy in malignant pleural mesothelioma: a randomized phase 2 study investigating clinical outcomes and the tumor microenvironment[J]. J Immunother Cancer, 2023, 11(9): e007552
[15] ZHU Z, ROBERT MCGRAY A J R, JIANG W J, et al. Improving cancer immunotherapy by rationally combining oncolytic virus with modulators targeting key signaling pathways[J]. Mol Cancer, 2022, 21(1): 196
[16] XIA T L, KONNO H, BARBER G N. Recurrent loss of STING signaling in melanoma correlates with susceptibility to viral oncolysis[J]. Cancer Res, 2016, 76(22): 6747-6759
[17] ATASHEVA S, EMERSON C C, YAO J, et al. Systemic cancer therapy with engineered adenovirus that evades innate immunity[J]. Sci Transl Med, 2020, 12(571): eabc6659
[18] MCLAUGHLIN M, PEDERSEN M, ROULSTONE V, et al. The PERK inhibitor GSK2606414 enhances reovirus infection in head and neck squamous cell carcinoma via an ATF4- dependent mechanism[J]. Mol Ther Oncolytics, 2020, 16: 238-249
[19] DAVOLA M E, MOSSMAN K L. Oncolytic viruses: how “lytic” must they be for therapeutic efficacy? [J]. Oncoimmunology, 2019, 8(6): e1581528
[20] QUAIL D F, JOYCE J A. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19(11): 1423-1437
[21] ANG L, LI J, DONG H, et al. Chimeric oncolytic adenovirus armed chemokine rantes for treatment of breast cancer[J]. Bioengineering, 2022, 9(8): 342
[22] BRACCI L, SCHIAVONI G, SISTIGU A, et al. Immunebased mechanisms of cytotoxic chemotherapy: implications for the design of novel and rationale-based combined treatments against cancer[J]. Cell Death Differ, 2014, 21(1): 15-25
[23] GUJAR S, POL J G, KIM Y, et al. Antitumor benefits of antiviral immunity: an underappreciated aspect of oncolytic virotherapies[J]. Trends Immunol, 2018, 39(3): 209-221
[24] LUO Y, LIN C L, ZOU Y D, et al. Tumor-targeting oncolytic virus elicits potent immunotherapeutic vaccine responses to tumor antigens[J]. Oncoimmunology, 2020, 9(1): 1726168
[25] MACEDO N, MILLER D M, HAQ R, et al. Clinical landscape of oncolytic virus research in 2020[J]. J Immunother Cancer, 2020, 8(2): e001486
[26]BELLUCCI R, MARTIN A, BOMMARITO D, et al. Interferon-γ-induced activation of JAK1 and JAK2 suppresses tumor cell susceptibility to NK cells through upregulation of PD-L1 expression[J]. Oncoimmunology, 2015, 4(6): e1008824
[27]DUMMER R, GYORKI D E, HYNGSTROM J, et al. Neoadjuvant talimogene laherparepvec plus surgery versus surgery alone for resectable stage ⅢB-ⅣM1a melanoma: a randomized, open-label, phase 2 trial[J]. Nat Med, 2021, 27(10): 1789-1796
[28]CUI C L, WANG X, LIAN B, et al. OrienX010, an oncolytic virus, in patients with unresectable stage ⅢC-Ⅳ melanoma: a phase Ⅰb study[J]. J Immunother Cancer, 2022, 10(4): e004307
[29]MARTINEZ-QUINTANILLA J, SEAH I, CHUA M, et al. Oncolytic viruses: overcoming translational challenges[J]. J Clin Invest, 2019, 129(4): 1407-1418
[30]CHEN J H, GAO P, YUAN S J, et al. Oncolytic adenovirus complexes coated with lipids and calcium phosphate for cancer gene therapy[J]. ACS Nano, 2016, 10(12): 11548-11560
[31]LI Y, LI L J, WANG L J, et al. Selective intra-arterial infusion of rAd-p53 with chemotherapy for advanced oral cancer: a randomized clinical trial[J]. BMC Med, 2014, 12: 16
[32]ZHANG Y L, QIAN L, CHEN K, et al. Oncolytic adenovirus in treating malignant ascites: a phase Ⅱ trial and longitudinal single-cell study[J]. Mol Ther, 2024, 32(6): 2000-2020
[33]DEY M, YU D, KANOJIA D, et al. Intranasal oncolytic virotherapy with CXCR4-enhanced stem cells extends survival in mouse model of glioma[J]. Stem Cell Reports, 2016, 7(3): 471-482
[34]BELCAID Z, BERREVOETS C, CHOI J, et al. Low-dose oncolytic adenovirus therapy overcomes tumor-induced immune suppression and sensitizes intracranial gliomas to anti-PD-1 therapy[J]. Neurooncol Adv, 2020, 2(1): vdaa011
[35]CHESNEY J A, PUZANOV I, COLLICHIO F A, et al. Talimogene laherparepvec in combination with ipilimumab versus ipilimumab alone for advanced melanoma: 5-year final analysis of a multicenter, randomized, open-label, phase Ⅱ trial[J]. J Immunother Cancer, 2023, 11(5): e006270
[36]BEKAII-SAAB T, KIM R, KIM T W, et al. Third- or later-line therapy for metastatic colorectal cancer: reviewing best practice[J]. Clin Colorectal Cancer, 2019, 18(1): e117-e129
[37]MONGE C, XIE C Q, MYOJIN Y, et al. Phase Ⅰ/Ⅱ study of PexaVec in combination with immune checkpoint inhibition in refractory metastatic colorectal cancer[J]. J Immunother Cancer, 2023, 11(2): e005640
[38]KLEINPETER P, FEND L, THIOUDELLET C, et al. Vectorization in an oncolytic vaccinia virus of an antibody, a Fab and a scFv against programmed cell death-1 (PD-1) allows their intratumoral delivery and an improved tumor-growth inhibition[J]. Oncoimmunology, 2016, 5(10): e1220467
[39]ELLIS G I, SHEPPARD N C, RILEY J L. Genetic engineering of T cells for immunotherapy[J]. Nat Rev Genet, 2021, 22(7): 427-447
[40]CHEN T Y, DING X Q, LIAO Q B, et al. IL-21 arming potentiates the anti-tumor activity of an oncolytic vaccinia virus in monotherapy and combination therapy[J]. J Immunother Cancer, 2021, 9(1): e001647
[41]SANTOS J, HEINIÖ C, QUIXABEIRA D, et al. Systemic delivery of oncolytic adenovirus to tumors using tumor-infiltrating lymphocytes as carriers[J]. Cells, 2021, 10(5): 978
[42]WANG G Q, ZHANG Z L, ZHONG K H, et al. CXCL11-armed oncolytic adenoviruses enhance CAR-T cell therapeutic efficacy and reprogram tumor microenvironment in glioblastoma[J]. Mol Ther, 2023, 31(1): 134-153
[43]YE K, LI F, WANG R K, et al. An armed oncolytic virus enhances the efficacy of tumor-infiltrating lymphocyte therapy by converting tumors to artificial antigen-presenting cells in situ[J]. Mol Ther, 2022, 30(12): 3658-3676
[44]PARK A K, FONG Y, KIM S I, et al. Effective combination immunotherapy using oncolytic viruses to deliver CAR targets to solid tumors[J]. Sci Transl Med, 2020, 12(559): eaaz1863
[45]WALSH S R, BASTIN D, CHEN L, et al. Type Ⅰ IFN blockade uncouples immunotherapy-induced antitumor immunity and autoimmune toxicity[J]. J Clin Invest, 2019, 129(2): 518-530
[46]ROSEWELL SHAW A, PORTER C E, WATANABE N, et al. Adenovirotherapy delivering cytokine and checkpoint inhibitor augments CAR T cells against metastatic head and neck cancer[J]. Mol Ther, 2017, 25(11): 2440-2451
[47]ZHENG N B, FANG J, XUE G, et al. Induction of tumor cell autosis by myxoma virus-infected CAR-T and TCR-T cells to overcome primary and acquired resistance[J]. Cancer Cell, 2022, 40(9): 973-985.e7
[48]PAKOLA S A, PELTOLA K J, CLUBB J H , et al. Safety, efficacy, and biological data of T cell-enabling oncolytic adenovirus TILT-123 in advanced solid cancers from the TUNIMO monotherapy phase Ⅰ trial[J]. Clin Cancer Res, 2024.[Epub Ahead of Print]
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#免疫治疗# #溶瘤病毒# #恶性肿瘤# #免疫检查点抑制剂# #过继细胞疗法#
89