Nature:破解DNA复制的密码:人类MCM双六聚体加载机制的首次全面解析
2024-12-02 生物探索 生物探索 发表于陕西省
本文阐述 DNA 复制中人类细胞 MCM 双六聚体加载机制研究,介绍方法、奥秘及意义,为理解生命和相关医学发展带来新启示。
引言
每一个细胞分裂的背后都隐藏着一场壮观而精密的分子协奏曲,而DNA复制正是这场演出的开场曲。每当细胞分裂,DNA必须被完美复制,以确保新细胞能接收到完整的遗传信息。然而,这一过程远非简单,它需要一个分子机器——微管状复制复合体(MCM)的参与。MCM是DNA复制的核心工具,它以头对头的双六聚体形式加载在DNA上,像一把解旋的钥匙,为DNA复制叉的形成做好准备。然而,人类细胞中这一过程的细节却长期被研究人员视为“黑匣子”。是什么驱动了MCM的加载?DNA如何解旋?这些分子事件如何在一个高度复杂的基因组中实现精准调控?这些问题不仅与生命的本质息息相关,还涉及基因组稳定性、癌症发生机制等重要领域。
过去,酵母细胞中MCM加载的机制已经被详细解析,但人类细胞的复制起始却远比酵母复杂。与酵母不同,人类细胞的DNA复制起始点分布广泛且不依赖特定的序列,这使得MCM加载过程更为灵活但也更加神秘。11月27日 Nature 的研究报道“MCM double hexamer loading visualized with human proteins”,首次结合生化重组和冷冻电子显微镜技术,成功重现了人类微管状复制复合体(MCM)双六聚体的加载过程。这项突破性研究不仅揭示了MCM加载的核心步骤,还发现了与酵母显著不同的加载路径与调控模式。这些发现为我们提供了一扇窥探生命复制奥秘的窗,也为理解基因组稳定性的调控机制、开发抗癌药物和优化基因编辑技术带来了全新的启示。

DNA复制:从酵母到人类的科学进化
DNA复制的起始,需要多个蛋白质复合体的紧密协作。起始识别复合体(ORC),相当于“指挥官”,负责招募其他因子;CDC6与CDT1,像是“工程师”,帮助安装MCM复合体;MCM2–7,DNA解旋的“工具”,加载为头对头的双六聚体,确保两条新链复制同步。
然而,人类细胞与酵母有着显著不同。
复制起始点的灵活性:酵母的复制起始点依赖严格的DNA序列,而人类细胞则几乎不挑剔;
加载调控的复杂性:酵母的ORC6是必需因子,但在人类中,它的作用竟然可被替代。
这些特性让人类MCM加载的机制显得扑朔迷离,也为研究人员提出了一个核心问题:人类细胞如何在这看似混乱的起始点中,确保DNA复制的精准进行?
研究方法:还原DNA复制的分子拼图
为了揭示人类MCM加载的奥秘,研究人员设计了一套巧妙的实验方案:
蛋白表达与制备
使用杆状病毒系统分别纯化了ORC1–5、ORC6、CDC6、CDT1和MCM2–7蛋白。实验发现ORC6无法与其他ORC蛋白共纯化,需单独制备;CDT1与MCM也需分离表达,以防非特异性结合。
研究团队进一步制备了去除N端非结构化区域(IDR)的突变蛋白,以避免非特异性液液相分离现象对实验结果的干扰。
核酸酶保护实验
想象一片DNA像是河流,加载的蛋白像桥梁。核酸酶保护实验通过降解未被保护的DNA区域,精确标记“桥梁”保护的范围。初始阶段,加载的MCM形成约75 bp的保护片段;完成阶段,保护片段缩短至55 bp,显示额外接触区域的消失。
冷冻电子显微镜(Cryo-EM)
冷冻电镜技术提供了原子级别的分辨率,帮助研究人员直接观察到人类微管状复制复合体的双六聚体(human MCM Double Hexamer, hDH)加载的分子结构,包括六聚体之间的结合方式、DNA解旋的精细过程及ATP酶的活性位点分布。
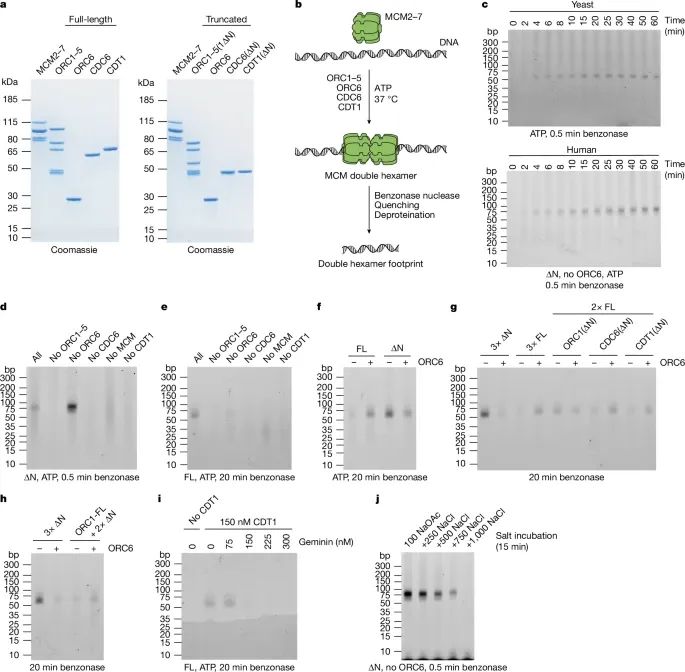
人类MCM双六聚体(hDH)加载的重构实验(Credit: Nature)
该图展示了重建人类MCM双六聚体加载过程的实验设计、关键技术和主要结果,具体分为以下几个部分:
蛋白纯化和检测(图a)实验中使用了全长蛋白和N端非结构域(IDR)删除突变蛋白(∆N蛋白),包括:ORC1–5复合体(含ORC1(∆N)),CDC6(∆N)和CDT1(∆N)。纯化的蛋白通过SDS-PAGE电泳分离后用考马斯蓝染色,左侧为全长蛋白,右侧为∆N突变蛋白,显示各蛋白的纯度和表达情况。结果验证了重组蛋白的制备质量,确保后续实验的可靠性。
核酸酶保护实验流程(图b)
核酸酶保护实验用于检测MCM加载过程中DNA与蛋白复合物的结合区域。实验中:加载反应后用Benzonase酶切处理去除未保护的DNA;用EDTA、SDS和蛋白酶K终止反应;通过苯酚-氯仿-异戊醇提取纯化剩余DNA;将DNA分离后通过TBE聚丙烯酰胺凝胶电泳分析,并用SYBR Gold染色检测。
时间依赖性实验(图c)对比了酵母和人类MCM加载反应的时间依赖性,分为两组:上图(酵母MCM加载),加载过程中,保护的DNA片段在2-4分钟时开始形成,最终长度约为55 bp。下图(人类MCM加载),类似地,在∆N突变蛋白条件下,人类MCM加载产生了约75 bp的保护片段,随后逐渐缩短为55 bp。这表明两者在加载过程中均表现出时间依赖性,但人类系统存在更广泛的初始接触区域。
∆N蛋白与全长蛋白的比较(图d和e)图d,∆N突变蛋白的核酸酶保护实验,逐步去除关键蛋白(如ORC6、CDC6、CDT1)后观察保护片段的变化。结果表明,缺失ORC6对hDH加载影响较小。 图e,全长蛋白条件下的实验,显示ORC6存在时加载效率略高,但并非绝对必需。
全长与∆N蛋白的依赖性差异(图f)对比了全长蛋白和∆N蛋白在加载过程中对ORC6的依赖性。结果表明:在全长蛋白条件下,ORC6促进了加载;而在∆N突变蛋白条件下,ORC6的加入反而抑制了加载。
不同蛋白截短对加载的影响(图g和h)图g,分别截短ORC1、CDC6和CDT1后,发现ORC1的N端非结构化区域(IDR)是ORC6依赖加载路径的必要因素。图h:使用全长ORC1与截短的CDC6和CDT1,进一步验证了ORC1 IDR在ORC6依赖路径中的关键作用。
Geminin对加载的抑制作用(图i)Geminin是一种在细胞周期中抑制MCM加载的蛋白,通过与CDT1结合发挥作用。实验显示,当Geminin浓度等于或超过CDT1时,MCM加载显著被抑制。这表明Geminin通过阻断CDT1功能有效阻止了hDH的形成。
加载后的盐稳定性(图j)加载30分钟后,用不同浓度的氯化钠(NaCl)处理hDH复合物,观察其稳定性。在500 mM NaCl条件下,hDH保持稳定;而在750 mM NaCl以上,hDH逐渐解离。相比之下,酵母MCM双六聚体在高达2 M NaCl中依然稳定,表明人类hDH对高盐浓度的耐受性较低。
实验发现:MCM加载的分子奥秘
加载是一个动态过程
通过核酸酶保护实验,研究人员首次揭示了hDH加载的时间依赖性:在加载的初始阶段(2分钟),MCM与DNA形成广泛接触,保护片段长度达75 bp;随着加载的完成(20分钟后),保护片段缩短至55 bp,与hDH中心通道的理论保护长度一致。
这种动态变化不仅是加载过程完成的标志,更揭示了额外接触区域的逐步解离。
DNA解旋与稳定机制
冷冻电镜结构显示,hDH加载过程中,两六聚体间的5个碱基对发生解旋(underwound),并断裂一个碱基对。断裂的碱基对由MCM5亚基的两个关键氨基酸稳定。R195,通过正电荷吸引孤碱基。L209:通过疏水作用进一步固定。
突变实验表明,这两个氨基酸并非DNA解旋的必要条件,但在稳定解旋后的DNA状态中至关重要。突变体加载的hDH在DNA上更加“滑动”,反映了这些位点在加载后固定DNA的作用。
ORC6参与但非必需:加载路径的灵活性
研究揭示了两条加载路径。非依赖路径,去除ORC6后,MCM依然能够高效加载。这一路径在IDR去除突变的蛋白中更为显著。依赖路径,ORC6通过与ORC1的N端非结构域(IDR)相互作用,促进了加载效率。当ORC1的IDR被删除时,ORC6的加载促进作用完全丧失。
ATP驱动:加载的核心动力
MCM加载的驱动力来自ATP水解。MCM的ATP结合位点以特定模式分布,MCM6–MCM2界面结合ATP,其余亚基结合ADP。当ATP被非水解型模拟物ATPγS替代时,仅能形成初始加载中间体,无法完成加载。
盐浓度影响稳定性
加载后的hDH在500 mM NaCl条件下表现稳定,而750 mM NaCl会导致其逐渐解离。相比之下,酵母的双六聚体在2 M NaCl中依然稳定,显示人类加载机制可能更加灵活但稳定性略逊。
从分子到生命:MCM加载机制的生物学意义
基因组稳定性的守护者 DNA复制起始的精确性直接影响基因组稳定性。MCM加载的多路径机制为人类细胞提供了冗余调控,降低了因单路径故障导致复制失败的风险。
癌症治疗的潜在靶点 异常的MCM加载与多种癌症密切相关。研究揭示的ORC6依赖与非依赖路径为开发新型抗癌药物提供了方向,例如通过靶向调控ORC1 IDR的作用。
DNA复制机制的进化视角 与酵母严格依赖DNA序列的加载不同,人类MCM加载表现出非特异性和路径多样性,这种灵活性或许是复杂基因组对进化压力的适应。
该研究首次为人类MCM加载机制提供了详尽的分子解析,揭示了其动态性、灵活性和调控特性。下一步研究或将尝试重建更完整的人类DNA复制起始复合体,探索加载后的复制叉形成和调控机制。这不仅是基础科学的延续,也将为精准医学和基因编辑技术带来全新契机。
生命的复杂性,往往体现在那些看似细微的分子事件中。通过解开DNA复制的奥秘,我们离理解生命本身又近了一步。
参考文献
Weissmann, F., Greiwe, J.F., Pühringer, T. et al. MCM double hexamer loading visualized with human proteins. Nature (2024). https://doi.org/10.1038/s41586-024-08263-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#DNA复制# #人类细胞# #生物学意义#
18