Nature:孤儿药不孤单
2014-04-11 Y佚名 生物360
正如癌细胞一样,目前淋巴瘤的定义也出现了分化。在美国,约 70 万人患有该病,但在过去的几十 年间,基于发生癌变免疫细胞的类型,淋巴瘤被细分成几十个亚型。药物公司将目标瞄向了这些亚型,并且一直要求将其划入“孤儿病”的范围。根据美国食品和药物管理局(FDA)给出的定义,“孤儿病”在当地是指那些尚无有效疗法且影响人群低于 20 万人的疾病。 2013 年, FDA 不下 21 次授予各种淋巴瘤药
正如癌细胞一样,目前淋巴瘤的定义也出现了分化。在美国,约 70 万人患有该病,但在过去的几十 年间,基于发生癌变免疫细胞的类型,淋巴瘤被细分成几十个亚型。药物公司将目标瞄向了这些亚型,并且一直要求将其划入“孤儿病”的范围。根据美国食品和药物管理局(FDA)给出的定义,“孤儿病”在当地是指那些尚无有效疗法且影响人群低于 20 万人的疾病。
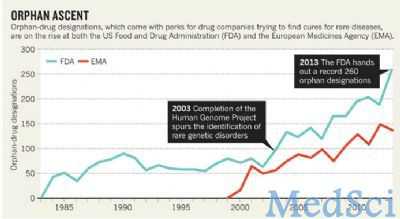
2013 年, FDA 不下 21 次授予各种淋巴瘤药物为指定孤儿药。全部算下来,这个由罕见病药品开发办公室(OOPD)运行的项目在 2013 年指定了 260 种申请药物为孤儿药。这创下了最高纪录,比 2012 年增长了 38%。
然而,随着精准施药趋势的发展,一些人担心该项目有可能沦落为自身非凡成就的牺牲品。通过该项目给予药品开发商的好处如市场独有权,正使得孤儿药价格不断攀升。同时,由于针对常见病的药物申请停滞不前, FDA 的一个主要收入来源正在受到威胁。
目前在马里兰州银泉市拥有一家孤儿药咨询公司的 OOPD 前主任 Timothy Cote 认为,孤儿药正在全面占据 FDA 业务。总的来说,2013 年 FDA 批准的新药里超过 1/3 是孤儿药。
1983 年的孤儿药法案旨在给予药物公司丰厚的奖励,以促使它们生产并不值得投资的药品。在药物开发过程的早期,公司通常会申请孤儿药指定权。如果最终某个孤儿药能获批入市, FDA 会免除公司在新药申请时向其缴纳的 217 万美元用户费。公司还能享受税收减免,以补偿临床试验遭受的损失,同时享有7 年的市场独有权,其间相似药物的申请都会被阻止。
欧洲也有相似的计划:1999 年,欧洲药管局针对当地每 万人中影响人群低于 5 人的疾病创建了一项孤儿药指定方案。该项目还有一些其他的优惠政策,包括授予公司 10 年的市场独有权。因此,在过去的几 年中,指定孤儿药数量出现了稳定增长。
如今,药品公司正纷纷涌向孤儿药市场,部分是因为很多常见病已经有很好的治疗药物,想要寻找实质上更有效的疗法非常困难。例如,目前已有几十种治疗糖尿病的药物,而且很多疗效相当不错。 Cote 认为,打造拳头产品的 年代似乎已经结束。
同时,药品开发商也慢慢发现一些孤儿药的市场规模要比想象的大。例如,总部位于纽约的辉瑞制药公司正在开发治疗镰刀状细胞疾病的孤儿药。尽管这种疾病在美国非常罕见,影响人群不超过10 万人,但镰刀状细胞贫血在非洲很常见。马萨诸塞州辉瑞罕见病研发小组首席运营官 Alvin Shih 表示,公司把这个因素考虑进来,并在断定罕见病将是一项不错的投资后,于2010 年建立该研发小组。
尽管孤儿病非常罕见,但相关药物还是有利可图。例如, 2012 年, FDA 批准了一种名为 Kalydeco 的药物。它可以治疗一种会引发囊胞性纤维症的特定基因突变,而囊胞性纤维症在美国的影响人群约为 3 万人。这种药物只对约 4% 的囊胞性纤维症患者有效,但这些病人每 年要为此支付37.3 万美元。
一些批评人士曾担心药物公司可能会人为地“捏造”疾病。为防止这种做法, FDA 在 2013 年 6 月颁发了一项规定以表明它的立场:药物申请公司必须为某种疾病的独特性提供科学可信的证据。然而,科学发展的日新月异创造了足够的机会提供这种证明。遗传学家已经能够修正非常小的突变,使其变成罕见症状;病毒学家可以追踪流感病毒表面受体的进化过程;生物化学家发现了阿尔茨海默氏症等疾病中的错误折叠蛋白。
马里兰州罗克维尔市国家转化科学推进中心主任 Christopher Austin 介绍说,1999 年人们只知道不到1000种疾病的机制,而如今隐藏在5000多种疾病背后的机制已经为人所知。“常见病正变得稀有,罕见病正变得习以为常。”
FDA 对于孤儿药的定义已经超出了治疗某种特定疾病的药物范围。 OOPD 主任 Gayatri Rao 表示,只要药物能有效治疗一小群常见病患者,例如针对那些之前治疗抑郁症药物不起作用的人群,就可以被指定为孤儿药。甚至被具有某种抗生素抗性的细菌感染,都可能获得指定的孤儿药。
这些以及一种癌症的不同亚型与极其罕见的基因疾病完全不同,后者是建立孤儿药项目的最初动机。例如,引起过早老化的儿童早衰症便是一种孤儿病,全世界不到 250 人受其困扰。“当时,人们根本无法预知肿瘤学会发展成现在这样。”总部位于伦敦、由英国各制药公司组成的生物产业协会会长 Steven Bates 表示。
Cote 认为,我们完全可以预见孤儿药或许有一天会占据 FDA 批准药物的大部分,而且这最终会使该机构的一个主要收入流大大缩减。217 万美元的用户费已大幅上升,10 年前这一数字仅为 57.35 万美元,而 FDA 要依赖这笔费用帮助自身运营。
同时, Bates 表示,一些孤儿药过高的费用正引发欧盟保险公司和国家保健体系的担忧。例如,英国国家健康与临床卓越研究所正考虑可能的办法,如设定最高价格或让药品公司设置合理的价格,以减低这些昂贵药物带来的费用。
Rao 表示,最终还是需要监管机构重新思考它们的战略。不过,迄今为止, FDA 依旧很乐意看到孤儿药项目如此受欢迎。“这些都是长远的顾虑,我们还没到那个程度。在不远的将来,我们能看见的孤儿药当然是越多越好。”
原始出处:
Sara Reardon. Regulators adopt more orphan drugs. Nature, 1 April 2014; doi:10.1038/508016a
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Nat#
74