Nature子刊:同济大学张鹏等利用多组学手段为NSCLC ICB-化疗反应性的不同细胞和分子成分提供了新见解!
2024-12-13 iNature iNature 发表于陕西省
该研究通过分析19例患者ICB化疗前后232080个细胞的单细胞转录组和肿瘤的空间分解转录组,表征了肿瘤细胞状态和肿瘤微环境(TME)的空间细胞组成。
尽管免疫检查点阻断(ICB)疗法已经改变了非小细胞肺癌(NSCLC)的治疗模式,但许多患者仍然具有耐药性。
2024年12月10日,同济大学张鹏、王晨飞、孙毅、张乐乐、中国科学院分子细胞科学卓越创新中心曾安共同通讯在Nature Genetics在线发表题为“Multi-omic profiling highlights factors associated with resistance to immuno-chemotherapy in non-small-cell lung cancer”的研究论文,该研究通过分析19例患者ICB化疗前后232080个细胞的单细胞转录组和肿瘤的空间分解转录组,表征了肿瘤细胞状态和肿瘤微环境(TME)的空间细胞组成。
研究发现肿瘤细胞和分泌的磷酸蛋白1阳性巨噬细胞与XI α1型胶原链阳性的癌相关成纤维细胞相互作用,刺激胶原纤维在肿瘤边界的沉积和缠结,阻碍T细胞浸润,导致预后不良。还揭示了TME中三级淋巴结构(TLSs)的不同状态。激活的TLS与预后改善有关,而过度激活的TLS似乎会抑制TLS的发展,并与预后不良有关。该研究对NSCLC ICB-化疗反应性的不同细胞和分子成分提供了新的见解,这些细胞和分子成分与NSCLC ICB-化疗反应性的治疗方法和治疗效果有关,这将有利于未来的个体化免疫化疗。

免疫检查点阻断(ICB)治疗已经彻底改变了非小细胞肺癌(NSCLC)的治疗,甚至治愈了一些晚期患者。新辅助免疫化疗比单独使用ICB更有效,平均有效率为32%(18-63%)。许多非小细胞肺癌患者对新辅助免疫化疗仍有耐药性,这种耐药性背后的分子机制尚不清楚。
肿瘤微环境(TME)包括多种促进肿瘤生长和免疫逃逸的免疫细胞和基质细胞。鉴于TME中细胞类型的多样性,开创性的研究已经使用单细胞RNA测序(scRNA-seq)来识别与免疫治疗耐药性相关的特征。最近一项对新辅助程序性细胞死亡蛋白1(PD-1)阻断后非小细胞肺癌的研究发现,组织驻留T细胞在肺癌TMEs中大量存在,但功能降低。另一项研究发现,在非小细胞肺癌中,PD-1阻断后,功能失调的CD8+ T细胞亚群经历了克隆复苏。这些研究共同表明,尽管新辅助ICB治疗可以部分重新编程TME并增加CD8+ T细胞浸润,但环境仍然具有一定的抑制作用,限制了长期疗效。
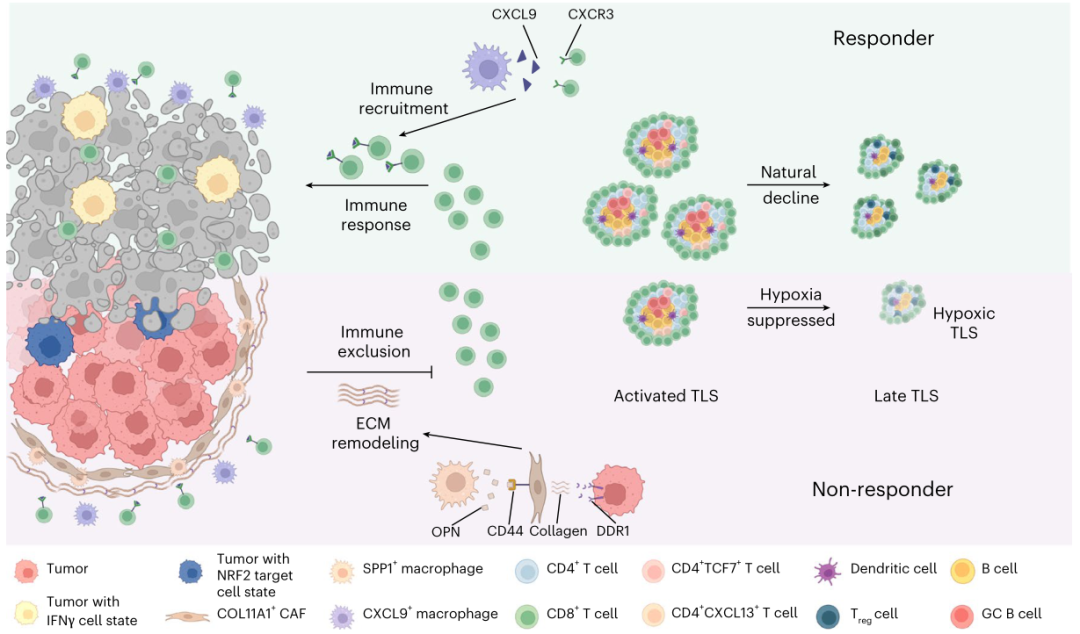
机理模式图(图源自Nature Genetics)
尽管scRNA-seq揭示了不同癌症中TME异质性的重要见解,但其局限性在于空间和形态信息的缺失,这使得研究细胞共定位和构建TME的空间结构具有挑战性。例如,三级淋巴样结构(TLSs)对于T细胞启动、B细胞激活以及T细胞和B细胞分化至关重要。在大多数实体肿瘤中,TLSs与预后呈正相关,可以预测对ICB治疗的反应。然而,由于缺乏B细胞和T细胞的空间组织信息,大多数scRNA-seq研究尚未阐明TLSs的几何结构及其在TME中形成、成熟和功能的机制。
在这项研究中,研究人员整合了scRNA-seq和空间转录组学来分析有反应和无反应的新辅助ICB化疗前后肿瘤细胞的细胞组成和空间组织以及微环境。还确定了与ICB化疗不良反应相关的癌细胞状态和基质细胞和免疫细胞类型的重要空间组成。通过计算分析,研究了TLSs在NSCLC中的成熟过程和潜在功能。该研究为复杂的NSCLC生态系统提供了新的见解,并为未来的联合治疗确定了潜在的生物标志物。
参考消息:
https://www.nature.com/articles/s41588-024-01998-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#非小细胞肺癌# #免疫检查点阻断#
10