Adv Sci:周钢桥/贺福初合作揭示了TBC1D31的基因组扩增促进肝细胞癌的作用机制
2024-09-04 iNature iNature 发表于上海
该研究通过基于转录组数据的综合计算框架对814名HCC患者的预后相关局灶性CNA进行全基因组调查,发现8q24.13处的基因组扩增是一个有希望的候选基因。
肝细胞癌(HCC)的特点是存在大量体细胞拷贝数变异(CNA);然而,它们的功能相关性在很大程度上是未知的。
2024年8月29日,国家蛋白质科学中心周钢桥/清华大学贺福初共同通讯在Advanced Science 在线发表题为“Genomic Amplification of TBC1D31 Promotes Hepatocellular Carcinoma Through Reducing the Rab22A-Mediated Endolysosomal Trafficking and Degradation of EGFR”的研究论文。该研究通过基于转录组数据的综合计算框架对814名HCC患者的预后相关局灶性CNA进行全基因组调查,发现8q24.13处的基因组扩增是一个有希望的候选基因。
进一步的证据表明,8q24.13扩增驱动的Rab GTPase活化蛋白TBC1D31过表达通过激活表皮生长因子受体(EGFR)信号传导加剧了体外和体内的HCC生长和转移。从机制上讲,TBC1D31充当Rab GTPase活化蛋白,催化Rab22A的GTP水解,然后减少Rab22A介导的溶酶体内运输和EGFR降解。值得注意的是,TBC1D31的过表达显著增加了肝癌细胞对仑伐替尼的耐药性,而抑制TBC1D31-EGFR轴可以逆转这种耐药表型。这项研究强调了8q24.13上的TBC1D31是一个新的关键致癌基因,揭示了肝癌中EGFR激活的新机制,并提出了治疗TBC1D31扩增或过表达的肝癌患者的潜在策略。

肝细胞癌(HCC)占肝癌的90%以上,是全球第三大癌症相关死亡原因。尤其是在中国,HCC新诊断病例和死亡病例占所有病例的50%以上。尽管对HCC新的预防和治疗策略进行了深入和广泛的研究,但HCC患者的5年生存率仍然有限。因此,迫切需要进一步探索治疗HCC的新功能靶点。
由于基因组异质性高,最近的大规模DNA测序研究在HCC的许多基因中检测到了多样但频率较低的致癌突变。或者,广泛的基因组分析揭示了HCC基因组中的许多拷贝数变异(CNA),例如11q13.3(FGF19)、7q31.2(MET)和6p21.1(VEGFA)扩增,从而在识别癌症驱动因素方面取得了重大进展。然而,大多数CNA,特别是那些跨越包含多个候选基因的大型基因组区域的CNA,没有疾病发病机制的功能线索和/或基本上没有被探索过。此外,许多研究局限于有限的样本量,无法说明可重复的HCC相关CNA的情况,因此将它们转化为医学实践带来了挑战。
CNA可以通过顺式调控效应以剂量依赖性方式影响同一基因位点的基因表达。因此,已经开发出几种计算方法来通过使用转录数据推断CNA来研究癌症中的基因组CNA,例如ACE(通过表达数据分析CNA)和WACE(基于小波的算法,基于表达分析CNA)。这些算法考虑了CNA对基因表达模式的后续影响,因此能够识别出主要由CNA驱动的关键候选基因,尤其是对于那些大型CNA。值得注意的是,先前的广泛研究已经生成了大量的HCC转录数据,因此提供了在大量此类恶性肿瘤样本中探索有前景的CNA的机会。
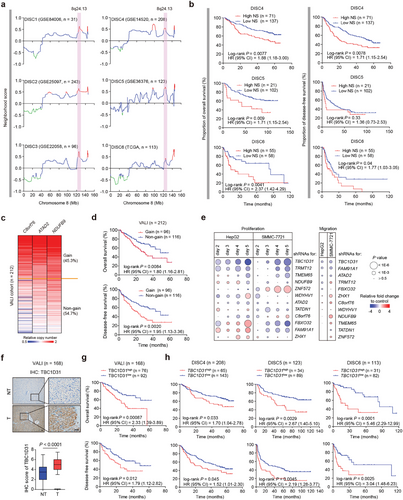
染色体8q24.13的基因组扩增预测HCC患者的不良临床结局(图源自Advanced Science )
表皮生长因子受体(EGFR)是受体酪氨酸激酶(RTKs)家族的成员,在癌症的恶性转化和转移中起着至关重要的作用。大量基因组研究表明,EGFR在各种类型的癌症中反复受到基因组改变的破坏。对于HCC,不到5%的患者在EGFR中发生致癌突变或扩增。然而,EGFR蛋白在60%以上的人类HCC中普遍过表达,并且与患者的侵袭性显着相关。这种惊人的不一致表明,可能存在其他机制来解释HCC中EGFR蛋白的过表达。新兴证据表明,一组Rab GTPases的EGFR内吞运输缺陷已被公认为调节EGFR表达和活性的新机制。然而,肝癌细胞中EGFR运输机制的多个方面仍远未阐明。
在这里,作者分析了由814名肝癌患者组成的大量转录组数据集。通过使用ACE方法,作者总共确定了15个显著的体细胞肝癌相关CNA。其中,染色体8q24.13扩增与患者不良临床结果显着相关。通过高内涵功能筛选和随后的一系列功能分析,8q24.13扩增中的TBC1D31被证明是一种在肝癌发展中发挥作用的新致癌基因。从机制上看,TBC1D31通过水解Rab22A来延缓EGFR降解,而Rab22A已被证明可作为EGFR从早期内体运输到晚期内体/溶酶体进行降解的启动子,从而增强肝癌细胞中的EGFR信号传导。此外,作者发现下调TBC1D31或抑制EGFR可使肝癌细胞对仑伐替尼敏感,从而为肝癌提供潜在的治疗策略。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405459
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肝细胞癌# #TBC1D31#
77