肺癌放化疗患者确诊t-AML伴t(8;21)(q22;q22)1例
2023-01-26 徐丹菲等 中国医学科学院肿瘤医院 “检验医学”公众号 发表于陕西省
本例患者为小细胞肺癌患者放化疗后三系减低,触发本室血常规复检规则,镜检发现外周血存在原幼细胞,最终确诊为治疗相关急性髓系白血病t-AML伴t(8;21)(q22;q22)。
前 言
血常规检查是反应各种疾病的窗口,更是血液病筛查的重要手段。在肿瘤患者中,尤其是肿瘤放化疗患者群体,相关治疗手段往往会影响患者红细胞、白细胞和血小板三系细胞的正常发育生成,继而出现贫血、感染和PLT减低等。因此,在该类群体中,当血常规显示有血细胞减少时,往往容易误认为是放化疗后骨髓抑制,忽视其发生恶性血液病的可能,从而错过最佳治疗时间。本例患者为小细胞肺癌患者放化疗后三系减低,触发本室血常规复检规则,镜检发现外周血存在原幼细胞,最终确诊为治疗相关急性髓系白血病t-AML伴t(8;21)(q22;q22)。
案例经过
患者69岁男性,确诊小细胞肺癌4年,行依托泊苷+顺铂方案治疗6周期后,胸部放疗后。口服依托泊苷治疗至今,于我院门诊规律复查。2022年6月23日,因复查就诊于我院胸内科门诊。
当天影像学检查(颈胸腹CT增强扫描)、肺癌相关肿瘤标志物(NSE 14.8ng/mL,CEA 3.52 ng/mL)、肝肾功能、凝血功能等结果较前次(2022.1)无明显变化。血常规结果提示全血减少:WBC 1.28×109/L↓,HGB 88g/L↓,PLT 58×109/L↓,血涂片镜检发现原始及异常幼稚粒细胞。经完善骨髓检查,患者最终确诊为治疗相关性急性髓系白血病伴t(8;21)(q22;q22)。
检验案例分析
患者全血细胞减少,血细胞分析仪报警信息虽仅提示中性粒细胞减少、淋巴细胞减少、白细胞减少、贫血、血小板减少;但散点图(图1)可见淋巴细胞群与单核细胞群有重叠,且单核细胞群荧光强度异常增高。触发本室血常规复检规则,结合仪器散点图分析需复测并推血涂片镜检。
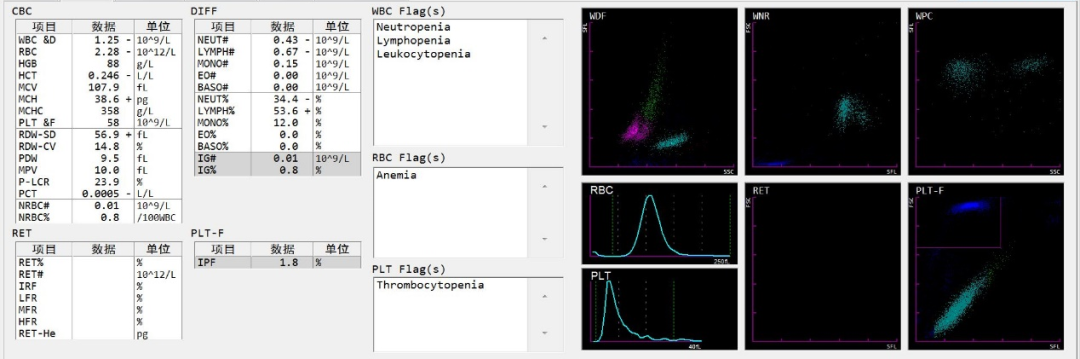
图1 血常规仪器报警信息及散点图
血涂片经瑞氏吉姆萨染色后镜检(图2),镜下有核细胞少,分类原始细胞约占5%,胞体大小不等;胞核圆形、椭圆形或不规则,染色质细颗粒状均匀分布,可见核仁;胞浆量较少,灰蓝色,内涵少许细小颗粒,个别可见1~2根Auer’s小体。
另可见一群异常幼稚粒细胞,约占20%,该群细胞胞体大小及形态不一;胞核多不规则,呈折叠、扭曲、分叶、裤腿样、蝴蝶样等,染色质较细致,个别可见核仁;胞质中等,含有丰富的紫红色颗粒,个别可见Auer’s小体。成熟红细胞大小不等,形态不规则。血小板减少。
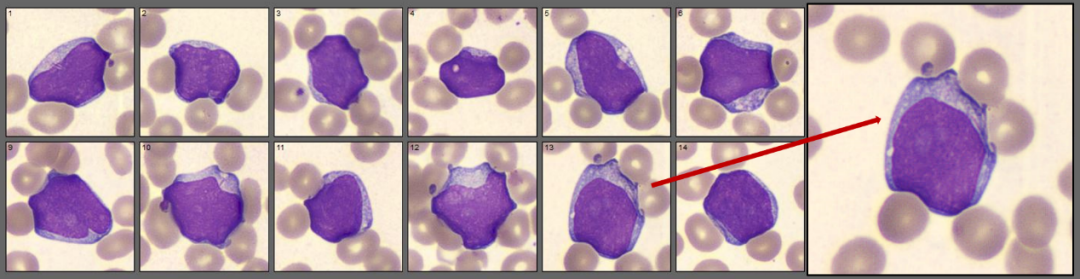
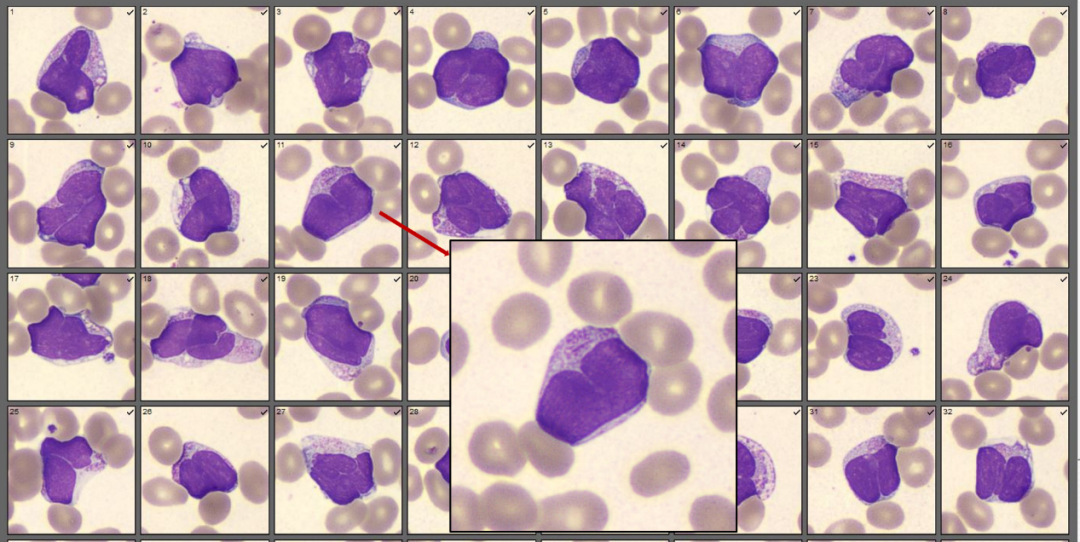
图2 患者血涂片中的异常细胞
(上:原始细胞;下:异常幼稚粒细胞)
结合患者历史结果,半年前血常规(本院2022.1)三系均正常,此次三系减低,且发现原始细胞及异常幼稚粒细胞,应警惕血液系统肿瘤。电话与门诊大夫沟通后获悉该患者近期未进行粒细胞集落刺激因子等相关治疗。
追问患者病史,自述三个月前脑出血于外院手术治疗,彼时血常规结果不详。考虑患者AML-M3不除外,遂建议患者尽快血液科进一步检查。外院急诊血液内科以“疑诊急性髓系白血病”收入后完善骨髓穿刺检查。以下分别为形态学(Morphology)、免疫学(Immunology)、细胞遗传学(Cytogenetics)、分子学检查(Molecular)结果:
骨髓细胞形态学检查:取材,涂片,染色良好。
1.骨髓增生Ⅳ级,粒系占54.50%,红系占39.50%,粒:红=1.38:1。
2.粒系:原始细胞占36%,此类细胞胞体规则,核规则、核染色质细、核仁可见、浆兰,量少,可见Auer's小体及圆形包涵体。计数100个有核细胞可见核浆发育不平衡、巨幼样改变、Pelger细胞、颗粒减少等病态造血<10%(约6%)。
3.红系:早红以下阶段可见,可见核出芽。成熟红细胞形态大小不等。
4.阅全片可见巨核细胞6个,血小板少。
5.阅片未见感染性微生物及寄生虫(包含利杜小体)。
6.偶见噬血现象。
7.化学染色:POX阳性率100%(图3),+8,++42/50个;NSE-50/50;NaF-50/50。诊断:AML-M2?请结合临床及免疫分型。
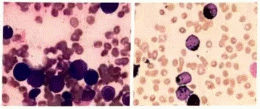
图3 患者骨髓涂片过氧化物酶染色
免疫分型:可见异常髓系表型(图4),幼稚细胞占24.77%,表达CD117, CD34, CD33, CD38, CD19, CD13, CD123, HLA-DR, CD45, CD11c, CD9, CD71, CD15, MPO, 部分细胞表达cCD79a,不表达CD10, CD5, CD56, CD7, CD4, CD16, CD11b, CD65, CD66c, CD36, CD64, CD14, CD300e, CD22, CD105, CD30, CD11c, CXCR4, CD25, CD203c, cCD22,为异常幼稚髓细胞。嗜碱细胞占2.97%,比例增加。异常表达CD25。不除外急性髓系白血病(AML-M2可能性大),请结合临床。
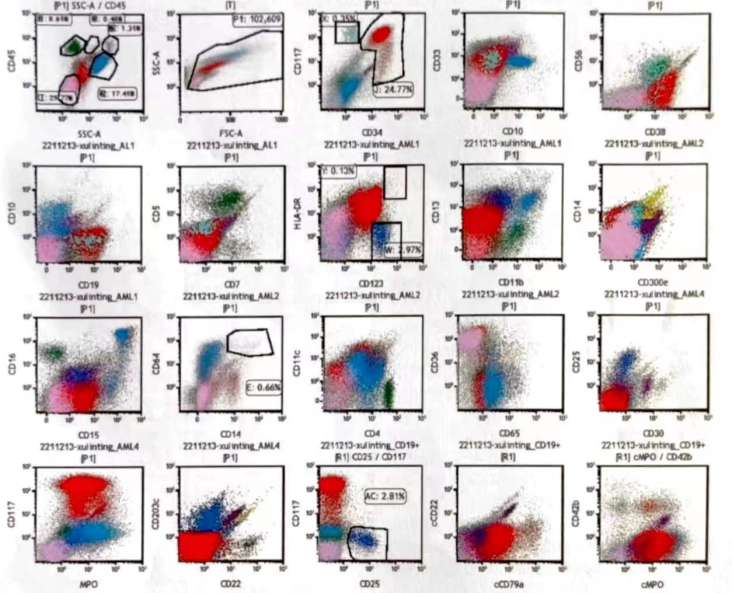
图4 免疫分型散点图
染色体分析:46,XY; der(8)t(8;21)(q22;q22),der(21)t(8;21)(q22;q22),del(8)(q22.3;q23.3) [10]/45,idem,-Y[5]/46,XY[5]:共分析20个中期分裂相,其中10个核型具有由8 q 22与21 q 22断裂重接发生相互易位形成衍生8号染色体、由8 q 22与21 q 22断裂重接发生相互易位同时8号染色体q22.3至q23.3之间的片段缺失形成衍生21号染色体的异常: 5个核型除上述异常外同时具有Y染色体丢失的异常:其余5个为正常男性核型。请结合临床。建议必要时送检AML/ETO探针FISH检测。
基因检测:AML相关融合基因中检测到AML1-ETO,400.7%;WT1异常高表达;C-KIT、TP53、NPM1未见突变。建议随访AML1-ETO mRNA水平监测微小残留病。
最终诊断:根据WHO白血病MICM分型标准,该患者最终确诊为治疗相关性急性髓系白血病伴t(8;21)(q22;q22),即t-AML伴t(8;21)(q22;q22)。
肿瘤患者放化疗后常见血细胞三系减低,通常情况下检验人员对患者的治疗情况及病史知之不详,在进行报告审核时容易出现思维定式,对患者可能罹患血液系统恶性疾病的警惕性不够,且血细胞的减少对于镜检发现异常细胞也提升了难度,从而存在一定的漏检可能。
近期我们在临床工作中发现多例血常规筛查出肿瘤患者治疗过程中伴发血液系统恶性疾病的病例,提示我们在血常规报告审核时对此类结果需给予足够的重视。
首先,应关注仪器报警信息及散点图,查看是否提示有“原始细胞”或“异常细胞”,该例虽未提示“原始细胞”或“异常细胞”,但散点图可见淋巴细胞群与单核细胞群有重叠,且单核细胞群荧光强度异常增高,提示有原始细胞存在可能。
其次,在进行血涂片复检时需采用正确的显微镜镜检方法,尤其是在血细胞减少时要注重低倍镜的运用以浏览全片及查找可疑细胞,从而提高镜检的效率以及降低镜检的漏检率。
根据WHO最新的分类及诊断标准[1],AML伴t(8;21)(q22;q22)是一种常见的伴有重现性遗传学异常的急性髓系白血病,具有较特异的形态学特征,包括丰富嗜碱性胞质的大原始细胞,常含有大量嗜天青颗粒和核周淡染或核凹陷,常见Auer’s小体。
除有大原始细胞外,还可见较小原始细胞(主要见于外周血),并可见不同程度发育异常的早幼粒、中幼粒及成熟中性粒细胞。这些细胞可有核分叶异常和/或核浆发育不平衡。本例外周血中异常早幼粒细胞占比较高,需与另一类型更为“危急”的白血病即急性早幼粒细胞白血病M3相鉴别。
临床案例分析
思考1:患者确诊小细胞肺癌4年,行依托泊苷+顺铂方案治疗6周期后,胸部放疗后。口服依托泊苷治疗至今。血常规提示贫血、粒缺、血小板减少,临床惯性思维首先考虑放化疗后骨髓抑制或肿瘤复发。此时血细胞形态学检查提供的信息尤为重要。该患者近期未使用粒细胞集落刺激因子,因此检验科在血常规中发现异常,突破惯性思维,人工镜检寻找线索,最终发现原始细胞,对该例患者血液系统恶性肿瘤的发现具有重要意义。
思考2:SCLC最常用的初治方案是依托泊苷+顺铂,而同步放化疗是SCLC的标准治疗[2]。本例患者经胸部CT与肺部穿刺活检病理结果诊断为SCLC。同步放化疗结束后4年出现三系减低,行骨髓检查考虑为急性髓系白血病。根据患者治疗经过,可以诊断为t-AML。
t-AML患者在暴露于拓扑异构酶Ⅱ抑制剂(依托泊苷属该类药物)1~3年后出现,或在使用烷化剂(顺铂属该类药物)治疗约5年后出现,且常伴有染色体易位[3]。本例患者在形态学、免疫分型、细胞遗传学和分子学上与前述的所具有重现性细胞遗传学异常的AML伴t(8;21)(q22;q22)相同。这类患者应该诊断为t-AML并注明相应的细胞遗传学异常,本例则为t-AML伴t(8;21)(q22;q22)。
思考3:AML1-ETO基因是由8号和21号染色体易位导致位于21q22上的AML1基因(又名RUNX1基因)与8q22上的ETO基因(又名RUNX1T1基因)融合而成,表达产物为AML1-ETO融合蛋白[4]。t(8;21)(q22;q22)约见于10%的AML病例,在过去的FAB分型中的AML伴成熟迹象型M2b中占90%。
如存在该染色体易位,即使骨髓中原始细胞数< 20%也应诊断为AML。AML伴t(8;21)(q22;q22)通常对化疗反应好,完全缓解率高,巩固治疗期使用大剂量阿糖胞苷者无病生存期长,而治疗相关白血病t-AML通常预后较差。对于本文所述病例,其预后偏向于t-AML还是首发AML伴t(8;21)(q22;q22)值得关注。
知识拓展
依托泊苷为拓扑异构酶Ⅱ抑制剂,对肿瘤细胞有明显的细胞毒性作用,其作用机制主要是形成三联体阻断拓扑异构酶Ⅱ的连接活性,引起DNA链损伤,使细胞分裂停止在S晚期或G2早期,或抑制拓扑异构酶Ⅱ的催化作用而抑制DNA双链断裂后重新连接,从而引起细胞凋亡。
顺铂(DDP)为铂的金属络合物,作用机制为与DNA形成DDP-DNA复合物,干扰DNA的复制,或与核蛋白及胞浆蛋白结合,属于非特异性周期药物。有研究显示,拓扑异构酶Ⅱ抑制剂与铂类联合治疗时可引发t-AML。其次,本例患者同时也接受了放疗,推测放疗也是引发t-AML的可能原因,机制可能是放疗引起造血干细胞DNA碱基脱落、转换、颠换产生移码突变或点突变,DNA链断裂,产生基因突变和染色体畸变,使白血病发生率增加。
案例总结
综上所述,在临床工作中,骨髓抑制是抗癌治疗中常见的不良事件,及早区别骨髓抑制与t-AML具有重要意义。因此,当抗癌治疗过程中或治疗结束后遇到血细胞减少时,应仔细检查外周血涂片。当在血涂片中发现原始细胞时,检验人员需详细了解其临床相关治疗情况,如放化疗的时间间隔以及是否使用细胞集落刺激因子等对检验所见进行综合判断;仔细观察原始细胞的形态是否有恶性肿瘤的特征,如“杯口”样核、Auer小体等[5];并及时与临床沟通相关检查情况,必要时临床可进一步行骨髓检查,尤其是对于曾接受过拓扑异构酶抑制剂治疗的患者,以排除t-AML。
专家点评
(中国医学科学院肿瘤医院检验科 崔巍)
点评1:本文通过一例具有与首发AML伴t(8;21)相同形态、免疫表现及融合基因的治疗相关性AML,从血常规三系减低为突破口,层层深入。外周血细胞形态为此病例及时发现与诊断的关键点,因此准确掌握血常规报告审核要点以及各类血液病的形态学特点,在非血液病专科医院也具有不可低估的作用。本文案例从血常规疑诊M2或M3,到骨髓MICM检查初步归为AML伴t(8;21)(q22;q22),最后结合患者过去治疗情况最终确诊为t-AML伴t(8;21)(q22;q22),可谓一波三折。总之,血常规结果异常时,血涂片形态学镜检能为临床诊治提供重要依据。
点评2:关于t-AML-t(8;21)仍有许多问题有待进一步研究,例如其相比于首发AML伴t(8;21)(q22;q22),在形态、预后等方面的区别,相关报告较少。仅Gustafson[6]等人研究了13例t-AML-t(8;21)和38例首发AML-t(8;21)的临床病理学特征。与首发AML-t(8;21)患者相比,t-AML-t(8;21)患者年龄较大,WBC计数较低,形态发育不良更为严重,CD19/CD56表达相当。中位随访13个月,10例t-AML-t(8;21)患者死亡;总生存期显着低于首发AML-t(8;21)患者(19个月未观察到终点)。这些发现表明,虽然t-AML-t(8;21)与首发AML-t(8;21)(q22;q22)有许多共同特征,但t-AML-t(8;21)患者的预后较差。此例患者的结局将如何可继续随访。
参考文献
[1] Arber, D.A., et al., The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. (1528-0020 (Electronic)).
[2] Kalemkerian, G.P., et al.,NCCN Guidelines Insights: Small Cell Lung Cancer, Version 2.2018.J Natl Compr Canc Netw, 2018. 16(10): p. 1171-1182.
[3] Strickland, S.A. and N. Vey, Diagnosis and treatment of therapy-related acute myeloid leukemia. Crit Rev Oncol Hematol, 2022. 171: p. 103607.
[4] Hatlen, M.A., L. Wang, and S.D. Nimer, AML1-ETO driven acute leukemia: insights into pathogenesis and potential therapeutic approaches. Front Med, 2012. 6(3): p. 248-62.
[5] 中华医学会检验医学分会血液学与体液学学组,血细胞分析报告规范化指南.中华检验医学杂志, 2020. 43(6): p. 619-627.
[6] Gustafson, S.A., et al.,Therapy-related acute myeloid leukemia with t(8;21) (q22;q22) shares many features with de novo acute myeloid leukemia with t(8;21)(q22;q22) but does not have a favorable outcome.(1943-7722 (Electronic)).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言