Bimekizumab 治疗活动性银屑病关节炎患者的疗效与安全性 (BE COMPLETE研究)
2023-08-05 网络 网络 发表于上海
对TNFα抑制剂反应不足或不耐受的活动性银屑病关节炎患者,Bimekizumab治疗相比安慰剂在第16周的关节和皮肤疗效结果上显示出优越性。
对肿瘤坏死因子-α (TNFα) 抑制剂的反应不足或不耐受的银屑病关节炎患者当切换到后续的TNFα抑制剂或其他治疗药物时,治疗反应通常较低,因此需要新的疗法。Bimekizumab是一种人源化的抗体,通过选择性抑制IL-17A和IL-17F,可有效抑制类风湿性关节炎患者的炎症反应。针对那些对TNFα抑制剂反应不足或不耐受的患者,bimekizumab可能是一种有效且耐受性良好的治疗选择。因此一项大型临床研究比较了Bimekizumab与安慰剂在16周内对活动性银屑病关节炎患者的疗效和安全性,这些患者此前对肿瘤坏死因子-α(TNFα)抑制剂治疗反应不足或不耐受。

BE COMPLETE是一项3期、多中心、随机、双盲、安慰剂对照试验,在11个国家的92个研究点(包括医院、诊所和研究中心)进行。符合条件的患者年龄在18岁或以上,患成人发病型银屑病关节炎(在筛选前至少6个月符合银屑病关节炎分类标准),并曾对一种或两种TNFα抑制剂治疗(用于银屑病关节炎或银屑病)反应不足或不耐受。以2:1的比例随机分配接受皮下注射bimekizumab 160 mg每4周一次或安慰剂。主要终点是在第16周时,根据美国风湿病学会标准(ACR50),达到50%或更大改善的患者比例((无反应者插补)。疗效分析针对随机分组的人群进行,安全性分析集包括接受一剂或多剂研究治疗的患者。
从2019年3月28日-2022年2月14日,筛选了556例患者,并随机分配了400例患者接受每4周一次的bimekizumab 160 mg(n=267)或安慰剂(n=133)。主要和所有分级次要终点在第16周达到。267例接受bimekizumab治疗的患者中,116例(43%)达到ACR50,而133例接受安慰剂治疗的患者中只有9例(7%)达到ACR50(校正后的比值比[OR]为11.1 [95% CI 5.4-23.0],p<0.0001)。在基线时患有面积≥3%的银屑病患者中,176例接受bimekizumab治疗的患者中有121例(69%)达到银屑病区域和严重程度指数(PASI90)≥90%的改善,而88例接受安慰剂治疗的患者中只有6例(7%)达到PASI90(校正后的OR为30.2 [12.4-73.9],p<0.0001)。到第16周,267例接受bimekizumab治疗的患者中有108例(40%)报告了治疗相关的不良事件,132例接受安慰剂治疗的患者中有44例(33%)报告了治疗相关的不良事件,没有发现新的安全方面的问题,没有发生死亡事件。
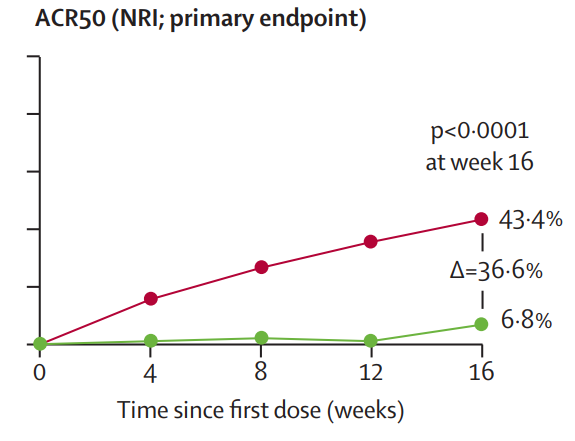
第 0 周至第 16 周的 ACR 应答患者比例
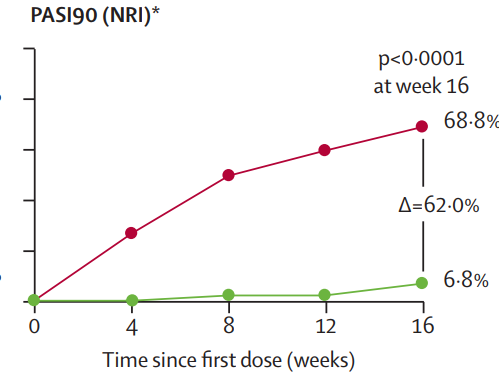
第 0 周至第 16 周的 PASI90 应答患者比例
对TNFα抑制剂反应不足或不耐受的活动性银屑病关节炎患者,Bimekizumab治疗相比安慰剂在第16周的关节和皮肤疗效结果上显示出优越性。Bimekizumab的安全性与先前在银屑病患者和IL-17A抑制剂研究中进行的3期临床研究一致。
参考文献:
Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor-α inhibitors: a randomised, double-blind, placebo-controlled, phase 3 trial (BE COMPLETE). Lancet. 2023 Jan 7;401(10370):38-48. doi: 10.1016/S0140-6736(22)02303-0. Epub 2022 Dec 6. PMID: 36495881.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












Bimekizumab是一种人源化的抗体
118