Nature子刊:厦门大学王洪睿/付国/复旦大学赵同金发现三阴性乳腺癌的潜在治疗靶点
2023-04-27 iNature iNature 发表于四川省
该研究报道了EGFR单体可能在缺乏跨膜蛋白TMEM25的情况下激活信号转导子转录激活因子-3 (STAT3),而TMEM25在TNBC中经常降低。
三阴性乳腺癌(TNBC)是乳腺癌的一种亚型,预后不良,缺乏批准的靶向治疗。表皮生长因子受体(EGFR)的过表达见于50%以上的TNBC中,并被认为是TNBC进展的驱动力;然而,使用抗体靶向EGFR以防止其二聚化和活化对TNBC患者没有显著益处。 2023年4月24日,厦门大学王洪睿、付国及复旦大学赵同金共同通讯在Nature Communications 发表题为“TMEM25 inhibits monomeric EGFR-mediated STAT3 activation in basal state to suppress triple-negative breast cancer progression”的研究论文,该研究报道了EGFR单体可能在缺乏跨膜蛋白TMEM25的情况下激活信号转导子转录激活因子-3 (STAT3),而TMEM25在TNBC中经常降低。 TMEM25的缺乏允许EGFR单体独立于配体结合对STAT3进行磷酸化,从而增强基础STAT3活化以促进雌性小鼠的TNBC进展。此外,通过腺相关病毒提供TMEM25可强烈抑制STAT3活化和TNBC进展。因此,该研究揭示了EGFR/STAT3信号通路在TNBC进展中的作用,并指出了TNBC的潜在靶向治疗。

表皮生长因子受体(EGFR)是ErbB/HER家族受体酪氨酸激酶(RTKs)的原型,其通过不同的信号通路控制各种发育过程,包括磷脂酰肌醇3激酶(PI3K)/Akt,Ras/Raf/MEK / ERK和STAT3途径。EGFR保持单体,并且在没有配体的情况下其激酶结构域被自身抑制。针对EGF等配体的结合,EGFR及其家族成员ErbB2 / HER2,ErbB3 / HER3和ErbB4 / HER4可以形成同源或异二聚体,导致变构构象改变以激活激酶结构域,同时,激酶结构域也可以通过增加局部浓度诱导的EGFR2二聚化来激活。
长期以来,由于点突变、基因内缺失或过度表达引起的EGFR信号传导的过度激活与多种人类癌症的发展密切相关。其中,EGFR在超过50%的三阴性乳腺癌(TNBC)中过表达,其特征是雌激素受体、孕酮受体和HER2表达缺乏,与临床结局差有关,治疗方法有限。普遍认为,二聚化是激活EGFR的重要步骤。有趣的是,使用EGFR单克隆抗体西妥昔单抗阻断EGFR二聚化的临床阶段试验在TNBC患者中未显示出统计学上的显著疗效。
信号转导和转录激活因子(STAT)家族蛋白是响应各种细胞因子和生长因子信号通路调节多种基因转录的转录因子。在STAT家族成员中,STAT3和STAT5以其在促进癌症进展中的作用而闻名,尤其是STAT3,目前被认为是癌症治疗的一个有希望的靶点。STATs 的活化通常是通过C末端结构域中单个保守酪氨酸残基的磷酸化,这诱导STATs的二聚化和随后的核转位。STATs可以通过各种信号通路激活。
典型地,没有内在激酶活性的受体将Janus激酶(JAK)和STATs募集到受体的细胞质结构域,其中JAK被激活以磷酸化STATs。此外,EGFR和血小板衍生生长因子受体(PDGFR)等RTK也可以通过直接磷酸化STAs或通过募集非受体酪氨酸激酶(如SRC)间接介导STATs的激活。STAT3通常在所有类型的乳腺肿瘤中持续激活,但最常见于TNBC。
尽管EGFR的过表达和STAT3的过度激活与TNBC患者的预后不良有关,鲜为人知这两个事件是否以及如何关联。迄今为止,已经做出了许多努力来靶向癌症治疗的STAT3通路。然而,尽管数十种靶向STAT3或其上游途径的抑制剂已经在临床试验中进行了测试,但只有少数被美国食品和药物管理局(FDA)批准用于治疗包括胰腺癌和胃/胃食管交界处癌在内的癌症,但尚未批准TNBC。主要障碍之一是STAT3普遍表达引起的毒副作用。因此,找到一种特异性靶向癌细胞中STAT3激活的方法可能是一个有吸引力的策略。
跨膜(TMEM)蛋白家族是一组描述较少的蛋白质,其中包含一个或多个跨膜结构域。TMEM25是一种单一的跨膜蛋白,之前曾被报道为乳腺癌患者的良好预后和预测标志物;然而,分子机制尚不清楚。此外,发现TMEM25在结直肠癌中的表达降低。最近的研究表明,TMEM25通过影响NMDA受体NR2B亚基降解来调节神经元兴奋性。
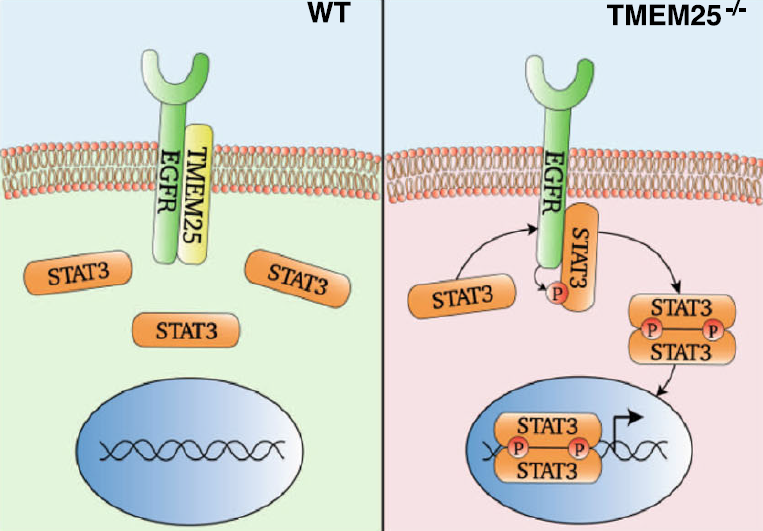
文章模式图(图源自Nature Communications )
该研究将TMEM25鉴定为EGFR结合蛋白,以防止单体EGFR介导的STAT3在基础状态下磷酸化,因此可作为肿瘤抑制因子抑制TNBC进展。该研究还证明了TMEM25在TNBC靶向治疗中的潜力,并表明在其他类型的癌症中鉴定出的TMEM25的临床突变可能能够触发单体EGFR / STAT3信号传导以促进肿瘤进展。此外,通过开发短肽或小分子化合物来阻断EGFR和STAT3之间的相互作用,有可能实现阻断EGFR介导的STAT3单体超活化的替代策略,这可能为TNBC药物开发提供先导化合物。
参考消息:
https://doi.org/10.1038/s41467-023-38115-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











学习了
67