FDA批准也是**一个多发性硬化症患者自行注射的B细胞疗法Kesimpta(ofatumumab),只需每月注射一次
2020-08-21 MedSci原创 MedSci原创
Kesimpta是全人源抗CD20单抗,与特立氟胺相比,显示出优异的疗效和相似的安全性。
诺华公司宣布,美国食品和药物管理局(FDA)已批准Kesimpta(奥法木单抗,ofatumumab)作为一种皮下制剂用于治疗复发型多发性硬化症(RMS),包括临床孤立综合征,复发缓解型和活动性继发进展型。
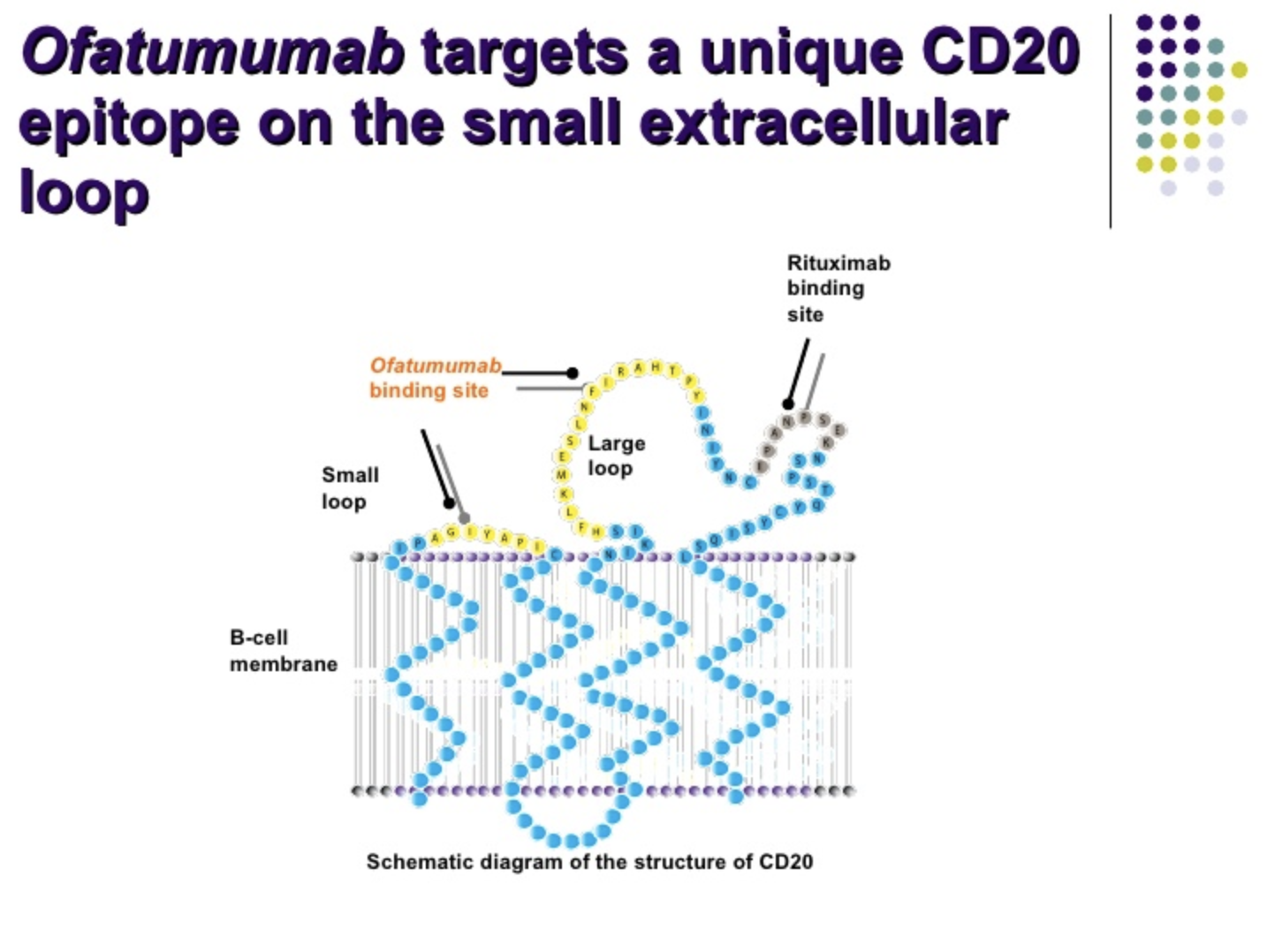
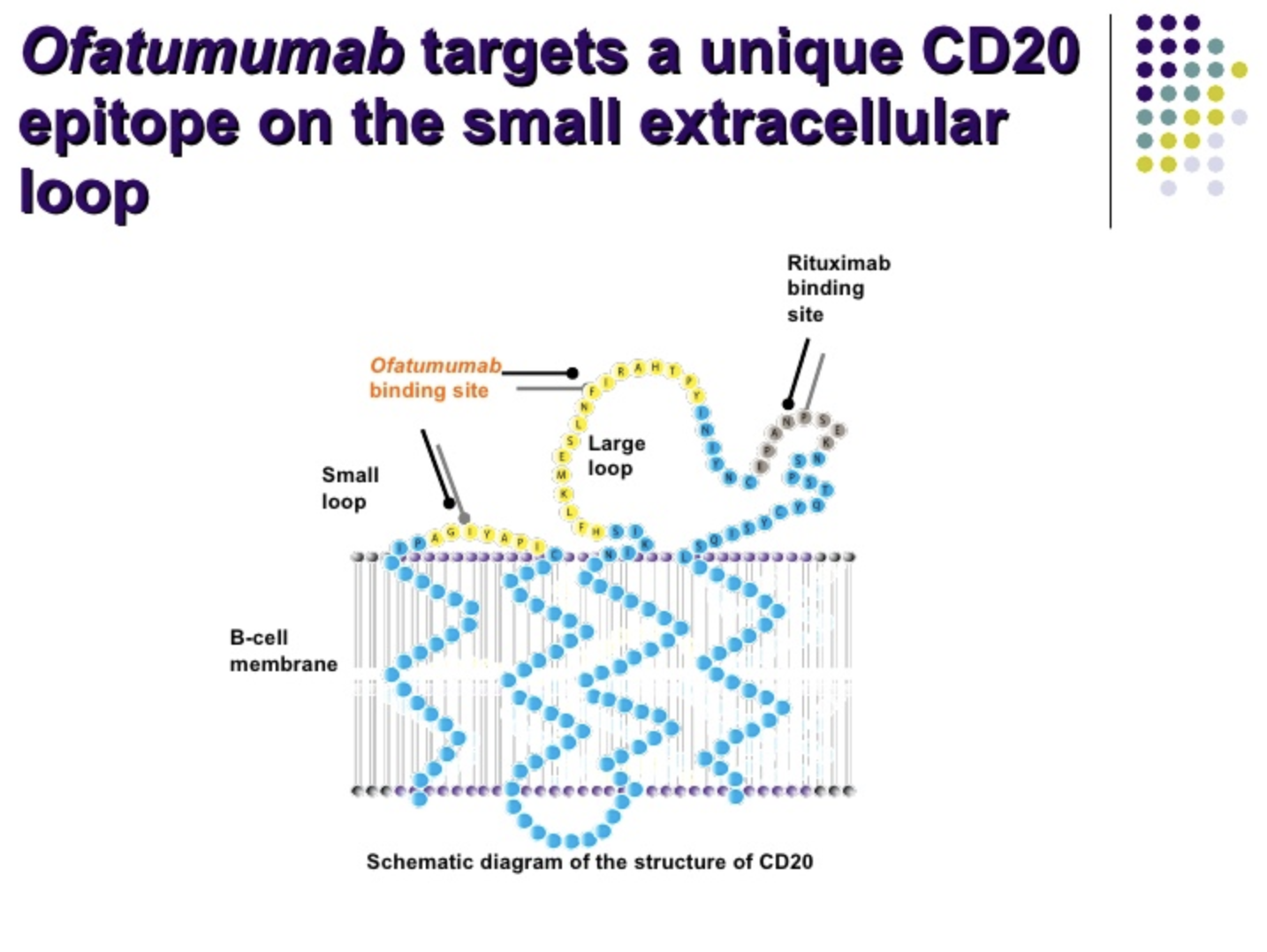
图片来源:https://www.slideshare.net/ESOSLIDES/2-stathis-10400840
Kesimpta是全人源抗CD20单抗,与特立氟胺相比,显示出优异的疗效和相似的安全性。此次FDA的批准,使得Kesimpta成为第一种也是唯一一种患者可以在家自行注射治疗的B细胞疗法,每月一次通过Sensoready自动注射笔注射。
Kesimpta的批准是基于III期临床研究ASCLEPIOS I和II期研究的结果,结果显示Kesimpta显着降低了年复发率(ARR,主要终点)和3个月后的确认残疾进展(CDP)。研究结果于2020年8月6日发表在NEJM杂志上。
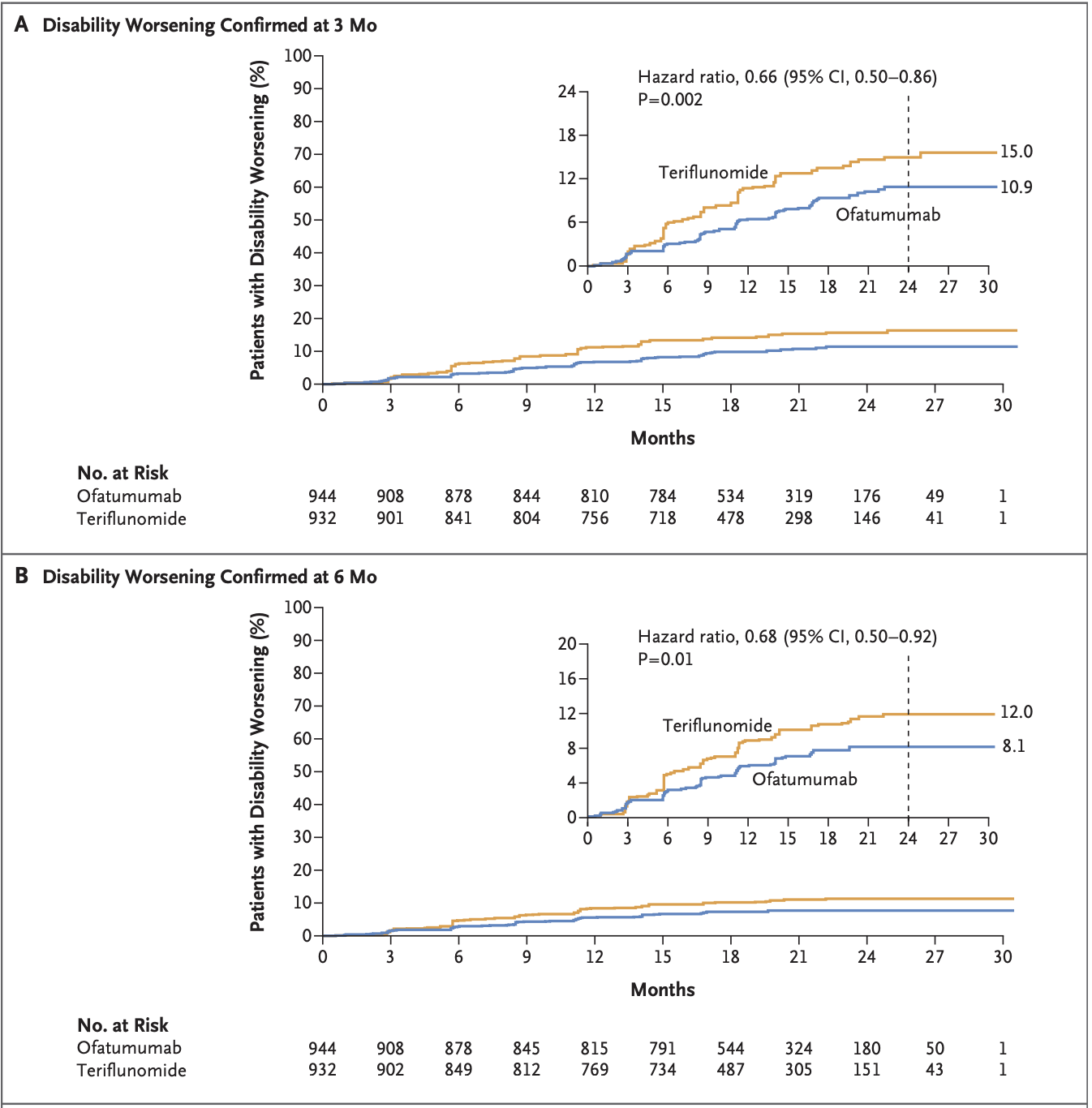
Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020;383:546-57. DOI: 10.1056/NEJMoa1917246
Kesimpta通过每月一次皮下注射为患者提供了自我给药的灵活性,无需前往医院输液治疗。II期研究APLIOS研究的阳性结果证明RMS患者通过预装注射器和Sensoready笔皮下注射Kesimpta的生物等效性。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#硬化症#
95
#mAb#
95
#多发性#
119
#FDA批准#
127
#fat#
0
学习了
144
#B细胞#
94
#ESI#
92
学习
162