STM:跨越血脑屏障治疗儿童脑瘤新思路:纳米颗粒药物输送系统
2024-01-08 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
该研究揭示了一种利用纳米颗粒作为药物载体的脑部给药方式,可以提高肿瘤部位的药物浓度,在髓母细胞瘤的小鼠模型中有效抑制肿瘤,且减轻全身毒性作用。为治疗髓母细胞瘤等脑部肿瘤提供了新思路。
小儿髓母细胞瘤(medulloblastoma)是一种发生在小脑或第四脑室的高度恶性肿瘤。目前的标准治疗方案包括最大程度的安全切除术、骨髓和脊髓照射防止扩散。即便如此,30%的患者仍然会复发,其中脑脊液路径扩散是小儿脑膜瘤相关死亡的主要原因。在过去的研究中,研究者曾尝试直接向脑脊液注入小分子药物来跨越血脑屏障,完成对脑部肿瘤的给药,但由于脑脊液周转率很高,药物很快被清除,难以累积到有效的浓度。
近日,来自耶鲁大学的研究团队在 Science Translational Medicine 上发表了题为 Intrathecal delivery of nanoparticle PARP inhibitor to the cerebrospinal fluid for the treatment of metastatic medulloblastoma 的文章,揭示了一种利用纳米颗粒作为药物载体的脑部给药方式,可以提高肿瘤部位的药物浓度,在髓母细胞瘤的小鼠模型中有效抑制肿瘤,且减轻全身毒性作用。为治疗髓母细胞瘤等脑部肿瘤提供了新思路。
本次研究中使用的药物载体是具有“核壳”结构、尺寸在90~210nm的颗粒,其中“核”由可降解材料聚乳酸(PLA)构成,外表的“壳”是由生物相容性较好的超支化聚甘油(HPG)组成。纳米颗粒载药系统是将小分子抗肿瘤制剂——PARP抑制剂talazoparib(BMN-673)包裹在PLA-HPG纳米颗粒中,通过鞘内注射给药到达脑部肿瘤区域。同时为了评估纳米颗粒在生物体的分布情况,研究团队还制备了可被荧光成像和PET成像等不同表面特征的纳米颗粒。
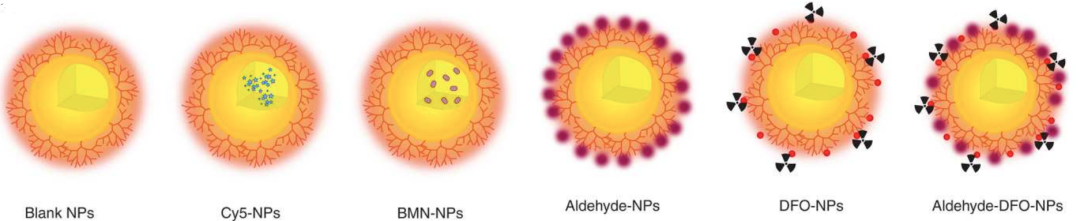
图1:A:不同运载状态的纳米颗粒(NP),从左到右示意图中的纳米颗粒分别是:空载(图中黄色中心表示“核”;橘红色树枝型表示“壳”)、载有荧光染料Cy5(用于荧光成像,绿色点状表示)、载有抗肿瘤药物BMN-673(紫色椭圆形表示)、外壳被修饰为富醛基表面(紫色圆圈表示)、外壳带[89Zr]Zr-DFO(用于PET成像,图中用红色圆圈表示)、外壳被修饰为富醛基表面且带[89Zr]Zr-DFO。
在小鼠实验中,研究人员将纳米颗粒[89Zr]Zr-DFO-NPs注射到小鼠脑脊液(游离的[89Zr]Zr-DFO作为对照组),动态PET/CT扫描的结果发现,纳米颗粒组在中央神经系统和大脑中维持的药物浓度会明显高于游离组,且随着时间推移,这种优势越来越明显。
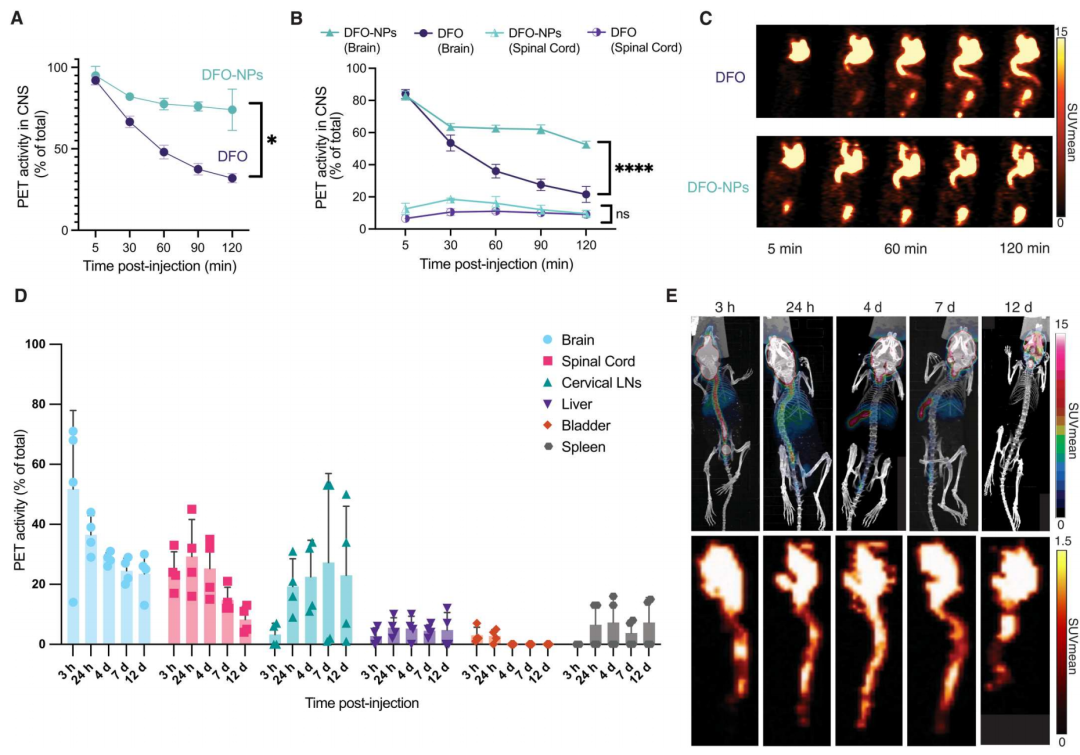
图2:无肿瘤的健康BALB/C小鼠通过鞘内注射给药途径注射[89Zr]Zr-DFO-NP或[89Zr]Zr-DFO,并连续PET/CT成像2小时(n=2)。(A)无肿瘤的健康小鼠注射[89Zr]Zr-DFO-NP和[89Zr]Zr-DFO后,中央神经系统的药代动力学曲线,*P=0.0243。(B)无肿瘤的健康小鼠注射[89Zr]Zr-DFO-NP和[89Zr]Zr-DFO后,大脑和脊髓的药代动力学曲线,****P<0.0001(大脑),ns(脊髓)。ns代表不显著,P>0.05。(C)无肿瘤的健康小鼠注射[89Zr]Zr-DFO和[89Zr]Zr-DFO-NP后,连续动态扫描2小时的全身体PET轴状断层图像。(D)无肿瘤的健康小鼠注射[89Zr]Zr-DFO-NP后,不同时间点的生物分布(从3小时到12天)(n=4,4、7和12天;n=8,3和24小时)。(E)上排:代表融合PET/CT图像的小鼠最大强度投影,注射[89Zr]Zr-DFO-NP后3小时、24小时、4天、7天和12天的图像。下排:根据颜色条平等缩放的全身体轴状断层PET图像,仅限CNS。(A、B、D的数据都是平均值+标准差)
研究人员给植入DAOY肿瘤(一种人源性的髓母细胞瘤细胞系)的小鼠注射纳米颗粒后进一步发现,与游离药物相比,纳米颗粒在肿瘤部位的积聚高于正常脑组织,能够更好地渗透到肿瘤组织中,并在其中保持较长时间。而且对肿瘤部位的组织切片表明,纳米颗粒在肿瘤组织中分布更加均匀,且能够深入渗透到肿瘤细胞的内部。相比之下,游离药物在肿瘤组织中的分布较为局限,且容易被清除。
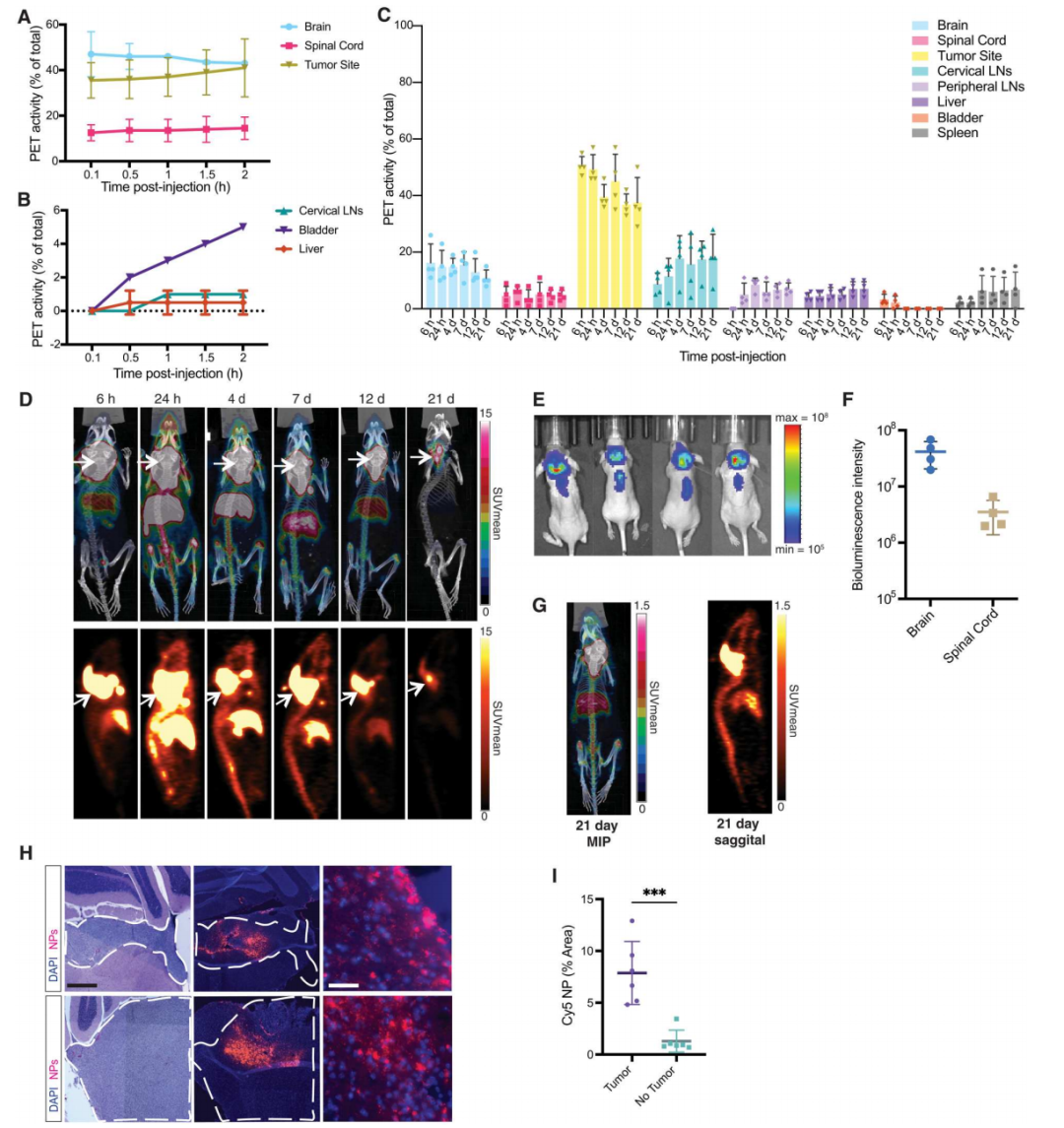
图3. [89Zr]Zr-DFO-NPs优先在肿瘤中积累。(A和B) 健康小鼠在接种DAOY细胞后3周通过IT注射[89Zr]Zr-DFO-NPs,并连续成像2小时(n = 2)。(A) 肿瘤小鼠脑、脊髓和肿瘤部位中[89Zr]Zr-DFO-NPs的药代动力学曲线。(B) 肿瘤小鼠颈部淋巴结、膀胱和肝脏的药代动力学曲线。(C) 在注射[89Zr]Zr-DFO NPs后的肿瘤小鼠在不同时间点的生物分布(从6小时到21天,n = 4)。(D) 上排:通过CM注射[89Zr]Zr-DFO-NP后6小时、24小时、4天、7天、12天和21天的最大强度投影(MIP)的代表性融合PET/CT图像。下排:全身矢状面PET图像,根据箭头进行对比。(E) 在[89Zr]Zr-DFO-NP给药和PET/CT成像前10天,接种荧光素酶标记的肿瘤细胞的小鼠的体内荧光图像(p/s/cm2/sr)。(F) 对(E)中小鼠脑和脊髓肿瘤信号的BLI (p/s/cm2/sr)进行定量。(G) 第21天的PET/CT MIP和矢状面PET图像,SUV强度降低10倍,以便可视化。(H) 小脑肿瘤的H&E染色和相应的Cy5- NPs (红色)的DAPI (蓝色)染色图像,放大倍数为10×和40×。比例尺:500μm (左两列)和25μm (右列)。(I) 在有或没有肿瘤的小鼠全脑的10个代表性区域中,对Cy5-NP面积分数进行定量,给药后24小时(n = 5),***P < 0.001,单因素方差分析。
在治疗效果上,载药纳米颗粒对肿瘤的生长速度具有明显的抑制作用,小鼠中位生存期显著延长(载药纳米颗粒组生存期56天,游离药物组生存期29天)。并且当纳米载药颗粒与替莫唑胺(一种治疗胶质母细胞瘤等恶性脑肿瘤的化疗药物)联合用药时,对肿瘤的抑制效果会增强。
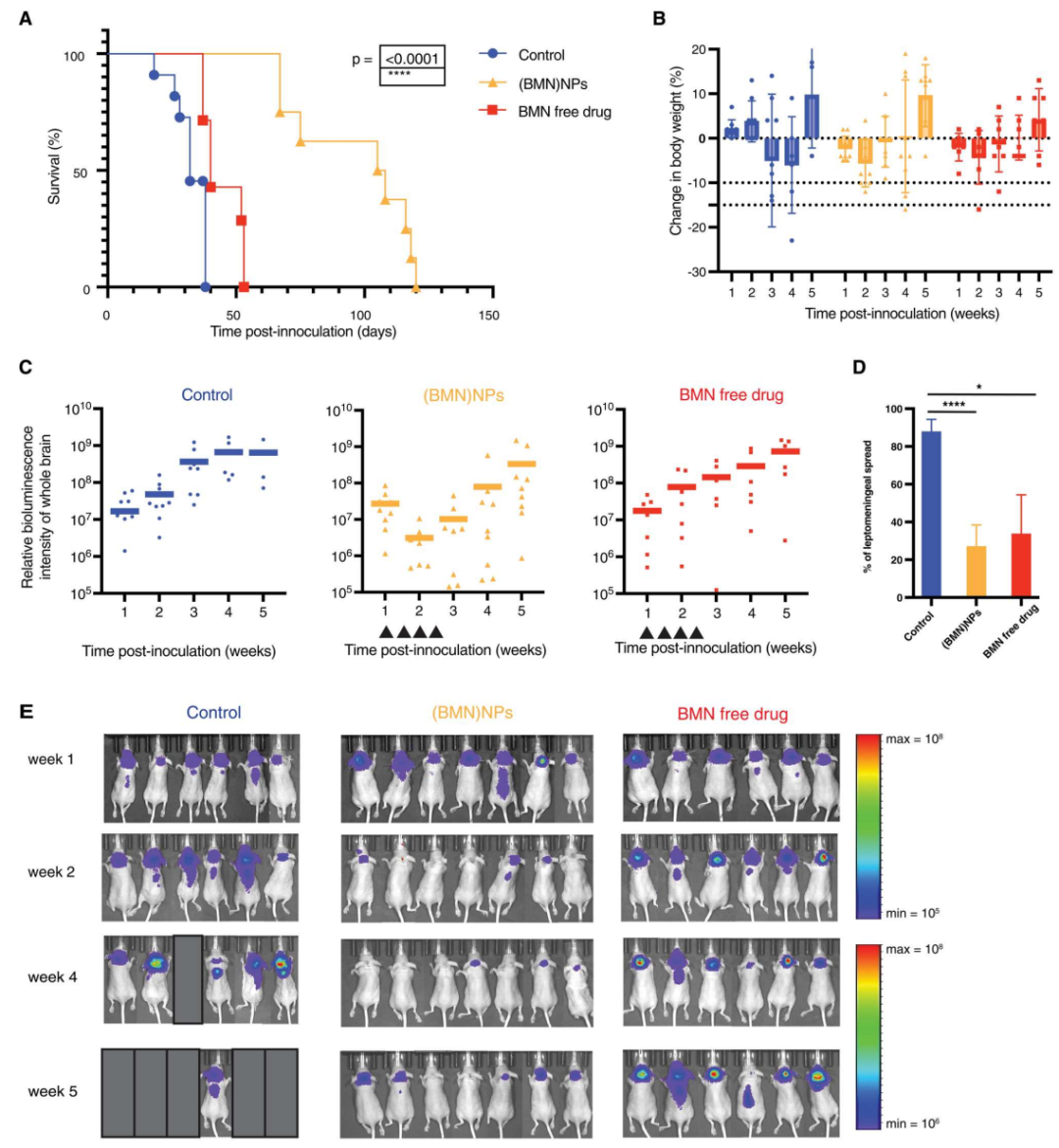
图4.给植入肿瘤的小鼠重复给药,评估(BMN)NPs的肿瘤抑制和抗转移能力。(A) BMN-673治疗组(n=7)、(BMN)NP治疗组(n=8)和对照组J:Nu小鼠(n=9)的生存曲线。对数秩检验,然后进行重复测量方差分析,****P<0.0001。(B)所有组的体重变化。数据以平均值±标准差表示。(C)全脑的生物荧光成像(BLIs)(p/s/cm2/sr)的感兴趣区域(ROI)分析。(D)植入肿瘤14天后,通过体内成像系统(IVIS)观察到有肿瘤(LMS)的小鼠百分比(对照组n=16,NP组n=10,自由组n=10)。***P<0.0001和P<0.05,单因素方差分析。(E)DAOY荷瘤小鼠的全身生物荧光图像。前两行和后两行的生物荧光比例不同。
肿瘤抑制剂BMN-673本身具有一定的细胞毒性,在健康小鼠的毒性试验中发现,载药纳米颗粒的最大耐受计量(MTD=1.25 mg / kg)比游离药物的MTD值(0.125mg/kg)高10倍。对两个实验组进行血细胞计数后发现,游离BMN-673治疗的小鼠在第3天出现进行性白细胞减少和血小板减少,在第7天没有明显改善;而通过纳米颗粒给药的小鼠在治疗过程中保持正常的白细胞、红细胞和血小板计数,并且除了嗜酸性粒细胞外,所有细胞计数在第7天都恢复到了正常范围。说明纳米载药颗粒的生物毒性也比游离药物更小。
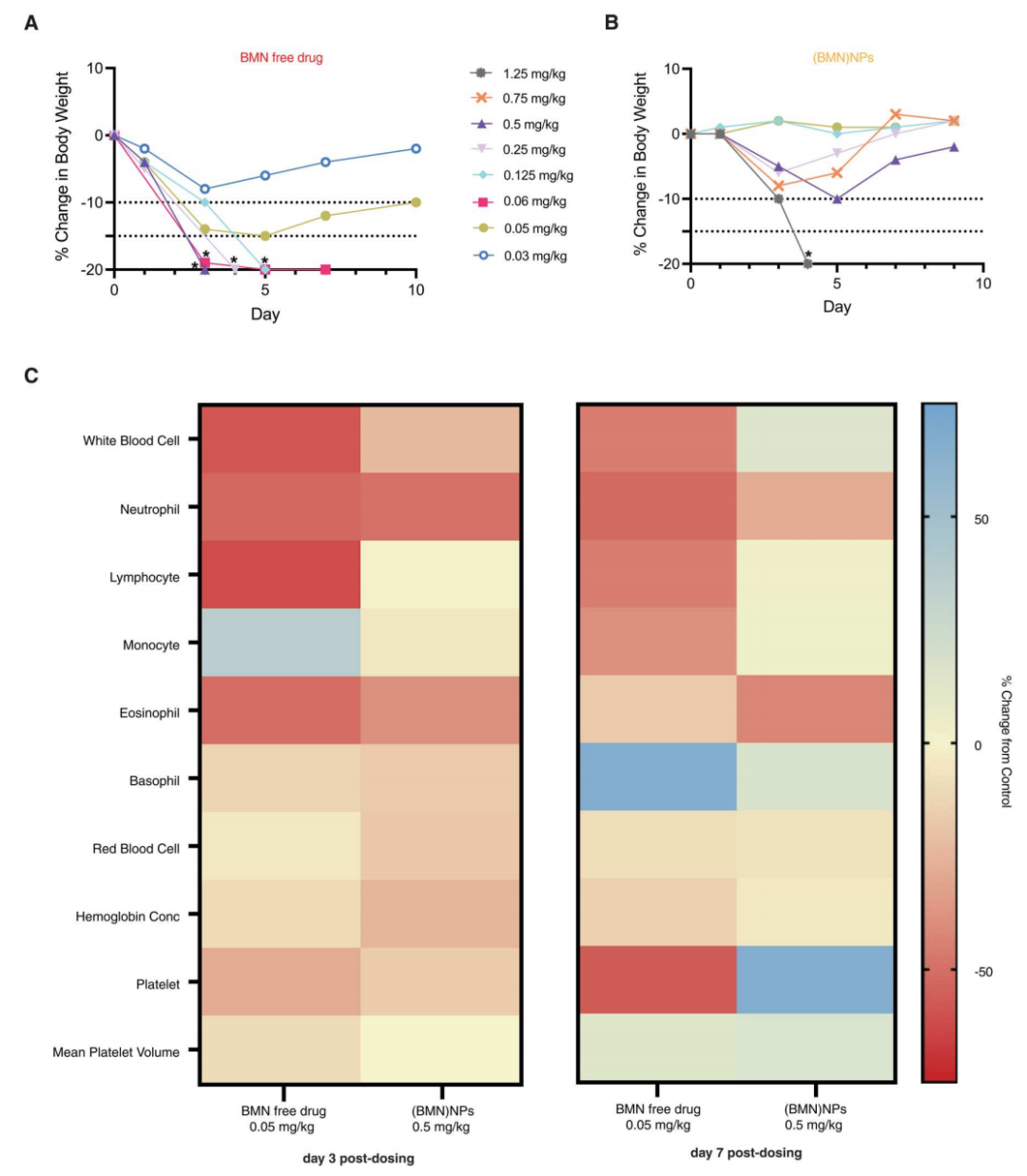
图5. BMN-673游离药物和载药纳米颗粒((BMN)NPs)在小鼠中的毒性。(A和B)不同剂量的游离BMN-673和(BMN)NPs在健康的J:Nu小鼠中的耐受性,通过监测体重和整体健康状况来评估单次鞘内注射治疗后的情况。首先给一只小鼠服用该剂量,如果耐受则扩展到5只。黑色星号表示因体重过度减轻而死亡或被安乐死的动物。(A)游离BMN-673在剂量大于等于0.06 mg/kg时会致命。在剂量为0.05 mg/kg时,动物体重减轻不超过15%。(B) (BMN)NPs在剂量为1.25 mg/kg时致死。在更低剂量下,小鼠体重减轻不超过10%。(C)J:Nu小鼠用BMN-673或(BMN)NPs以最高耐受剂量(MTD)治疗后,进行全血细胞计数、白细胞分类计数和血小板计数,以评估血液毒性。这项研究中,每组n=6。
美中不足的是,本次研究仅用少量的小鼠进行了给药实验,并未扩大到大型哺乳动物(如猴)。能否真正应用于儿童脑肿瘤的治疗,还需要更深入且更大样本的药效学、药代动力学研究,以及细胞分子水平的机制研究。但这项研究仍提供了一种针对脑部肿瘤的给药新思路,相信随着医学技术的进步,纳米载药系统用于脑肿瘤治疗的方案也有希望进入到临床阶段。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#髓母细胞瘤# #儿童脑瘤# #纳米颗粒药物输送系统#
56
不错,学习了。
34
小儿髓母细胞瘤(medulloblastoma)是一种发生在小脑或第四脑室的高度恶性肿瘤
42
不错,学习了。
49