非小细胞肺癌检测的DDR基因是个啥?竟与放疗、免疫治疗的疗效相关
2023-12-19 苏州绘真医学 苏州绘真医学 发表于上海
本研究旨在评估晚期 NSCLC 患者大型回顾性队列中 DDR 基因致病性变异与治疗效果的相关性。
DNA 损伤修复(DDR)基因突变是癌症的标志之一,与癌细胞对某些疗法的敏感性较高有关。本研究旨在评估在晚期非小细胞肺癌(NSCLC)患者中,DDR 致病性变异与治疗效果的相关性。对2015年1月至2020年8月在三级医疗中心就诊并接受NGS检测的晚期NSCLC患者进行回顾性研究,根据DDR基因状态进行聚类,使用log-rank和Cox回归分析比较客观缓解率(ORR)、无进展生存期(PFS)(接受全身治疗的患者)、局部PFS(接受放疗的患者)和总生存期(OS)。在 225 例具有明确DDR状态的患者中,42 例存在致病性/可能致病性 DDR 变异(pDDR),183 例不存在 DDR 变异(wtDDR)。两组的总生存期相似(24.2 vs. 23.1个月,p = 0.63)。在接受放疗的患者中,pDDR组的中位局部PFS较高(中位45个月 vs. 9.9个月,p=0.044)。在接受免疫检查点阻断治疗的患者中,pDDR组的ORR较高(88.9% vs. 36.2%,p = 0.04),中位PFS较长(未达到 vs. 6.0个月,p = 0.01)。在接受铂类化疗的患者中,两组的ORR、中位PFS和中位OS没有差异。本回顾性研究的数据表明,在 4 期 NSCLC 患者中,DDR 通路基因致病性变异可能与放疗和免疫检查点抑制剂(ICI)疗效更高有关。应进一步进行前瞻性探索。
研究背景
DNA 损伤修复(DDR)机制负责识别 DNA 损伤,阻断细胞周期进程,以及定位和修复病变。通过几条由不同蛋白控制的通路起作用:碱基切除修复(PARP1、PARP2 等),核苷酸切除修复(ERCC1-4 等),错配修复(MSH2-6、PMS2 等),同源重组(BRCA1/2、RAD、MRE11A 等)或非同源重组(Ku70、Ku80、PRKDC 等)。在癌前细胞中,这些通路的缺陷可导致基因变异的积累,最终导致癌变屏障的崩溃。基因组不稳定性是癌症的普遍标志。数据表明,DNA修复基因胚系突变增加癌变的易感性。
同时,DNA修复反应的失调可能有助于克服细胞对治疗的耐药性。因此,DDR缺陷可作为抗癌治疗的靶点打开治疗窗口,不仅是直接诱导DNA损伤的化疗和放疗,还有靶向治疗和免疫治疗。大量数据表明,DDR 基因致病性变异与尿路上皮癌、前列腺癌和卵巢癌对铂类化疗的敏感性较高有关,预测卵巢癌、乳腺癌、胰腺癌、去势抵抗性前列腺癌和原发性肝癌对 PARP 抑制剂的反应,并作为不同肿瘤类型 [包括非小细胞肺癌(NSCLC)]中免疫检查点抑制剂(ICI)反应相关生物标志物发挥有希望的作用。
肺癌是基因组最不稳定的实体瘤之一。研究表明,胚系或体细胞 DDR 基因突变与肺癌的发生发展存在密切关联。根据程序性死亡配体 1(PD-L1)表达状态,ICI 联合化疗或作为单一药物是 NSCLC 标准一线和二线治疗。然而,需要额外的 ICI 反应相关生物标志物,以更好地定制治疗。
本研究旨在评估晚期 NSCLC 患者大型回顾性队列中 DDR 基因致病性变异与治疗效果的相关性。
研究结果
在数据可及的 348 例 IV 期 NSCLC 患者中,183 例(53%)无 DDR 基因(包括 ATM、ATR、BLM、 BRCA1、BRCA2、BRIP1、CHEK1、CHEK2、ERCC4、FANCA、FANCC、MLH1、MRE11A、MSH2、MSH3、MSH6、MUTYH、NBN、PALB2、PARP1、PMS2、POLE、RAD21、RAD50、RAD51、RAD51B、RAD51C、RAD51D、RAD52 和 RAD54L)变异(wtDDR),42 例(12%)有致病性或可能致病性变异(pDRR),21 例(6%)有良性或可能良性变异,94 例(27%)有意义未明的变异(VUS);8例患者(2%)DDR状态无法确定(图1)。最终队列包括 225 例具有明确 DDR 状态的患者:wtDDR(n=183) 或 pDDR(n=42)。116 例患者有 ctDNA NGS数据,101 例患者有 FFPE 组织 NGS 数据,8 例患者没有样本类型信息。wtDDR组和pDDR组的临床特征平衡(表1)。
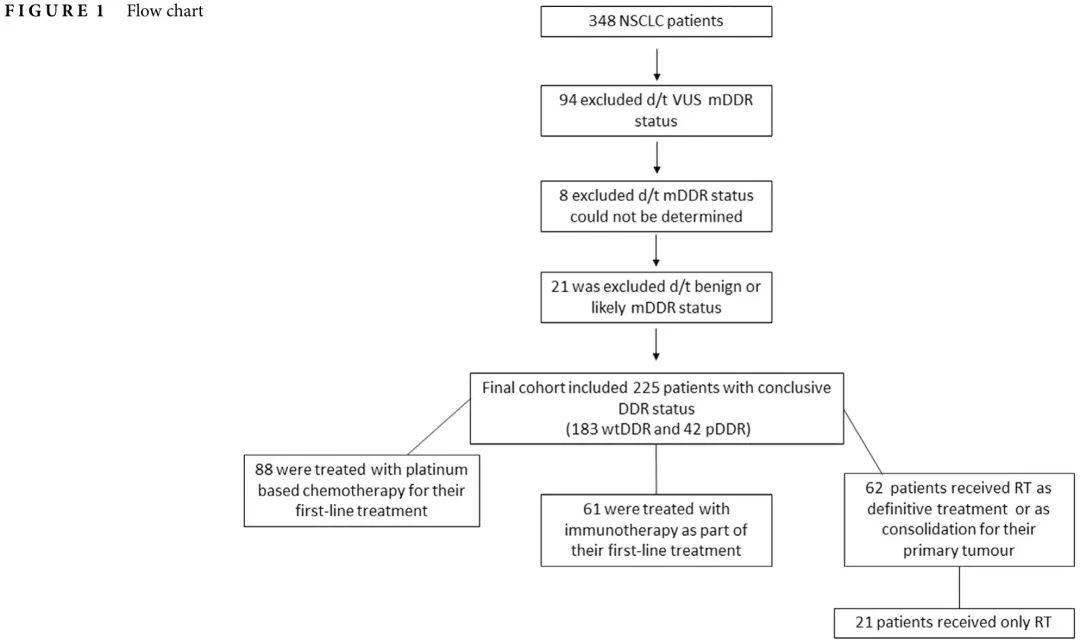
图1
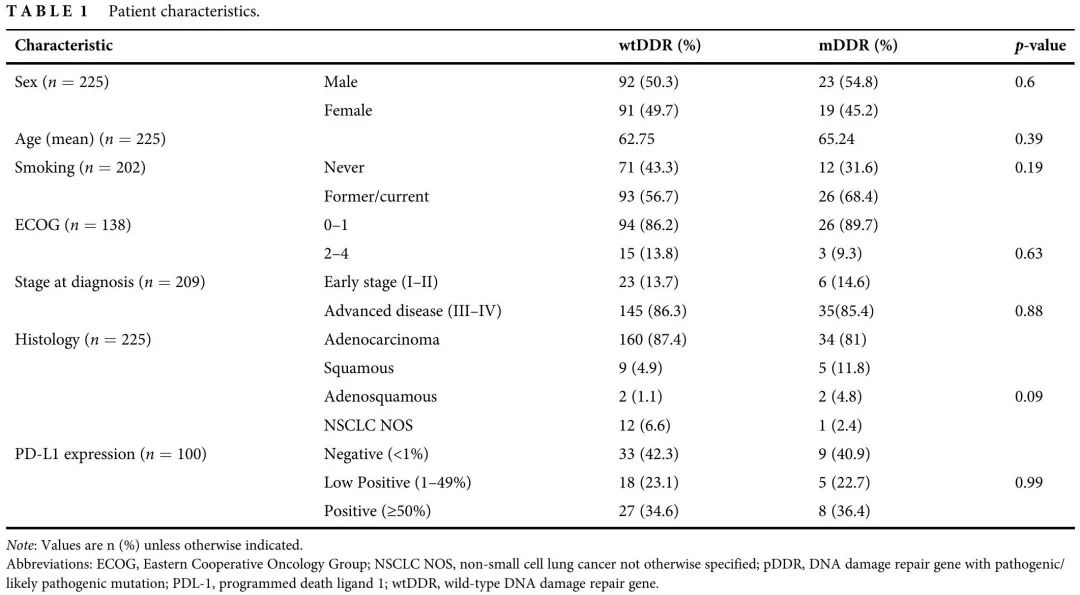
表1
中位随访时间为19.8个月,wtDDR组和pDDR组的OS无显著差异(23.1 vs. 24.2个月,p=0.63)。
44 例患者接受了原发肿瘤巩固放疗(图 1):32 例为 wtDDR 肿瘤,10 例为 pDDR 肿瘤。剂量分割方案为 30-54 格雷(Gy),分 3-15 次。10 例寡转移性疾病患者接受根治性剂量 72-66 Gy,分 33-36 次或 SBRT 60 Gy,分 5 次。2例患者计划接受根治性剂量,但在 48 Gy 分 24 次和 46 Gy 分 23 次后停止治疗,原因未知。两组间ORR无差异(56% vs. 70%,p = 0.425;表2)。pDDR组放疗后局部PFS长于wtDDR组(中位45个月 vs. 9.9个月;HR 0.74,95% CI:0.549–0.995,p = 0.04)。在排除接受同步全身治疗的患者(n = 15)后,这一结果保持不变(中位局部PFS:pDDR,112.5个月,wtDDR,11.7个月;HR 0.48,95% CI:0.24–0.971,p = 0.017)(图 2a,b)。
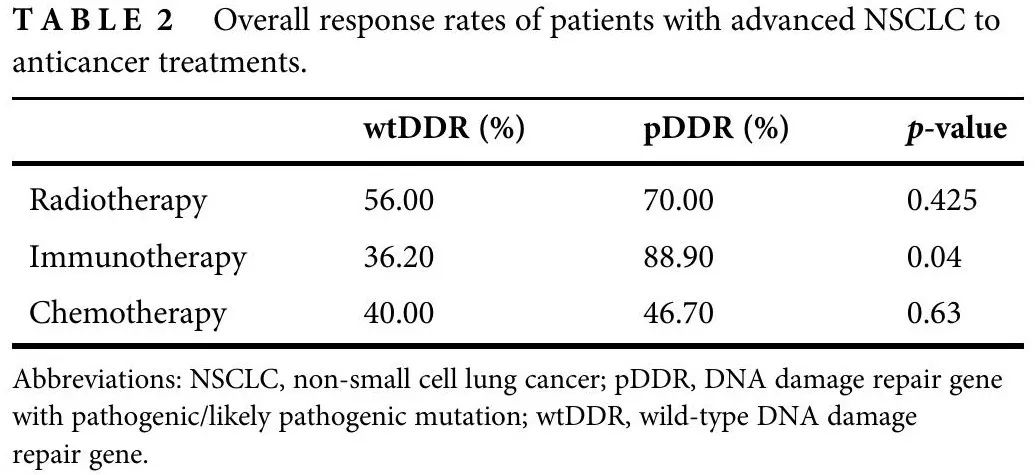
表2
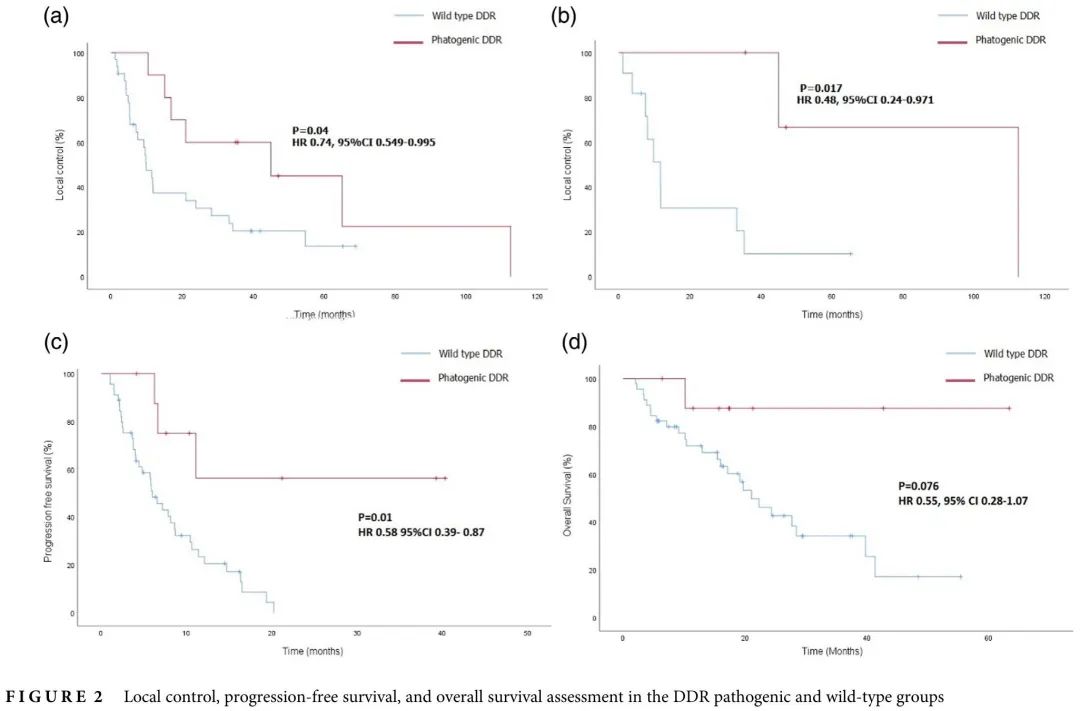
图2
56 例患者(47 例 wtDDR 和 9 例 pDDR)接受免疫联合或不联合化疗作为一线治疗。pDDR组的缓解率更高(88.9% vs. 36.2%,p = 0.04;表2),中位PFS更长(未达到 vs. 6.0个月,HR 0.58,95% CI:0.39–0.87,p = 0.01)。中位OS具有数值差异,但没有统计学意义(未达到vs.21.1个月,HR 0.55,95%CI:0.28–1.07,p = 0.076)(图2c,d)。
在接受一线铂类化疗的85例患者中,70例为wtDDR,15例为pDDR,两组的ORR(40% vs. 46.7%,p = 0.63)、中位PFS(4.8 vs. 6个月,HR 1.01,95% CI:0.816–1.252,p = 0.92)和中位OS(21.6 vs. 19.4个月,HR 1.118,95% CI:0.917–1.363,p = 0.27)无显著差异。
讨 论
随着全面基因检测正成为 NSCLC 患者的标准实践,关于 DDR 通路基因变异频率及其临床意义的数据已经积累。携带 DDR 基因突变的肺癌患者比例约为 29.5%-49.6%。本研究评估了大型晚期 NSCLC 患者队列中 DDR 基因致病性变异与不同治疗方案疗效的临床相关性。结果表明,在接受放疗和ICI治疗的患者中,致病性变异与结局较好相关,在接受铂类化疗的患者中,按DDR状态分层,疗效没有差异。回顾了其他关于特定DDR致病性变异与NSCLC治疗效果相关性的文献,本研究结果与其一致(表3,4,5)。
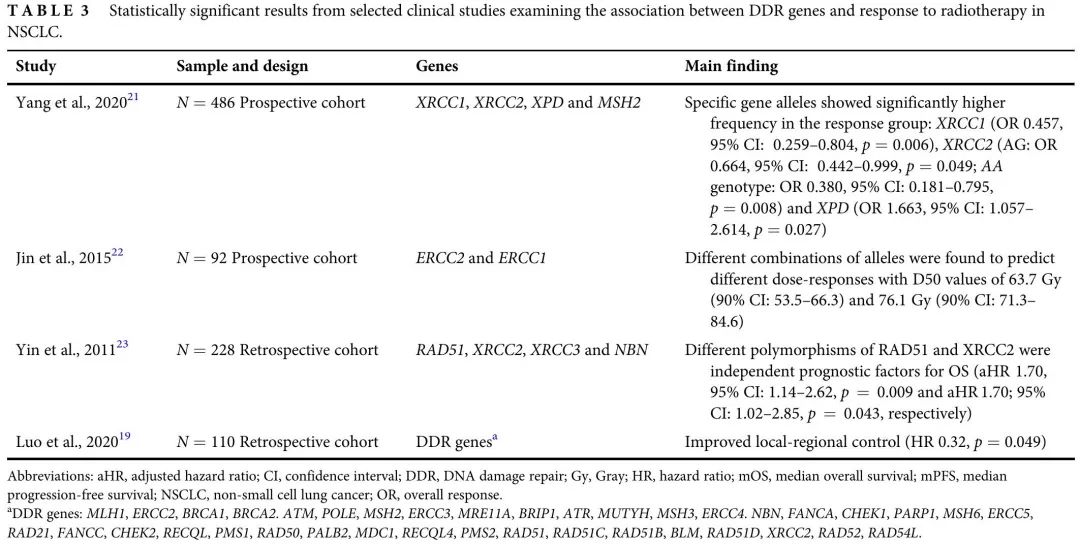
表3
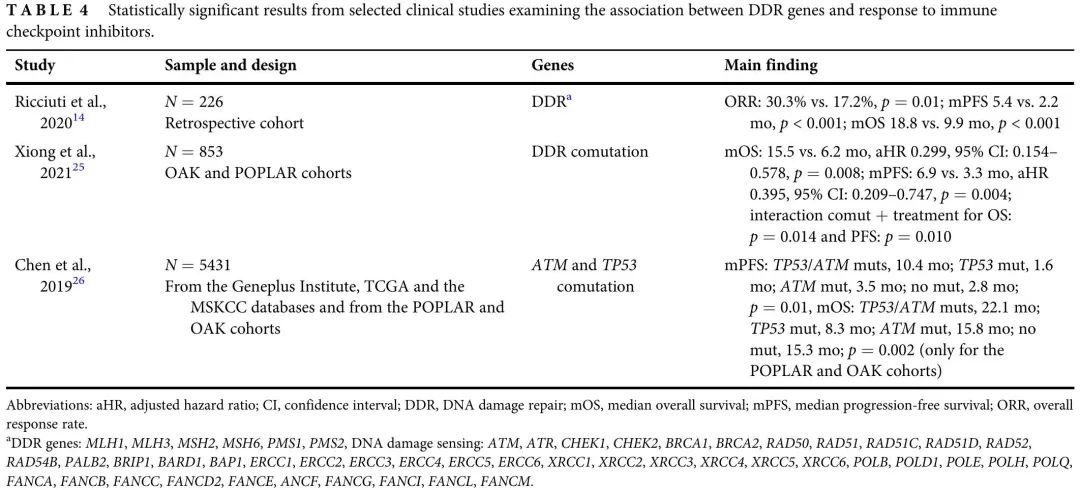
表4
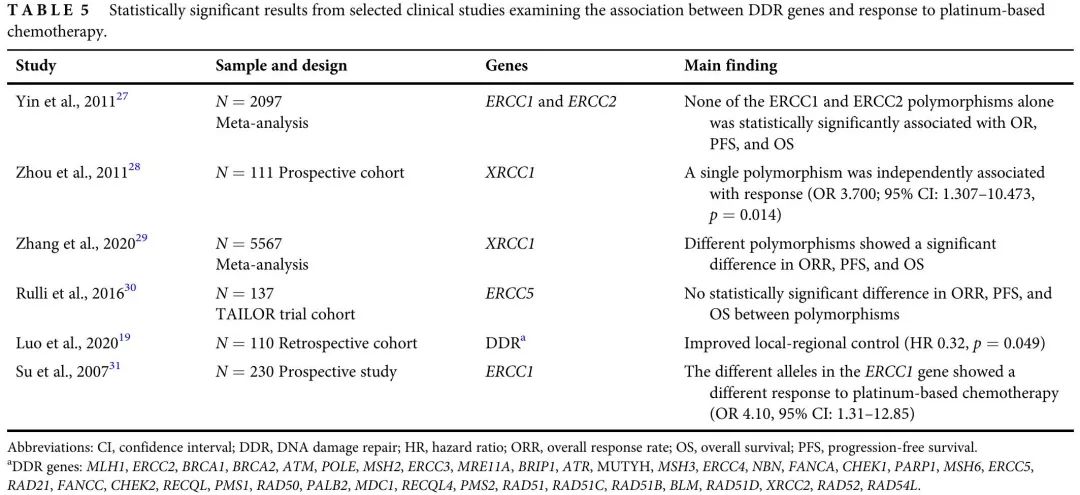
表5
我们的数据显示,在接受放疗的患者中,pDDR组局部PFS较长,支持既往研究报道的放疗在具有DDR致病性变异患者中的疗效(表3)。Luo 等人表明在 III 期 NSCLC 患者中,DDR 基因变异与对放疗的良好反应相关,但其研究存在局限性,纳入了同时接受化疗的患者。本研究的额外价值是在接受或未接受全身治疗的晚期 NSCLC 患者中观察到对放疗的敏感性较高。鉴于放疗主要依靠诱导双链DNA断裂击败癌症细胞的修复机制,触发细胞凋亡,我们发现的一个可能的解释是,具有DDR致病性变异的癌细胞修复放疗诱导的DNA损伤的能力已经受损。
关于放疗,使用基因组生物标志物来预测治疗获益的做法仍处于早期阶段。NGS可以分析放疗敏感性的想法主要是一种研究假设,临床应用很少。Jin 等人表明,不同的 ERCC1 和 ERCC2 等位基因组合预测不同的剂量反应,50% 反应的最大剂量值不同,从 63.7 到 76.1 Gy不等。该研究积累了证据,最终可能促进基于肿瘤生物学和基因组学而不仅是解剖学的个体化定制、剂量调整放疗方案的概念。
我们发现pDRR组和wtDRR组的ORR没有差异。一种可能的原因是存在放疗后炎症或纤维化变化,如在放疗后进行的计算机断层扫描(CT)和正电子发射断层扫描(PET)/CT 扫描中所见,这使得疗效评估具有挑战性。
本研究证实了其他几项评估DDR基因致病性变异与免疫检查点阻断治疗疗效相关性的研究的数据(表4)。Ricciuti等人分析了66例NSCLC患者中53个DDR基因变异的影响,发现有DDR变异的肿瘤患者ORR(30.3% vs. 17.2%,p = 0.01)、中位PFS(5.4 vs. 2.2个月,p < 0.001)和中位OS(18.8 vs. 9.9个月,p < 0.001)优于没有DDR致病性变异的患者。Xiong 等人探索了 DDR 基因共突变与治疗(阿替利珠单抗/多西他赛)疗效的相关性,发现在 PD-L1 表达阴性或低表达的患者亚组中,接受阿替利珠单抗治疗的共突变患者OS(p = 0.010)和 PFS(p = 0.036)显著较优。
研究者正致力于识别从PD-1/PD-L1抑制剂治疗中获益最多的患者。在NSCLC中,PD-L1表达是唯一经过验证的预测免疫检查点阻断疗法获益的生物标志物。然而,KEYNOTE-024 研究显示,在 PD-L1 高表达患者中,帕博利珠单抗的 ORR 仅为 44.8%,提示其不是理想的生物标志物。Xiong等人表明,DDR 的预测价值在 PD-L1 表达阴性或低表达的亚组中保持不变。不幸的是,在我们的队列中,大多数患者缺乏PD-L1表达数据,因此无法进行类似的分析来证实其发现。
几项研究评估了DDR基因致病性变异对铂类化疗疗效的影响,结果相互矛盾(表5)。在本研究中,没有发现pDDR组和wtDDR组的ORR、PFS和OS有显著差异。这些组太小,无法评估特定的基因,如BRCA。
本研究受到回顾性设计及其固有偏倚的限制,包括难以总结因果关系,以及缺乏正式的RECIST疗效评估。一个重要的局限性是特定亚组的样本量较小,例如仅RT组(n = 15),尽管结果存在统计学上的显著差异,但无法得出确切的结论。此外,DDR基因变异是通过七个不同的NGS平台识别的,一些来源于FFPE,另一些来源于cfDNA,只覆盖了部分 DDR 基因。需要进行前瞻性观察性试验,来得出这些问题更可信的答案。最后,组间存在一些重叠,RT组的患者也出现在免疫治疗组中。大多数患者没有肿瘤突变负荷(TMB)数据。DRR 基因致病性变异通常与 TMB 较高有关,由于缺少数据,无法得出 TMB 是否可能为 DDR 变异的替代物。
总而言之,本研究结果支持既往研究数据,在 NSCLC 患者中,DDR 致病性变异的存在与放疗和 ICI 疗效较好相关。前瞻性临床试验应记录这些变异,进一步探索其作为生物标志物用于个体化抗癌治疗。
参考文献:
Averbuch I, Tschernichovsky R, Icht O, Goldstein DA, Mutai R, Dudnik E, Rotem O, Peled N, Allen AM, Laufer-Geva S, Goldberg Y, Zer A. Correlations between pathogenic variants in DNA repair genes and anticancer treatment efficacy in stage IV non-small cell lung cancer: A large real-world cohort and review of the literature. Thorac Cancer. 2023 Jun;14(17):1589-1596. doi: 10.1111/1759-7714.14902. Epub 2023 Apr 24. PMID: 37095004; PMCID: PMC10260479.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#非小细胞肺癌# #DNA 损伤修复#
62