中国青年学者领衔!最新Nature Biotechnology:活细菌肿瘤免疫治疗
2024-10-06 BioMed科技 BioMed科技 发表于上海
研究利用工程化非致病性大肠杆菌携带抗诱饵 IL18 突变体治疗癌症,激活免疫反应,增强 CAR-NK 细胞抗肿瘤能力,为癌症治疗提供新策略。
癌症是全球健康的主要威胁之一,尽管近年来在癌症治疗领域取得了显著进展,包括手术、化疗、放疗、靶向治疗和免疫治疗等,但许多癌症类型,特别是晚期和转移性癌症的治疗仍然面临重大挑战。这些挑战包括治疗的副作用、肿瘤的耐药性、以及免疫抑制性的肿瘤微环境等问题。近年来,免疫治疗作为一种新兴的治疗手段,通过激活患者自身的免疫系统来攻击肿瘤细胞,已经在某些类型的癌症治疗中取得了显著的成效。特别是CAR-T细胞疗法在血液癌症的治疗中已经取得了革命性的进展,但对实体瘤的治疗仍然存在较大的困难。相似的,CAR-NK细胞疗法策略也被提出,通过将特定的受体表达在NK细胞表面,使其能够特异性地识别和杀伤肿瘤细胞。同样,CAR-NK细胞疗法对实体瘤的治疗仍然面临挑战。
在这一背景下,研究者们开始探索新的治疗策略,以期提高癌症治疗的响应率和安全性。其中,利用微生物,尤其是细菌,作为癌症治疗的载体,成为了一个研究的热点。一些细菌能够选择性地在肿瘤组织中聚集,这一特性为开发新型癌症治疗方法提供了新的可能性。通过基因工程改造的细菌,可以设计成递送抗肿瘤药物、免疫激活剂或其他治疗分子的载体,从而实现对肿瘤的精准治疗。
丹娜法伯癌症研究院Rizwan Romee和密西根大学李嘉禾团队利用非致病性的大肠杆菌(E. coli)携带IL18 DR18这一种创新的方法,旨在通过增强免疫反应来治疗癌症。IL18是一种免疫激活细胞因子,能够促进Th1细胞和NK细胞的活性,从而增强抗肿瘤免疫反应。然而,IL18的活性受到其结合蛋白的抑制。研究者通过设计抗诱饵的IL18突变体(DR18),旨在减少这种抑制作用,从而更有效地激活免疫系统。相关内容以“Non-pathogenic E. coli displaying decoy-resistant IL18 mutein boosts anti-tumor and CAR NK cell responses”为题发表在《Nature Biotechnology》上。

【主要内容】
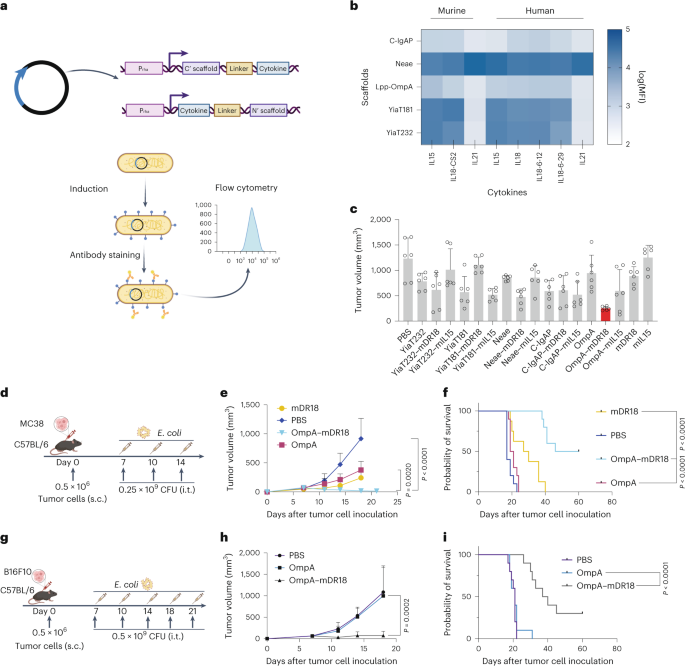
图1 非致病性E. coli表面携带小鼠mDR18对肿瘤生长和存活的影响
研究者们通过将不同类型的大肠杆菌注射到携带结肠癌细胞(MC38)的C57BL/6小鼠中,评估了它们对肿瘤的抑制效果。结果显示,携带OmpA-mDR18的大肠杆菌能够有效控制肿瘤生长,并且与空载体(OmpA)、纯mDR18蛋白和磷酸盐缓冲液(PBS)相比,具有显著的抗肿瘤效果。此外,优化后的OmpA-mDR18细菌在较低剂量下也能显著抑制肿瘤生长,且有一半的小鼠在100天后仍然没有肿瘤。这些结果表明,工程化大肠杆菌通过表面展示mDR18能够诱导强大的CD8+ T细胞和NK细胞依赖的免疫反应,从而抑制肿瘤进展。
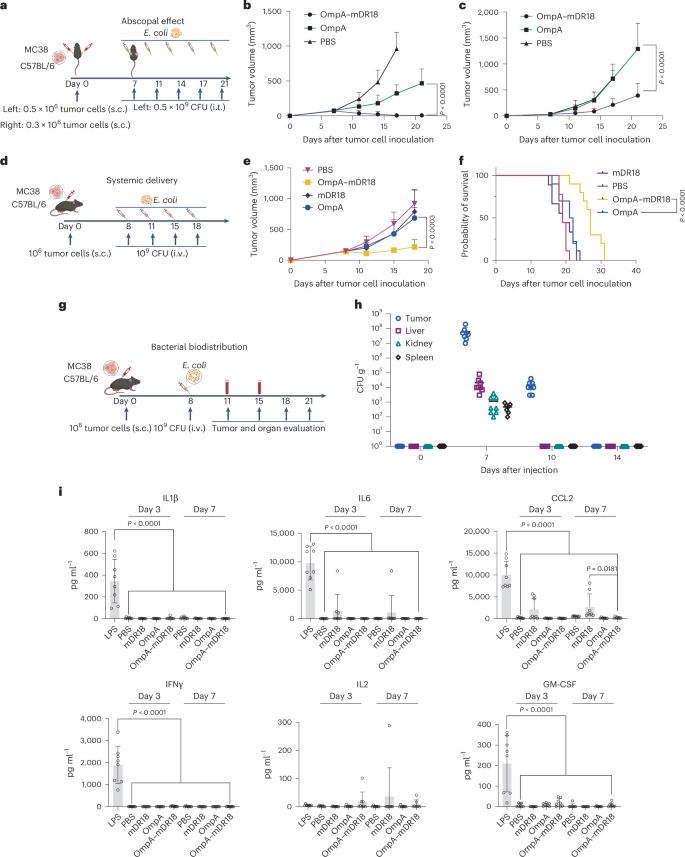
图2 OmpA-mDR18工程化大肠杆菌在肿瘤治疗中诱导的免疫反应和安全性
研究中,C57BL/6小鼠接种MC38肿瘤细胞后,通过尾静脉注射OmpA-mDR18大肠杆菌,然后监测肿瘤生长和存活情况。结果显示,与对照组相比,接受OmpA-mDR18治疗的小鼠展现出更好的肿瘤控制和生存益处。此外,实验还评估了工程化细菌的安全性,包括细菌在小鼠体内的分布和潜在毒性。研究发现,即使通过系统给药,OmpA-mDR18处理的小鼠也未表现出明显的毒性症状,如体重减轻或行为改变,且在重要器官中未检测到细菌,表明该治疗方法具有良好的安全性。
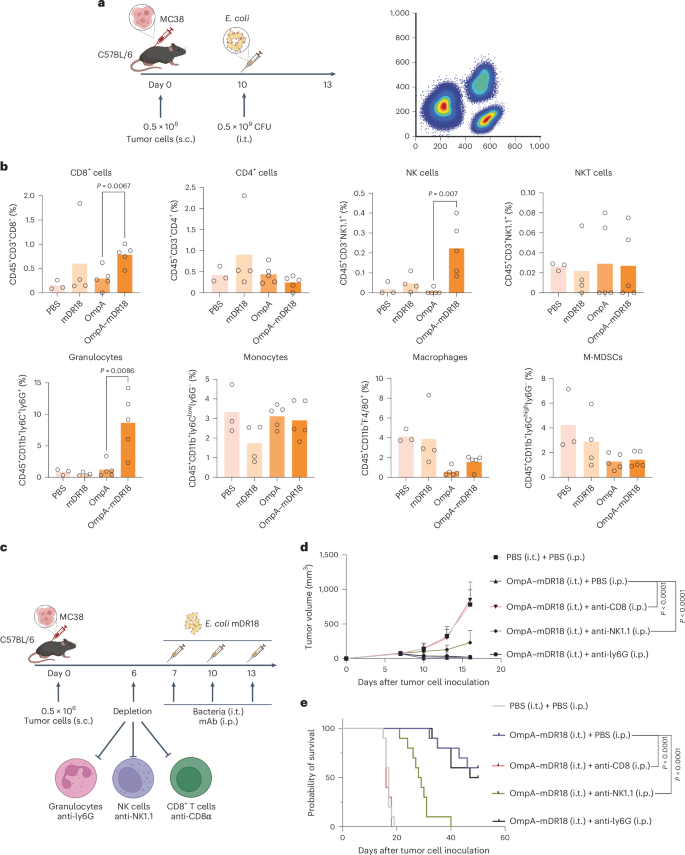
图3 OmpA-mDR18大肠杆菌对肿瘤微环境中免疫细胞的影响
研究发现,经过OmpA-mDR18处理的小鼠,其肿瘤组织中CD8+ T细胞、NK细胞和粒细胞的浸润明显增加,而肿瘤相关巨噬细胞(TAMs)和单核细胞来源的抑制细胞(M-MDSCs)的数量则有所减少。这表明OmpA-mDR18能够调节肿瘤微环境,增强免疫细胞的浸润,减少免疫抑制细胞的数量。此外,通过耗竭实验进一步证实了CD8+ T细胞和NK细胞在介导OmpA-mDR18大肠杆菌抗肿瘤反应中的关键作用,而粒细胞的耗竭对治疗效果影响不大。
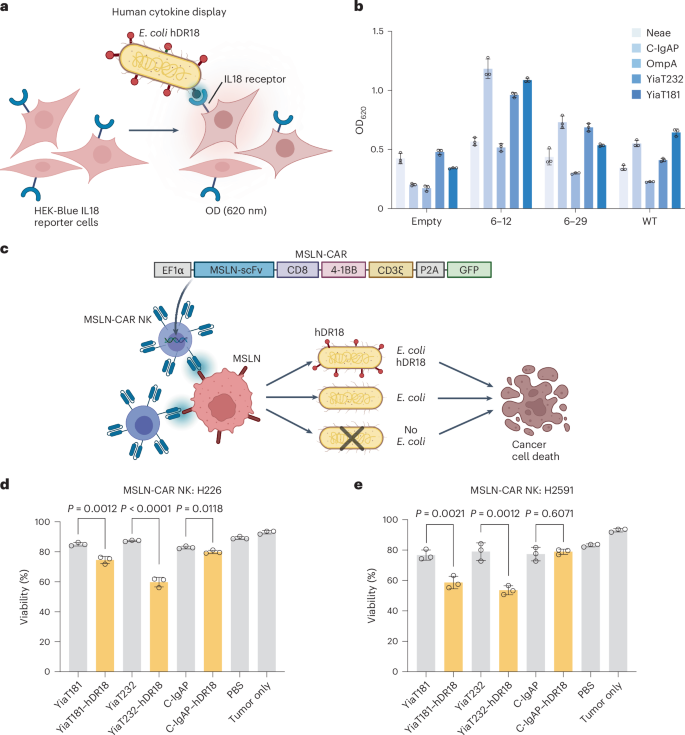
图4 大肠杆菌展示人DR18(hDR18)增强CAR-NK细胞对肿瘤的杀伤能力
研究中,通过流式细胞仪检测了不同细菌骨架展示的hDR18的活性,并评估了这些工程化大肠杆菌与MSLN-CAR-NK细胞共培养后的细胞毒性。结果显示,使用YiaT232骨架携带hDR18的大肠杆菌在增强CAR-NK细胞对肿瘤细胞的杀伤能力方面最为有效。此外,体内实验表明,与系统性给予CAR-NK细胞和YiaT232-hDR18大肠杆菌治疗的小鼠相比,单独使用YiaT232或hDR18处理的小鼠在肿瘤控制和生存期方面表现较差。这些结果表明,工程化大肠杆菌通过激活NK细胞,增强了CAR-NK细胞的抗肿瘤反应。
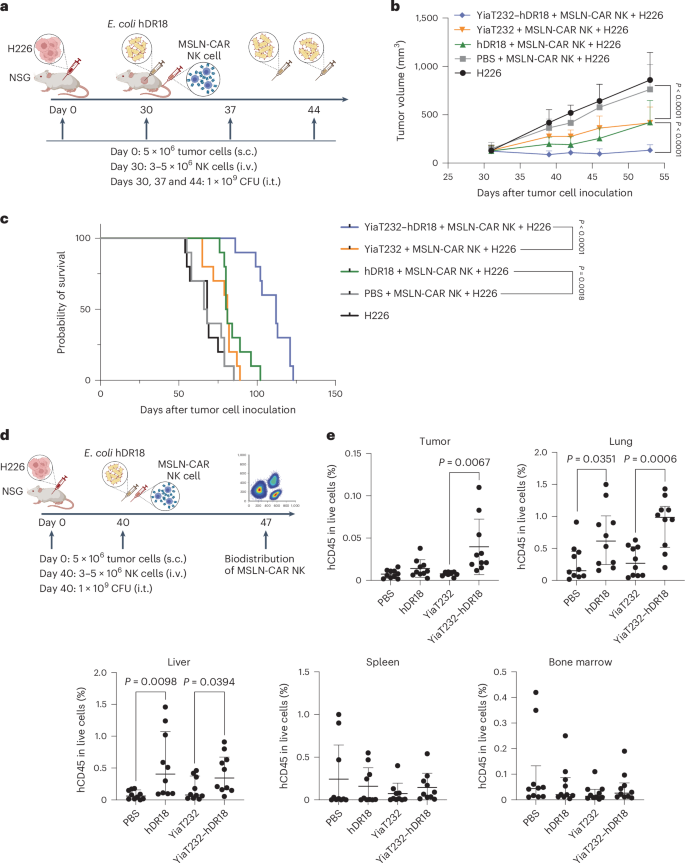
图5 工程化大肠杆菌携带hDR18在体内增强MSLN-CAR-NK细胞的增殖、肿瘤归巢和疗效
研究中,将H226肿瘤细胞植入NSG小鼠,随后通过尾静脉注射MSLN-CAR-NK细胞,并以不同方式处理小鼠:给予PBS、YiaT232、YiaT232-hDR18或纯化的hDR18。研究发现,与对照组相比,接受YiaT232-hDR18处理的小鼠在肿瘤生长和存活方面表现出显著的改善,表明工程化细菌能够增强CAR-NK细胞的肿瘤归巢和杀伤能力。此外,通过流式细胞仪分析,YiaT232-hDR18处理的小鼠在肿瘤、肝脏、肺脏、脾脏和骨髓中的人类CD45+细胞比例增加,表明工程化细菌促进了CAR-NK细胞在这些器官中的积累。
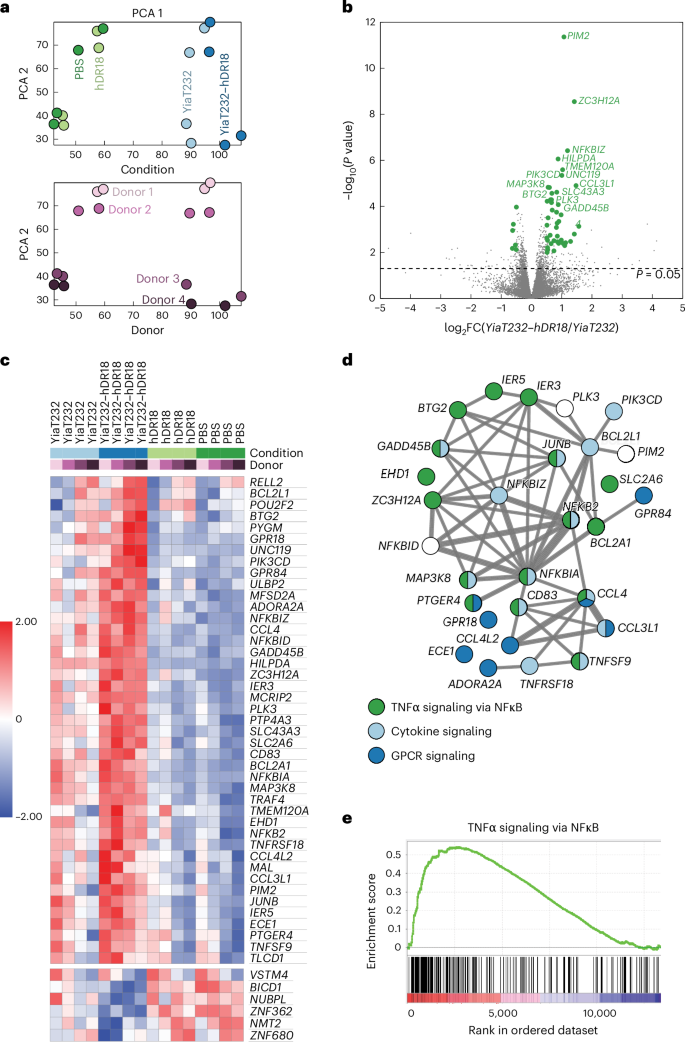
图6 RNA测序分析揭示MSLN-CAR-NK细胞在与YiaT232-hDR18大肠杆菌共培养后基因表达的变化
研究发现,与PBS对照组相比,YiaT232-hDR18处理的NK细胞在基因表达上出现了显著差异,其中多个与肿瘤坏死因子α(TNFα)信号通过核因子κB(NFκB)途径相关的基因表达上调。这一发现表明,工程化大肠杆菌通过激活TNFα/NFκB信号通路,增强了NK细胞的活性。此外,基因集富集分析(GSEA)也确认了TNFα信号通路的显著富集,进一步证实了该通路在NK细胞激活中的关键作用。
【全文总结】
本研究成功开发了一种新型癌症免疫疗法,通过工程化非致病性大肠杆菌携带抗诱饵IL18突变体(DR18),有效激活了抗肿瘤免疫反应。在动物模型中,该疗法显著增强了CD8+ T细胞和NK细胞的活性,抑制了肿瘤生长,并在多种肿瘤模型中展现了强大的抗肿瘤效果。此外,该方法还增强了嵌合抗原受体自然杀伤(CAR-NK)细胞的肿瘤归巢和杀伤能力,为治疗抵抗性肿瘤提供了新策略。研究结果表明,这种基于细菌的免疫疗法不仅安全有效,而且能够诱导免疫记忆,为癌症患者提供了一种潜在的新治疗选择。
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#大肠杆菌# #癌症治疗# #IL18#
105