Trends Cancer:以肠道微生物群为靶点治疗癌症患者免疫治疗引起的结肠炎
2021-03-23 MedSci原创 MedSci原创
促进丁酸的益生元是预防ICI所致结肠炎的一种很有前途的新方法,甚至有可能通过增加对治疗的耐受性和促进有益于治疗的微生物种类的扩大来提高ICI治疗的疗效。
免疫检查点抑制剂(ICIs)是过去十年癌症治疗中的一个变革性进展。然而,ICIS可产生免疫相关不良反应(irAEs),可导致发病率和过早终止治疗。最近的研究表明,肠道微生物区系及其代谢产物影响ICI的疗效和毒性。Amy E. Chang在Trens in Cancer发表综述,回顾了ICI诱导的结肠炎的相关证据。尤其是短链脂肪酸丁酸盐,这是一种微生物代谢物,对肠道有保护作用,讨论了饮食益生菌的使用(可由细菌代谢产生丁酸盐)如何成为预防ICI相关性结肠炎并改善患者预后的一种有趣的新研究方法。

ICIs通过去除抑制性T细胞信号,使平衡向T细胞激活倾斜,从而引发对癌细胞的破坏。目前临床上使用的ICIS通过阻断细胞毒性T淋巴细胞相关抗原(CTLA)-4、程序性细胞死亡蛋白(PD)-1或其配体(PD-L1)来实现这一点。在某些情况下,ICIS可以在预后不佳的患者中产生戏剧性和持续性的抗肿瘤反应,使这些药物成为肿瘤学的一个令人兴奋的进步。
ICIs现在被广泛用于多种癌症的治疗,包括黑色素瘤和肺癌、肾癌、膀胱癌、乳腺癌和头颈癌。美国符合FDA批准的ICI治疗适应症之一的患者的估计百分比从2011年的1.5%增加到2018年的43.6%。更多的临床试验正在进行中,ICIS的应用有望进一步扩大。
尽管ICI治疗在改善许多癌症类型的无进展存活率和总存活率方面取得了可喜的结果,但仍然存在挑战,包括相对较低的总体应答率和免疫相关的不良反应(IrAEs)。缺血性脑损伤(IrAEs)是ICI治疗后自身免疫导致的器官损伤,降低了T细胞的抑制性信号。IrAEs可累及任何器官,但最常见的是引起皮肤(如皮疹)、胃肠道(如腹泻、肝炎和结肠炎)和内分泌系统(如甲状腺功能减退)的症状。ICI的频率和主要的irAEs随ICI类型的不同而不同。例如,抗CLTA-4治疗有更高的腹泻发生率(单独使用抗CTLA-4的比例为31.8%,单独使用抗PD-1的比例为10.5%),而使用抗PD-1的患者有更高的肺炎发病率(单独使用抗PD-1的比例为2.6%,单独使用抗CTLA-4的比例为0.3%)。双重ICI治疗(最常见的是抗CTLA-4和抗PD-1的组合,例如ipilimumab和nivolumab)比任何单药ICI治疗更容易出现irAEs。一项对73项临床研究的荟萃分析显示,双ICI治疗的腹泻(30-43%)和结肠炎(12-14%)的发病率很高。
越来越多的证据表明,肠道微生物区系对于ICI治疗的有效抗肿瘤反应是必不可少的,并且肠道微生物区系可能影响irAEs的发展。因此,肠道微生物群是改善ICI疗效和减轻irAEs的潜在靶点。微生物群的复杂性和充分阐明微生物群影响ICI疗效和毒性的机制是一个持续不断的挑战。
肠道微生物群产生数百种代谢物。短链脂肪酸(SCFA)丁酸盐是由肠道微生物产生的,据报道具有抗炎特性。丁酸为基础的治疗在其他肠道炎症性疾病中显示出良好的疗效。该文章回顾了ICIs,irAEs,微生物-代谢物轴(重点是丁酸),并讨论了丁酸增加益生菌作为预防ICI诱导的结肠炎的简单干预措施的潜力。
肠道微生物与ICI效率和毒性的关系
来自临床前模型和临床观察的肠道微生物群与ICI疗效和毒性数据之间的联系表明,微生物区系在抗肿瘤反应和调节irAEs的发展中都是重要的。就ICI疗效而言,在无菌小鼠中,抗CTLA-4抗体治疗的抗肿瘤作用被消除,而在临床前小鼠模型中,使用抗生素扰乱肠道微生物群降低了ICI疗效。引入益生菌,如双歧杆菌和类杆菌,在小鼠实验中恢复了抗PD-L1和CTLA-4抗体疗法的治疗效果。另一种改变微生物群的方法,粪便微生物区系移植(FMT),一项研究中显示在10名黑色素瘤患者中有3名有望增强抗PD-1的治疗反应,这些患者的疾病在先前的ICI治疗中取得了进展。
然而,FMT有重要的局限性,包括影响是供者特有的,以及造成这种影响的移植微生物群的属性尚不清楚,这可能会限制该方法的重复性和可扩展性。肠道微生物群和ICI效应之间联系的更多证据来自多项回顾性临床研究,这些研究发现抗生素的使用是ICI反应差和总体存活率较差的预测因子。
在小鼠模型和人类研究中,肠道微生物群也可以影响irAEs的发展。肠道微生物群改变与ICI诱导的结肠炎之间的联系并不令人惊讶,因为微生物群失调在其他情况下也与结肠炎有关,包括炎症性肠病(IBD)和移植物抗宿主病(GVHD)。
肠道微生物代谢物作为ICI治疗效果和毒性的潜在调节剂
肠道微生物群调节接受ICIS患者的宿主免疫系统的具体机制尚未完全阐明。不同的报告表明多种不同种类的细菌与ICI效应相关。对于ICI相关性结肠炎,不同的研究同样涉及不同的细菌种群。虽然这些差异的基础尚未解决,但一个吸引人的假设是,这代表着功能冗余,在这种情况下,多个细菌物种可以执行相同的特定功能,从而增强ICI疗法的疗效或降低对irAEs的易感性。微生物群可能影响ICI疗效或irAEs发生的一个潜在机制是通过微生物产生的代谢物。基于这一概念,共同代谢物的产生可能是不同种类的细菌产生相同表型的原因,例如在ICI诱导的结肠炎中改变肠道炎症水平。
丁酸盐是一种抗炎代谢产物,可治疗ICI-结肠炎
肠道微生物产生的多种代谢产物可以影响宿主细胞的功能。丁酸盐是抗炎性能最好的SCFA,可能是胃肠道炎症和潜在的ICI诱导的结肠炎的关键影响因素。丁酸盐可以减轻肠道炎症的多种机制已经建立。一个可能的机制是通过激活过氧化物酶体增殖物激活受体-γ,它是氧化呼吸的重要调节因子和促炎NF-κB信号的负调节因子,从而减轻局部肠上皮炎症。与抑制炎性细胞因子的产生一致,丁酸盐可以降低血浆和结肠粘膜中的IL-17,并以依赖于G蛋白偶联受体Gpr109a的方式诱导树突状细胞、树突状细胞(DC)和巨噬细胞产生IL-10。丁酸盐抑制组蛋白去乙酰化酶(HDAC)的能力也可能通过促进结肠调节性T细胞分化来预防结肠炎。除了对免疫系统的影响外,丁酸盐还可以直接支持上皮细胞对炎性损伤的抵抗力,作为结肠细胞的基本能源,通过刺激结肠上皮细胞的增殖,增强上皮屏障功能,以及有利地调节结肠上皮中促凋亡和抗凋亡基因的表达。微生物产生的丁酸盐的丢失可能是ICI结肠炎的原因之一。有研究发现从元基因组测序中获得的更多的丁酸生产途径与irAE率的降低和ICI反应的改善显著相关,支持丁酸作为微生物操纵优化ICI治疗的潜在靶点。
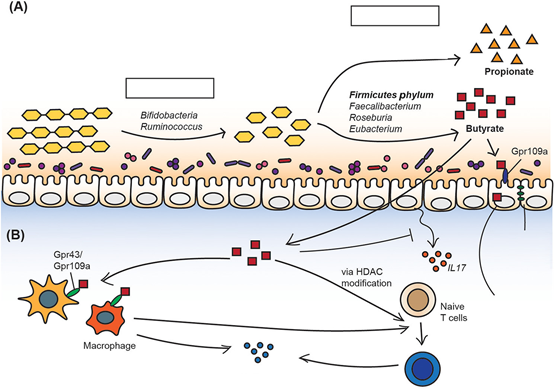
抗性淀粉(益生菌)对丁酸的代谢及其对结肠的已知影响
(A)由于对宿主淀粉酶的抵抗,抗性淀粉被输送到结肠,而没有在近端肠道中被消化。它被1°降解物分解成中间代谢物,再由2°发酵罐在结肠中发酵成小分子代谢物。 (B)丁酸盐在肠道的多重抗炎作用。缩写:AMPK,AMP激活的蛋白激酶;IL,白介素;HDAC,组蛋白去乙酰化酶;PPAR,过氧化物酶体增殖物激活受体。
丁酸盐作为一种治疗方法:来自其他肠道炎症性疾病的启示
ICI诱导的结肠炎是一个异质且不完全了解的疾病过程,具有IBD和GVHD的共同特征。例如,持续性≥-2级腹泻的脑梗死患者的肠道活检显示出IBD和肠道移植物抗宿主病的组织学特征。考虑到抑制性T细胞信号的广泛去除可能会造成一个失调的炎症环境,重述GVHD和IBD的组成部分,这些混合的组织学特征是可以预料的。一些研究已经检验了丁酸盐作为一种治疗炎症性肠病的方法。丁酸盐还在临床前小鼠模型中保护了肠道完整性并减轻了移植物抗宿主病。丁酸盐灌肠也有利于放射性直肠炎的治疗。
益生元:一种简单而有效的微生物组操作方法
有多种可用策略来调节微生物区系及其副产品。FMT是最不精确的干预措施,整个细菌群落从捐赠者移植到接受者。在一个小病例系列中,FMT成功地解决了难治性ICI结肠炎。FMT可以在不鉴定特定微生物或副产物的情况下进行,但在不了解驱动表型的生物学因素的情况下,确定理想的供体是具有挑战性的。此外,尽管FMT一般耐受性良好,但它们存在转移耐多药病原体的风险,并可能导致肠道微生物群的持久变化,带来不确定的长期临床后果。
第二种方法是管理益生菌,这是一种定义为特定有益菌株的合成群落。然而,在肠道生态系统中成功地运送和维持这些物种可能是具有挑战性的。此外,可能会发生意想不到的负面影响,因为据报道,在ICI之前服用益生菌的患者具有较低的微生物区系α多样性,这一发现与微生物群健康状况下降和对ICI的反应减弱广泛相关。
如果目标是增加特定的微生物代谢物,另一种方法是直接给予代谢物,就像IBD患者的丁酸盐灌肠或口服丁酸盐补充剂一样。这些方法有很大的局限性,包括由于上消化道的吸收,丁酸盐不完全暴露于整个带有灌肠的胃肠道,以及需要频繁给药,缺乏可靠的处方来将口服丁酸盐输送到人类的远端结肠。
规避上述许多挑战的另一种方法是使用益生素,这是一种营养或食物,可以选择性地诱导特定微生物的生长和活动,然后产生所需的代谢物。这种方法有多种优点,包括易于给药,良好的安全性,低成本,以及通过诱导驻留的微生物群产生丁酸盐来实现更均匀、更持久的丁酸盐水平的潜力。在一项针对IBD患者的小型对照先导研究中,使用燕麦麸作为膳食益生素可以增加粪便丁酸盐,并导致症状控制与对照组相比有所改善,没有明显的不良反应,这表明基于益生菌的丁酸调节可能能够减少结肠炎症[16]。一种已被研究用于微生物组操作的益生元是抗性淀粉(RS),这是一种能抵抗宿主淀粉酶消化的膳食淀粉分子。RS被双歧杆菌和瘤胃球菌等初级淀粉降解菌分解成单/低聚糖。这些初级淀粉降解菌产生的分解产物作为二级发酵菌(如Firmicutts和Bacteroidetes)的营养物质,这些二级发酵菌产生单链脂肪酸(SCFA),包括丁酸盐。反过来,这些单链脂肪酸为结肠上皮提供能量,并通过多种机制影响宿主生理。63名健康志愿者饮食中服用RS耐受性良好,粪便丁酸盐水平增加[62,63]。在没有控制受试者总体饮食的情况下,在研究人群中也观察到了这种效果,这表明这种方法可能是可行的,可以广泛应用。这些数据增加了RS可能是一种简单、安全和实用的方法来增加结肠中的丁酸水平,从而减轻ICI引起的结肠炎和腹泻。
丁酸益生菌预防ICI结肠炎:额外考虑
虽然丁酸盐在肠道中的抗炎功能是众所周知的,但其效果可能与疾病背景有关。在严重受损的上皮中,丁酸盐抑制结肠干细胞形成完整的上皮单层,这增加了丁酸盐可以阻止严重ICI结肠炎患者受损肠上皮愈合的可能性。因此,当测试乳酸菌益生素干预预防时,如果出现严重的ICI结肠炎,停止使用益生菌是很重要的。在某些情况下,肠道中产生的丁酸可能会进入血液循环,对全身产生影响。对接受ICI治疗的患者进行乳酸型益生菌干预试验时,评估微生物区系增加丁酸产量的局部(肠道)和全身影响将是重要的。
微生物群是一个复杂的生态系统,其中微生物之间的相互作用网络是决定肠道微生物群最终代谢产出的重要因素。因此,使用酪基益生元的全部效果可能很难预测,而且在不同个体之间也不尽相同。
ICIs已经改变了癌症治疗,但irAEs仍然是一个挑战。肠道菌群似乎不仅影响ICI治疗的疗效,而且影响腹泻和结肠炎的发展,这两种疾病是重要的、经常限制治疗的irAEs。丁酸盐在结肠中有抗炎作用,因此可能对ICI引起的结肠炎/腹泻有保护作用。使用促进丁酸的益生元是预防ICI所致结肠炎的一种很有前途的新方法,甚至有可能通过增加对治疗的耐受性和促进有益于治疗的微生物种类的扩大来提高ICI治疗的疗效。
在临床试验的背景下,有许多关于实施这种益生菌方法预防ICI诱导的结肠炎的悬而未决的问题和考虑(参见突出问题)。这些因素包括微生物群改变的最佳制剂的选择、时间、剂量、持久性,以及患者的饮食习惯和本地肠道微生物区系群的影响。这种干预可能使免疫稳态转向耐受性,或增加血浆丁酸水平,这表明还需要仔细评估对ICI治疗效果的影响。此外,用益生菌剂操纵肠道微生物群可能会导致微生物群的额外变化,而不仅仅是增加丁酸盐的产量。因此,在精心设计的前瞻性临床试验中,全面评估肠道微生物群、局部和全身效应的变化及其临床意义将是至关重要的。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













丁酸盐还在临床前小鼠模型中保护了肠道完整性并减轻了移植物抗宿主病。丁酸盐灌肠也有利于放射性直肠炎的治疗。
137
#微生物#
91
#trend#
85
#ENDS#
146
#癌症患者#
142
#肠道微生物群#
110
#微生物群#
128
肠道微生物群为靶点治疗免疫引起的结肠炎
145