病理干货 | 浅谈HPV E6/E7检测
3小时前 上海阿克曼病理 上海阿克曼病理 发表于陕西省
本文介绍 HPV 与宫颈癌关系、感染致癌机制、E6/E7 阳性含义、检测方法及适用人群(如早期筛查、HPV DNA 阳性等分流患者、宫颈切除术后随访患者),强调其在宫颈癌防控中的意义。
1983年,德国科学家豪森研究发现99.8%的宫颈癌患者中可以检测到不同型别的HPV DNA,而HPV阴性者几乎不会发生宫颈癌。HPV是“人乳头瘤病毒”的简称,是一种目前已知的、较小的DNA病毒,人体皮肤及黏膜的复层鳞状上皮是它的宿主。HPV家族非常庞大,目前有200多种不同的HPV,主要分为低危型和高危型。低危型HPV感染主要包括HPV6、11、40、42、43、44、61、72、81等,会引起生殖器官表面出现肉质生长物,被称为“疣”,或者由感染造成炎症。高危型HPV感染主要包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68、73型。最常见的感染类型为HPV16和18,进展为高度宫颈病变的风险都远远高于其它HPV型别阳性,占全部宫颈癌的55-60%[1]。
HPV感染是宫颈癌发生的必要条件但不是必然结果。HPV感染多为一过性,主要通过性生活或密切接触传播,80%以上的女性一生中至少有过一次HPV感染,90%以上的HPV感染可在2年内自然清除,约1%的患者发展至子宫颈癌前病变和子宫颈癌。作为全球唯一致病因素确切的癌症,通过早期筛查和有效治疗,该病是可预防、可治愈的。近日,国家卫健委发布“关于印发加速消除宫颈癌行动计划(2023年-2030年)的通知”,再次强调宫颈癌早筛查、早诊断、早治疗。目前,宫颈癌筛查按“三阶梯筛查”标准诊疗程序:细胞学+HPV初筛,阴道镜助诊和组织学确诊[2]。其中HPV检测只是病因检测,HPV DNA 存在不一定会导致细胞发生癌变,并不能反映病毒感染后的活跃状态,无法对宫颈病变的进展进行风险评估,只有当病毒持续大量转录E6、E7mRNA,从而大量表达E6、E7癌蛋白,才会导致细胞发生癌变。因此HPV检测从DNA进入E6、E7mRNA的时代,为宫颈癌的精准筛查更近了一步[3]。
01 HPV感染致癌机制
HPV感染宿主细胞后,按照生物中心法则,其病毒致癌基因E6、E7通过转录产生E6、E7mRNA,再通过翻译产生E6、E7癌蛋白[4]。E6和E7两种癌蛋白分别与宿主细胞的抑癌蛋白如p53和PRB等细胞内相关蛋白结合,从而干扰细胞周期、凋亡和染色体的稳定性,最终导致细胞的永生化,发生癌变。由此可见,HPV E6/E7是HPV病毒致癌活动提示指标和宫颈上皮细胞癌变进展预测指标,其表达提示HPV整合入宿主细胞DNA中,癌基因转录失控导致E6、E7癌蛋白过表达,进而启动细胞恶性转化,预示HPV癌基因E6/E7处于表达活动期,促进宫颈上皮细胞癌变进展[5]。
02 E6/E7阳性就一定会癌变吗?
HPV E6/E7基因阳性,表示在人体内检测到这两个基因的mRNA,并不代表一定会癌变,但能说明HPV感染已经比较久了,部分病毒开始整合表达致癌蛋白(如下图1所示),这个时候通常宫颈会出现一定程度的瘤变或者表示进入宫颈高级别病变的机会较大。此时,需要进一步检查如组织病理学等来明确是否有宫颈病变。因此,发现 E6/E7阳性不要过度紧张,及时完善相关检查,在医生指导下积极治疗即可[6]。
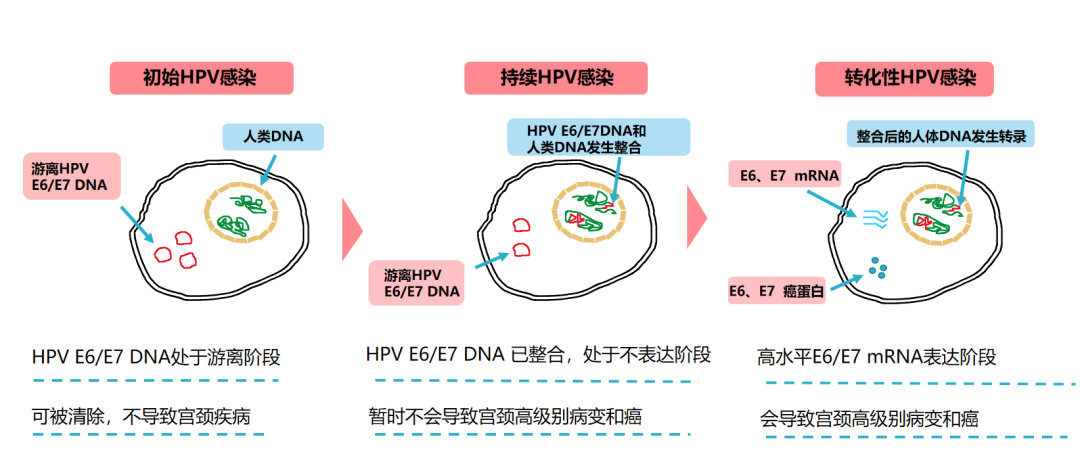
▲图1:HPVE6/E7感染的三个阶段
03 E6/E7检测怎么做?
E6/E7的检测与HPV的检测取样方法一致,由医生使用专用取样器对受检者宫颈分泌物取样,一般先用一次性窥阴器充分暴露宫颈或阴道残端,再用专用采集刷于宫颈口或阴道顶端顺时针3-5圈取得患者脱落细胞,取样后将采集刷放进专用脱落细胞保存瓶固定保存,送检。在实验室里完成样本处理,核酸扩增,再进行结果判读。
一般情况下,E6/E7的检测结果可以与HPV的检测结果对比来解读,如果HPV呈阳性,而E6/E7显示阴性,表示病毒暂时不活跃,未发生病毒的复制与转录。临床的处理方式可结合细胞学检查,一年后复查,仍阴性可3-5年复查。如果14种高危型HPV中16/18/45型呈阳性,可直接干预,若14种高危型HPV中除16/18/45型之外的亚型阳性,结合细胞学检查决定下一步检查[7]。
04 E6/E7检测适用于哪类人群?
1 早期筛查患者
在宫颈癌预防和治疗的过程中,需要对疾病发生及发展的过程进行全面了解。而疾病在发展过程中所必须经历的一个步骤是E6/E7 mRNA的转录,所以经过对HPV E6/E7 mRNA进行测定,对于宫颈癌早期病变的筛查具有非常重要意义。目前一般采取E6/E7与TCT(液基薄层细胞学)联合筛查的方式,蒙静[8]研究结果显示,所有研究对象经过病理学检查结果证实,阳性179例,阴性21例,所占比例分别为89.50%、10.50%。TCT组检测阳性160例,占比达到80.00%,E6/E7组检测阳性168例,占比达到 84.00%,E6/E7联合TCT组检测阳性177例,占比达到88.50%,其检查的阴性预测值、准确率、敏感性均高于TCT组和E6/E7组,差异有统计学意义(P<0.05)(如下表1所示)。
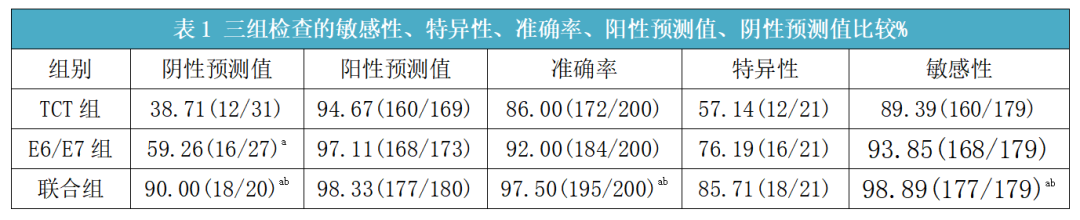
注:与TCT组比较,aP<0.05,与E6/E7组比较,bP<0.05
2 HPV DNA阳性分流患者
目前,我国女性每年新发宫颈癌疾病病例约占世界发病率的33%。故及时予以相关检测,防控宫颈疾病的发生,是提高女性健康的有效措施。然而随着 HPV DNA 在一线筛查中的应用,其不足之处也显现出来,即尽管HPV感染是导致宫颈上皮内瘤变和宫颈癌的主要病因,但由于大多数HPV感染只是一过性感染,6-24个月内无需任何临床处理即可转归,所以HPV感染经常是无害的。即使存在了感染,HPV DNA检测并不能反映病毒感染后的活跃状态,不能明确宫颈病变的严重性,无法对宫颈病变的进展进行风险评估。因此,在一线筛查的基础上对可疑或低度病变及HPV DNA 阳性患者进行E6/E7检测,在关注高级别病变和癌症转变风险同时,能将一过性HPV感染以及更多无进展的病变重新归入常规的筛查管理中,减少对疾病严重程度的误判,避免不必要的检查和治疗,减轻给患者带来的经济和心里压力,具有良好的临床指导意义[9]。
3 ASC-US分流患者
ASCUS(未明确诊断意义的非典型鳞状上皮细胞)患者的细胞学特征虽存在鳞状上皮的异常,但诊断为上皮内病变的证据不足,因此,其组织病理学的差异很大。目前主要是根据HPV DNA的结果进行ASCUS患者的分流,由于HPV DNA存在假阳性率高及特异性低等问题,使得该类患者的阴道镜转诊率及活检率居高不下,造成了过度治疗,增加了患者的经济和心理负担。白萍[10]等研究显示,各级别宫颈病变患者的HPV E6/E7 mRNA的拷贝值经Spearman秩相关分析,发现随着宫颈病变级别的进展,HPV E6/E7 mRNA的阳性率及拷贝值与之呈正相关,且各病变级别差异有统计学意义(如下表2所示)。
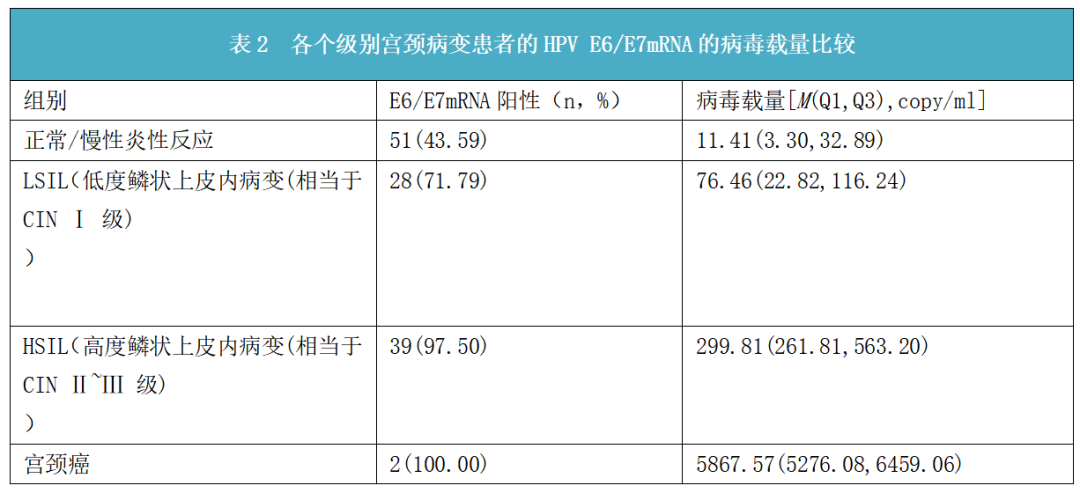
由上可见,ASCUS患者的HPV E6/E7 mRNA的表达水平会随宫颈病变的级别升高而升高,能有效预测疾病进展的风险。对于ASCUS患者,可以根据其HPV E6/E7mRNA 的结果进行可能发生的病变的初步评估,并根据其评估结果考虑是否行阴道镜检查,HPV E6/E7 mRNA 可作为一种新的方法进行ASCUS患者的分流,对于ASCUS 患者HPV E6/E7 mRNA结果为阴性的女性,无需进行进一步的阴道镜检查,做好随访工作,减少过度诊疗及漏诊、误诊率,控制患者的疾病进展,指导临床工作。
4 宫颈切除术后随访患者
高危型HPV感染是导致宫颈癌发生的重要条件。CIN(宫颈上皮内瘤样病变)与宫颈癌的发生和发展密切相关,在行宫颈病变手术治疗后(如子宫颈环形电切除术、冷刀锥切术)的患者中存在病变持续、病灶复发以及进展的风险,故而对宫颈病变手术治疗后患者的定期随访,可以早期发现宫颈病变复发状态,及时了解病变的发生风险。研究显示,CIN手术治疗后,存在病变残留或复发风险的比例为5%~25%。影响CIN术后残留或病灶复发的主要因素包括高危型HPV阳性、切缘阳性、患者年龄、机体免疫状态、多象限受累等[11]。
国内临床宫颈术后随访方法采用TCT及HPV DNA检测等,而术后过高的HPV DNA阳性率给患者带来心理焦虑。朱大华[12]等报道HPV E6/E7 mRNA检测联合TCT对于预测宫颈CIN3+及宫颈癌手术治疗后复发或病灶残留的特异度和阳性预测值均较高,综合诊断性能更佳,更具有临床价值,故临床上可使用联合筛查用于评估宫颈高级别病变手术治疗的预后,发挥HPV E6/E7mRNA检测的临床特异性,早期发现真正有病变风险的患者,同时避免不必要的过度诊疗,减轻患者的焦虑和压力。
*本文(包括图片)仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1]:李巍巍.HPV 检测应用于早期宫颈癌筛查中的意义[J].中国实用医药,2018,13(4):51-52.
[2]:卿清.宫颈癌筛查策略的研究进展[J].昆明医科大学学报,2020,41(6):162-166.
[3]:蒋欣.高危HPVE6/E7mRNA 与 HPV DNA检测对宫颈病变诊断及风险评估的价值[J].广东医学,2018,39:132-136.
[4]:Molden T,et al.Predicting CINII+ when detecting HPV mRNA and DNA by PreTect HPV-proofer and consensus PCR:A 2-year follow-up of women with ASCUS or LSIL Pap smear[J]. Int J Cancer,2005,114(6):973-976.
[5]:Sorbye SW,et al.Triage of women with low-grade cervical lesions--HPV mRNA testing versus repeat cytology[J]. PLoS One,2011,6(8):24083.
[6]:邱玉荣.宫颈癌基因 E6E7 与 HPV 检测宫颈病变的效果观察[J].Healthmust-Readmagazine,2019,10:277.
[7]:涂琴.不同取样方式HPV分型、定量检测的效果对比[J].现代妇产科进展,2021,4:855-858.
[8]:蒙静.宫颈癌早期筛查与诊断中HPV E6/E7 mRNA的作用[J].实用妇科内分泌电子杂志,2023,10(5):37-39.
[9]:Benevolo M,et al.Sensitivity, specificity, and clinical value of human papillomavirus (HPV)E6E7 mRNA assay as a triage test for cervical cytology and HPV DNA test[J].J Clin Microbiol,2011,49(7):2643-2650.
[10]:白萍,李巧云.HPV E6/E7 mRNA及病毒载量检测对ASCUS 患者分层及疾病进展的预测价值[J].中国现代医生,2022,60(26):37-41.
[11]:Moberg M, et al. High viral loads of human papillomacirus predict risk of invasive cervical carcinoma[J].Br J Cancer, 2005, 92(5): 891-894.
[12]:朱大华.HPV DNA 检测、HPV E6/E7 mRNA 检测和 液基薄层细胞学检查对宫颈切除术后病 灶残留或复发的预测价值[J].发育医学电子杂志,2022,10(3):203-208.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#HPV# #宫颈癌#
0