读书报告 | 移码突变在泛癌真实世界中的景观及其在低突变负荷的肿瘤中预测免疫检查点抑制剂治疗反应的作用
2023-12-17 iCombo iCombo 发表于上海
临床队列为接受帕博利珠单抗单药治疗的转移性实体瘤患者212例,对其无进展生存期、总生存期和客观缓解率进行研究。
导读
近年来,免疫检查点抑制剂改变了许多实体和血液恶性疾病的治疗情况,但仍有许多患者不能从中获得临床益处,因此需要生物标志物对适用人群进行判断。移码突变已被证明能增强免疫原性,且对免疫检查点抑制剂的反应在不同的癌症组织中差异很大,该研究描述了移码突变的景观,并评估了它们在临床队列患者中作为免疫检查点抑制剂预测生物标志物的作用。
临床队列为接受帕博利珠单抗单药治疗的转移性实体瘤患者212例,对其无进展生存期、总生存期和客观缓解率进行研究。结果表明:与没有移码突变的肿瘤相比,携带移码突变的肿瘤患者(占所有患者27%)的客观缓解率更高,并且在低TMB组中携带移码突变的肿瘤患者中位无进展生存期与那些没有突变的相比有一定的改善。提示在TMB低于10mut/Mb患者中27%患者存在移码突变,他们可能对免疫检查点抑制剂治疗应答(J Immunother Cancer.2023 Aug;11(8):e007440.doi: 10.1136/jitc-2023-007440)。
Background
背景--免疫检查点抑制剂(ICIs)
免疫检查点(immune checkpoint):即一类可以调节免疫反应的强度和广度,从而避免正常组织的损伤和破坏的分子。
免疫检查点抑制剂(Immune checkpoint inhibitors):通过阻断免疫检查点来激活机体的抗肿瘤免疫反应。而ICI可解除T淋巴细胞的功能抑制,诱导肿瘤免疫反应,到达抑制肿瘤的作用。

本文所关注的ICIs:
PD-1抑制剂:nivolumab[纳武利尤单抗]和pembrolizumab[帕博利珠单抗]是两种针对PD-1的抑制剂,通过阻断PD-1与PD-L1的结合,恢复免疫细胞的活性,从而消除肿瘤细胞。这两种药物已经被批准用于多种癌症的治疗,如非小细胞肺癌、肾细胞癌、黑色素瘤等
PD-L1抑制剂:atezolizumab[阿替利珠单抗]是一种针对PD-L1的抑制剂,同样通过阻断PD-1/PD-L1通路来激活免疫细胞。它主要应用于治疗晚期非小细胞肺癌和尿路上皮癌
CTLA-4抑制剂:Ipilimumab[伊匹木单抗]是一种CTLA-4抑制剂,通过阻断CTLA-4与其配体(CD80/CD86)结合,增加T细胞激活和增殖,从而杀灭肿瘤。适应症包括黑色素瘤、肾细胞癌
背景--ICI反应的临床综合生物标志物
本文所关注的生物标志物包括:
错配修复缺陷(mismatch repair deficiency, dMMR)是在DNA复制过程中无法修复自发突变,导致肿瘤突变负荷水平高,并改变DNA微卫星序列或微卫星不稳定性(microsatellite instability, MSI),产生大量的移码突变。
高肿瘤突变负荷(a tumor mutational burden of 10 or more mutations per megabase, TMB-H),TMB数值可反映肿瘤内产生肿瘤新抗原的潜力,与DNA修复缺陷密切相关。
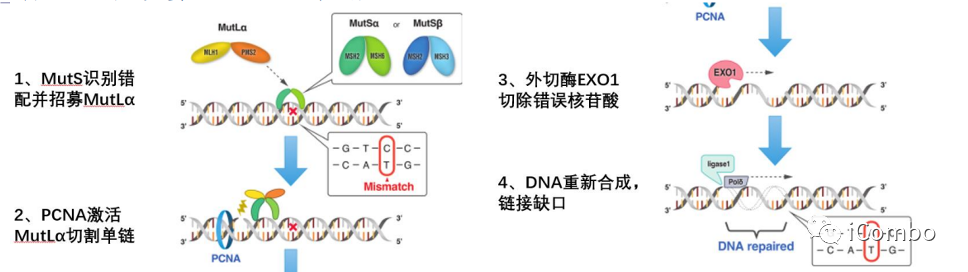
DNA错配修复系统(MMR)的工作机制
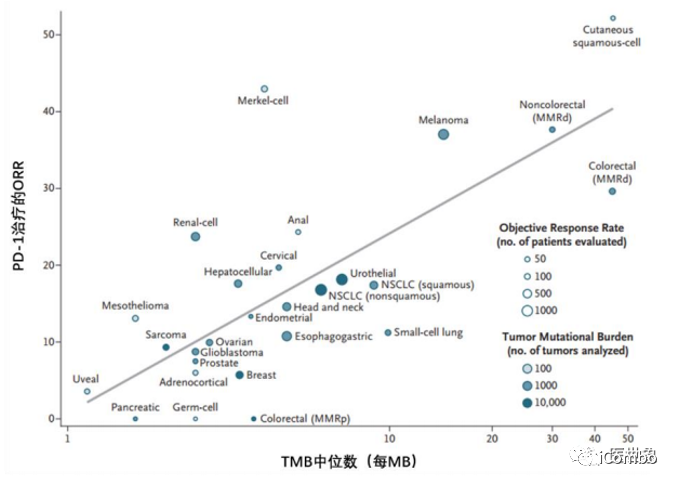
TMB对27种肿瘤的免疫治疗疗效有显著的预测作用
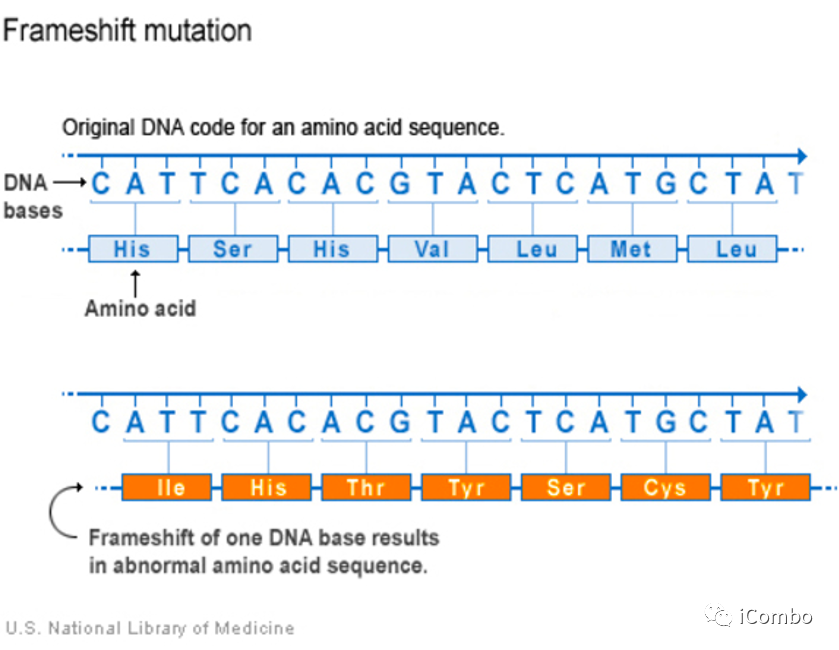
背景--移码突变(Frameshift Mutation, FS)
指DNA分子由于某位点碱基的缺失或插入,引起阅读框架变化,造成下游的一系列密码改变,使原来编码某种肽链的基因变成编码另一种完全不同的肽链序列。
背景--相关实验
Pembrolizumab是2017年FDA批准的首个针对所有MSI肿瘤的组织/部位不确定性药物,该研究基于5项临床试验(KEYNOTE-016(NCT01876511)、KEYNOTE-164(NCT02460198)、KEYNOTE-012(NCT01848834)、KEYNOTE-028(NCT02054806)和KEYNOTE-158(NCT02628067)),149例患者客观缓解率(ORR)为39.6%(95% CI 31.7%~47.9%), 78%的患者反应持续6个月及以上
2020年,FDA基于KEYNOTE-158多队列临床试验Pembrolizumab治疗TMB-H实体瘤组织。在本研究中805例患者中,13%的患者有tTMB-H状态,ORR为29%(95% CI 21%至39%),而TMB<10突变/兆碱基患者的ORR为6%(95% CI 5至8)
......
在KEYNOTE-158试验中,某些类型的癌症患者表现出明显较少的获益趋势。故在这项工作中,本文旨在探讨移码突变在增强TMB作为肺癌以外实体肿瘤中ICI的预测性生物标志物中的作用。
RESULTS
实验对象
实验对象:
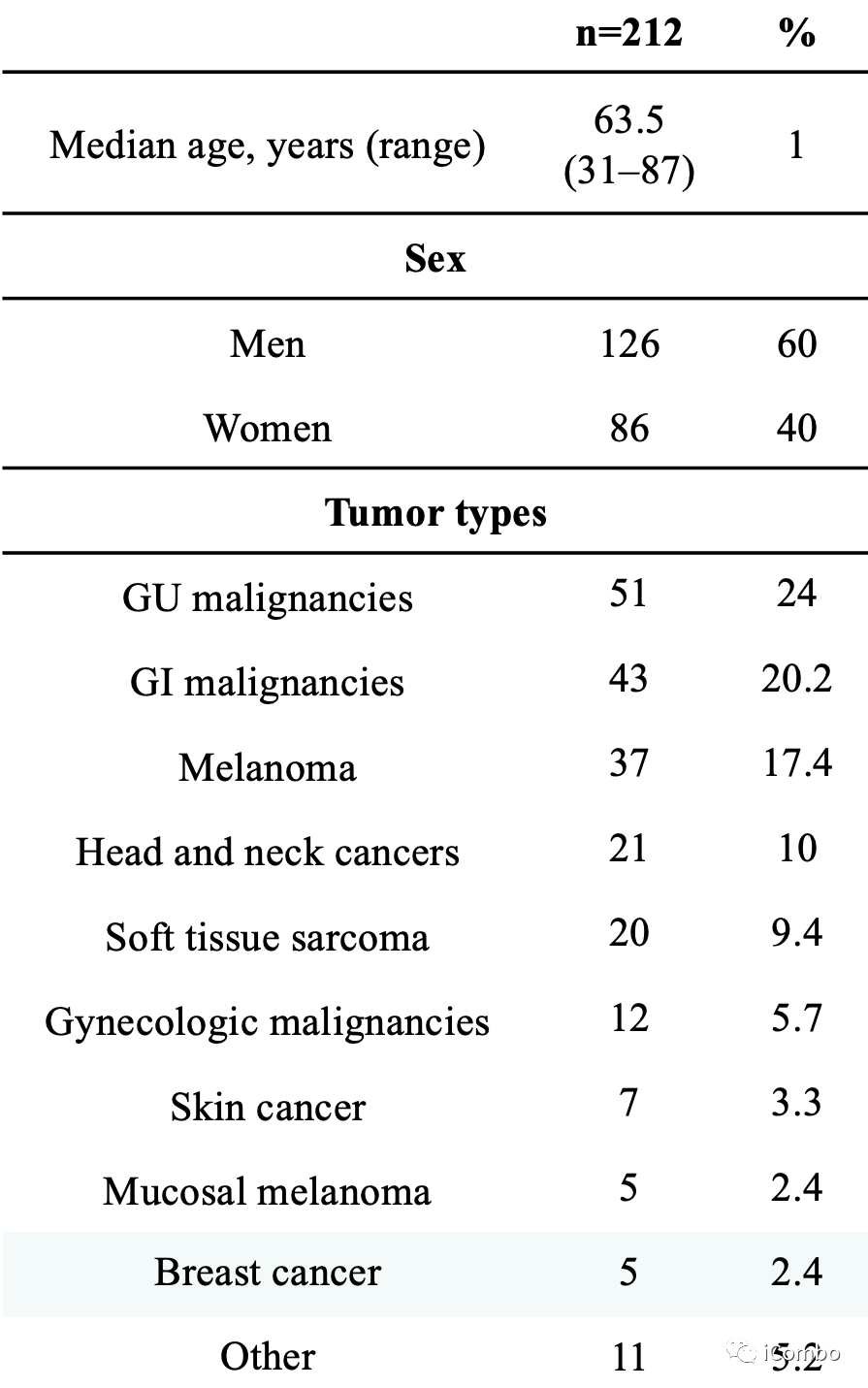
2个机构中212例被诊断为转移性实体瘤的患者,接受ICI作为单药治疗,并由供应商对肿瘤进行了基因组测序。患者的中位年龄为63.5岁(范围31-87岁),其中60%为男性。
肿瘤类型:
10种肿瘤类型,最常见的是泌尿生殖系统癌(n=51, 24%),其次是胃肠道恶性肿瘤(n=43, 20.2%)和黑色素瘤(n=37, 17.4%)。
既往治疗:
既往治疗的中位数为1(范围0-8),大多数患者接受ICI单药治疗。
在212例肿瘤中,196例为微卫星稳定(MSS)(92.5%)。
RW癌症分布:
为了确定TMB和FS在各种癌症中的分布,本文分析了RW基因组队列中所有实体瘤类型样本(N=250813)的基因组数据。大多数肿瘤是MSS(n=246252, 98.1%)和TMB-L(TMB<10mut/Mb)(n=209567, 83.1%)
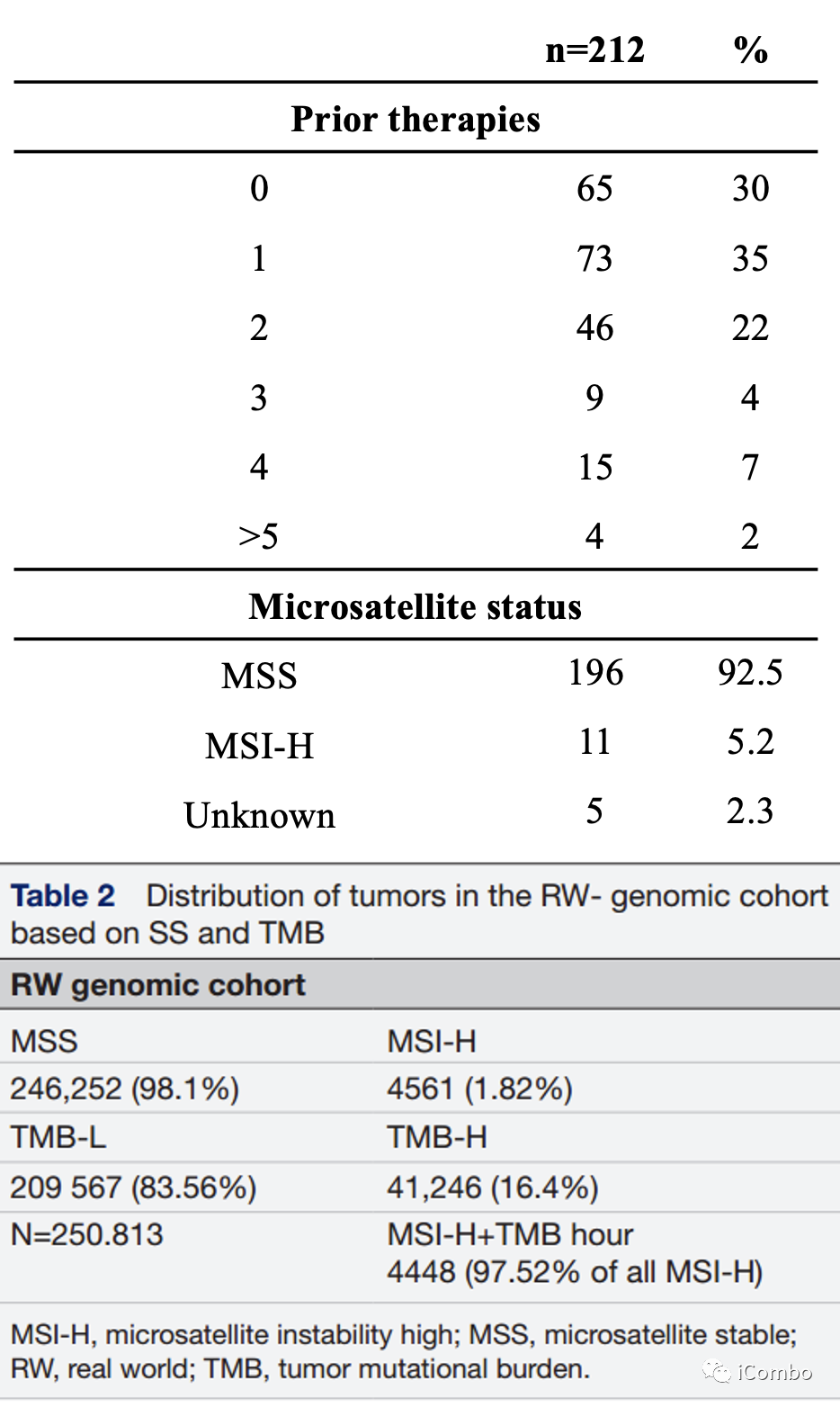
临床结果
根据肿瘤FS(FS-a:无移码,FS-p:有移码)和肿瘤TMB(TMB-h:TMB>=10个突变/Mb, TMB-l:TMB<10个突变/Mb)将212例临床患者分为四组:
-
TMB-L/FS-A(n=80, 38%)
-
TMB-L/FS-P(n=57, 27%)
-
TMB-H/FS-A(n=36, 17%)
-
TMB-H/FS-P(n=39, 18%)
-
中位PFS分别为3.6个月vs 5.1个月vs 11.6个月vs 12.0个月(p<0.01)
-
中位OS为13.3个月vs 11.9个月vs 30.3个月vs 24.5个月(p=0.057)
-
TMB-H和TMB-L患者中位PFS分别为10.6和3.6个月(HR 0.51 CI 0.36-0.73; p<0.001)
-
TMB-H和TMB-L的中位OS分别为30.2个月和12.2个月(HR 0.54 CI 0.35-0.84; p < 0.01)
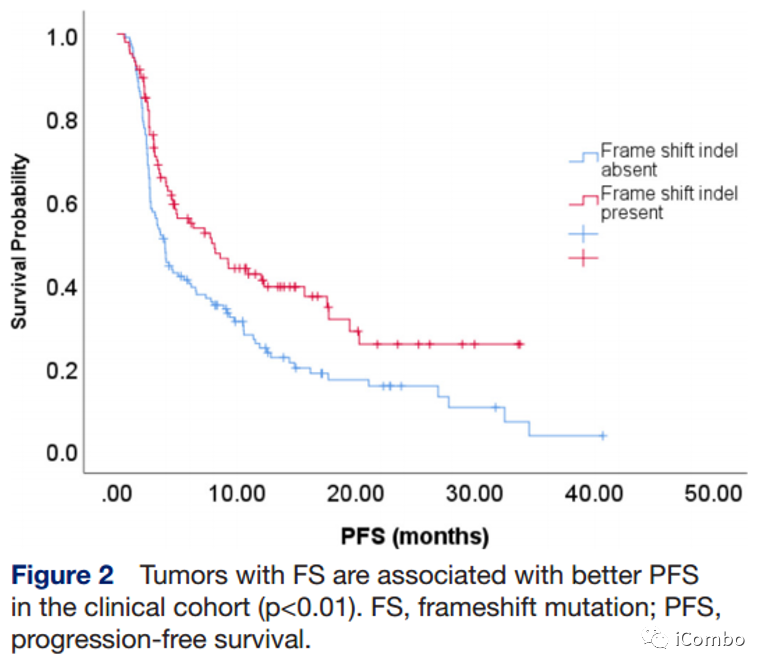
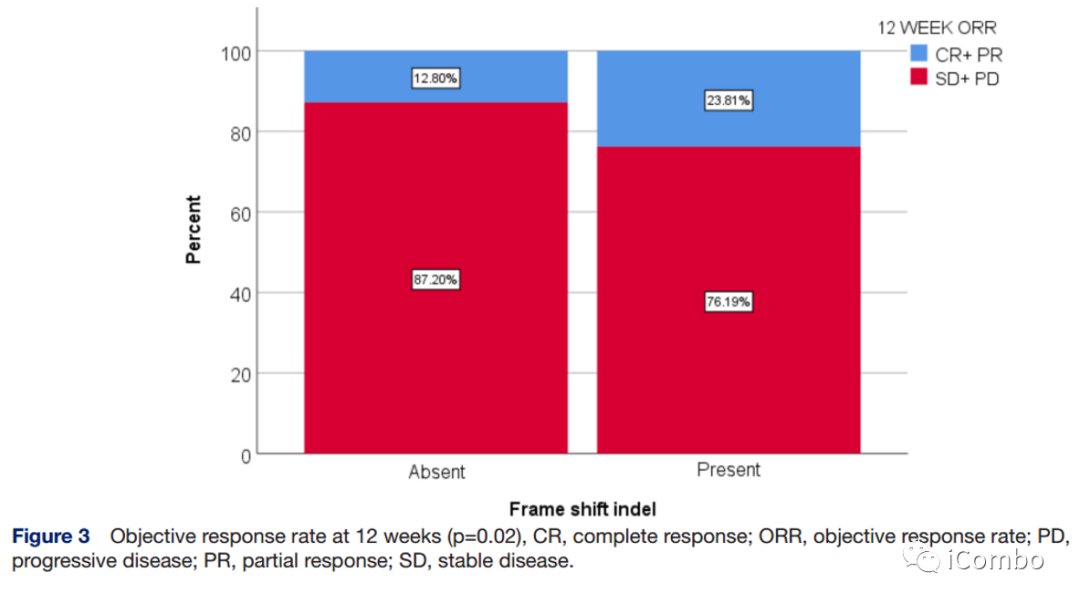
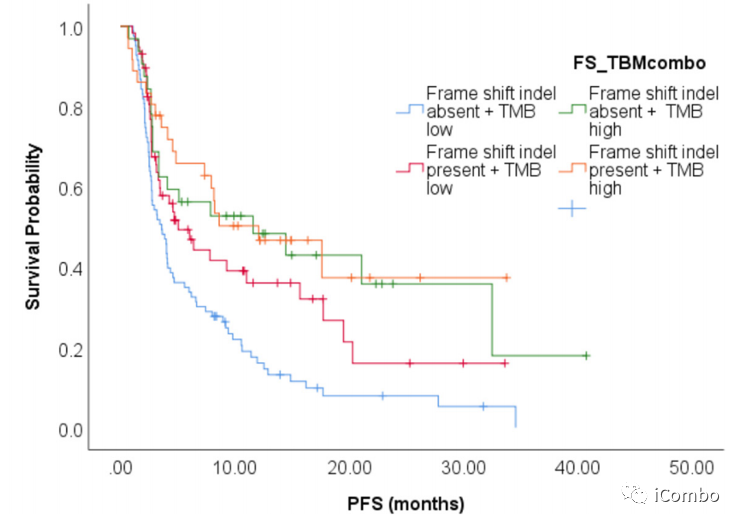
FS-A和FS-P的中位OS分别为20.4个月和14.4个月(HR 0.98, 95% CI 0.67~1.39; p>0.1),中位PFS分别为4.0个月 vs 7.9个月(HR 0.63, 95% CI 0.46~0.87, p=0.005)(左图);12周时FS-P组的ORR为23.8%,FS-A组为12.8%(p=0.02)(右图)。
研究前景
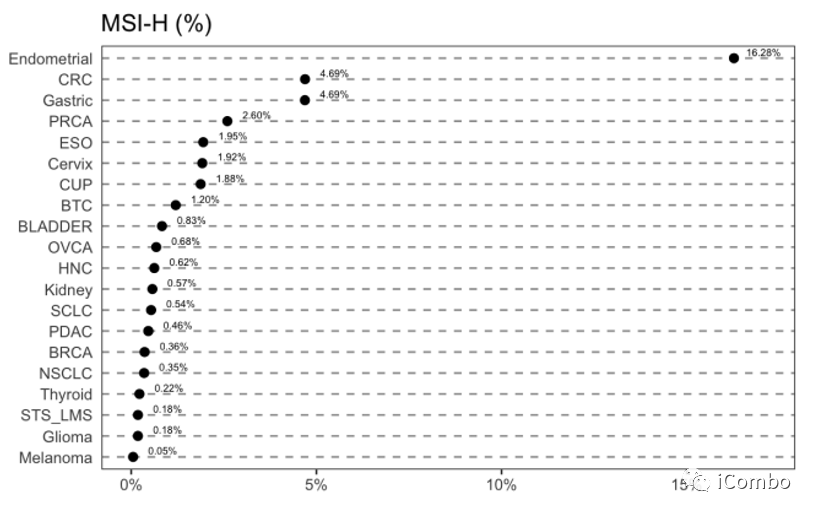
MSI的发生率仅为1.82%,而TMB-H的发生率是MSI的9倍(16.4%,n=41246)。几乎所有的MSI-H肿瘤都是TMB-H。MSI-H发病率最高的肿瘤类型是子宫内膜癌(16.28%),其次是胃癌(4.69%)、结直肠癌(4.69%)和前列腺癌(2.6%)。其余肿瘤类型为MSI-H肿瘤的病例不到2%。8044个黑色素瘤样本中只有4个是MSI-H。
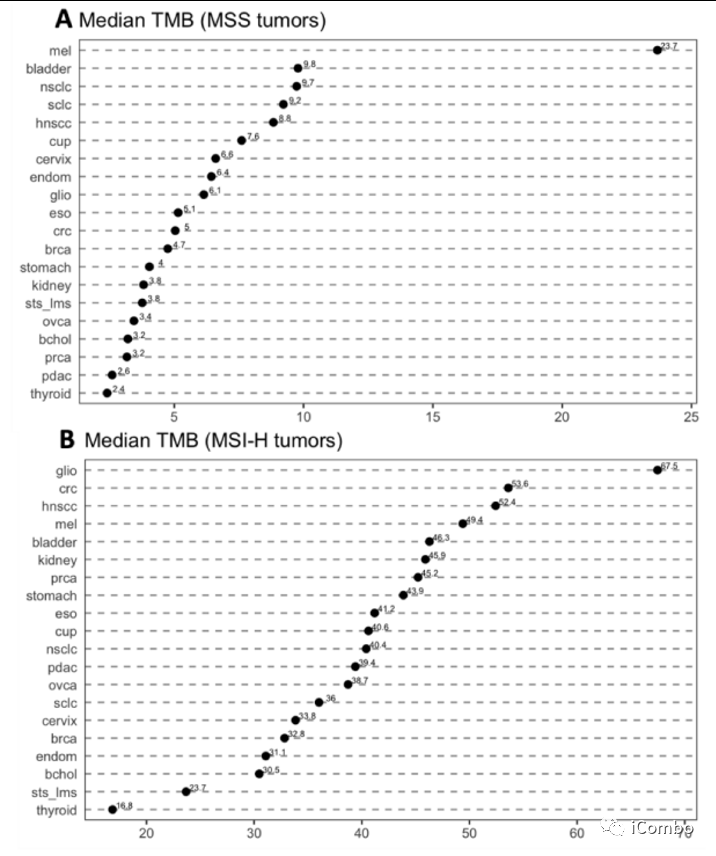
在MSS肿瘤中,除黑色素瘤(23.7 mut/Mb)外,所有肿瘤类型的中位TMB均低于10 mut/Mb。TMB中位数第二高的肿瘤类型是膀胱癌(9.8 mut/Mb),其次是非小细胞肺癌(9.7 mut/Mb)、小细胞肺癌(9.2 mut/Mb)、头颈癌(8.8 mut/Mb),胰腺癌和甲状腺癌的TMB中位数最低(分别为2.6和2.4 mut/Mb)。
在MSI-H肿瘤中,胶质母细胞瘤的TMB中位数最高(67.5 mut/Mb),其次是结直肠癌(53.6 mut/Mb)、头颈癌(49.4 mut/Mb)、黑色素瘤(45.3 mut/Mb)、肾癌(45.4 mut/Mb)。另一方面,MSI-H型甲状腺癌的TMB中位数最低(16.8 mut/Mb)。
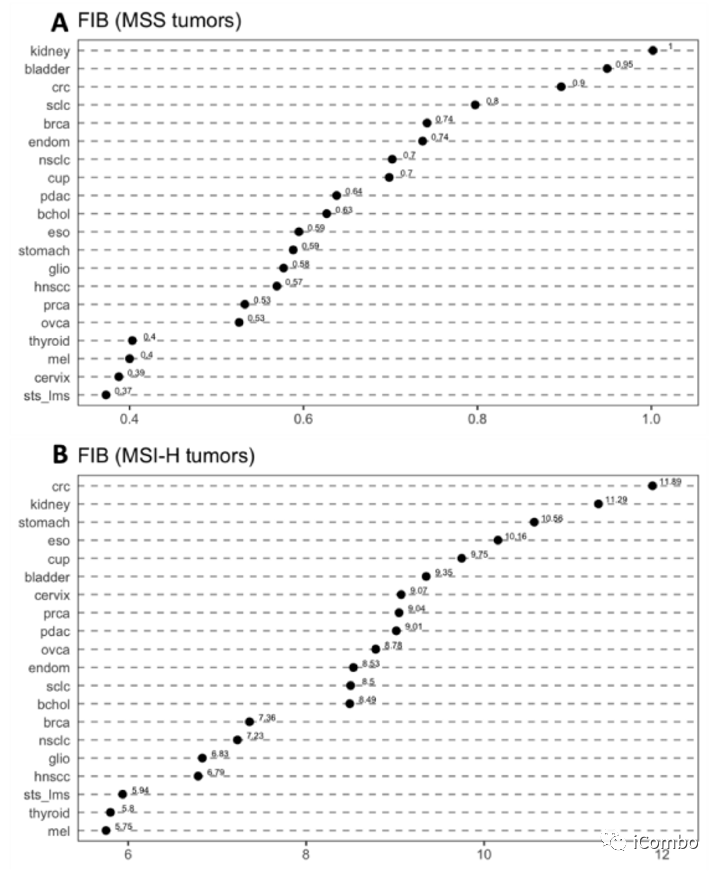
根据MSI-H状态计算移码突变负担(FIB)。对于MSS肿瘤,平均FIB最高的组织学是肾癌,其次是膀胱癌和结直肠癌。FIB最低的为黑色素瘤、宫颈癌和软组织肉瘤。
在MSI肿瘤中,结直肠癌、肾癌和胃癌的FIB最高,软组织肉瘤、甲状腺癌和黑色素瘤的FIB最低。
整个MSS组的平均FIB为5.91,而MSI-H组为9.93。
TMB和FS的联合分布
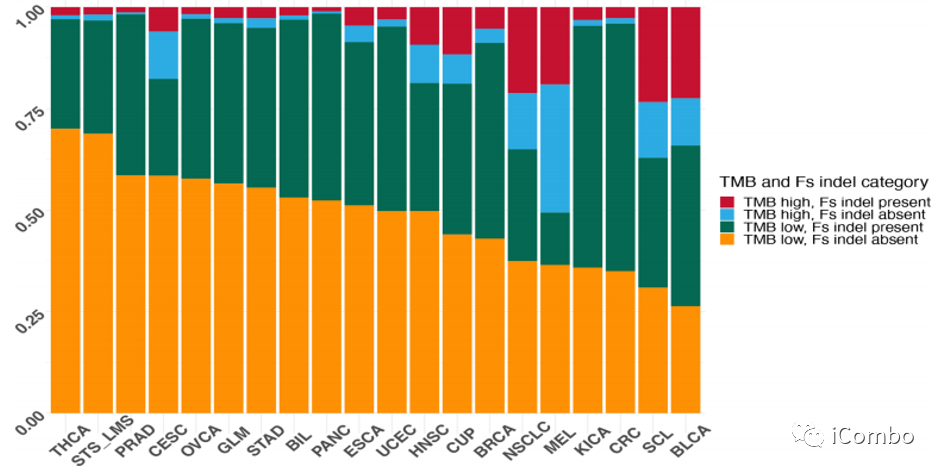
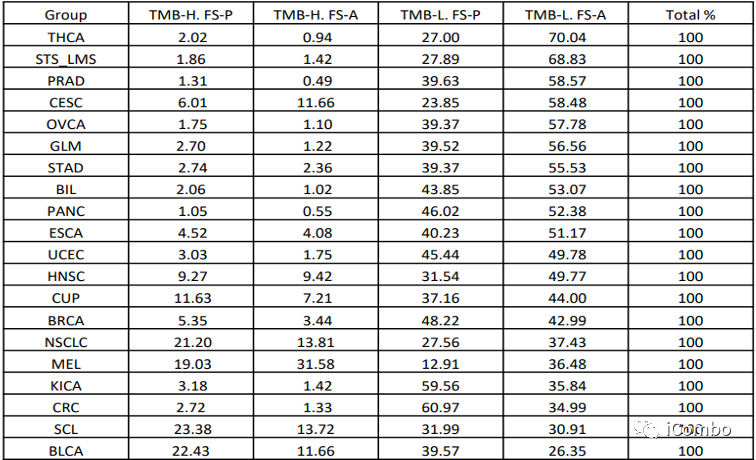
与临床队列相似,本文检查了rw基因组队列中TMB和FS的分布。由于MSI-H肿瘤占队列的比例不到2%,故将分析限制在MSS肿瘤上。根据TMB和是否存在FS指标将样品分为TMB-l/FS-a、TMB-l/FS-p、TMB-H/FS-a和TMB-H/FS-p。TMB-L/FS-P组中比例最高的肿瘤为结直肠癌(60.97%)、肾癌(59.56%)、乳腺癌(48.22%)和子宫内膜癌(45.44%)。TMB-L/FS-P组中代表性最低的肿瘤为黑色素瘤(12.91%)、宫颈癌(23.85%)、甲状腺癌(27%)和软组织肉瘤(27.89%)。
MSS肿瘤中致癌和DNA损伤修复途径相关基因的FS突变分布
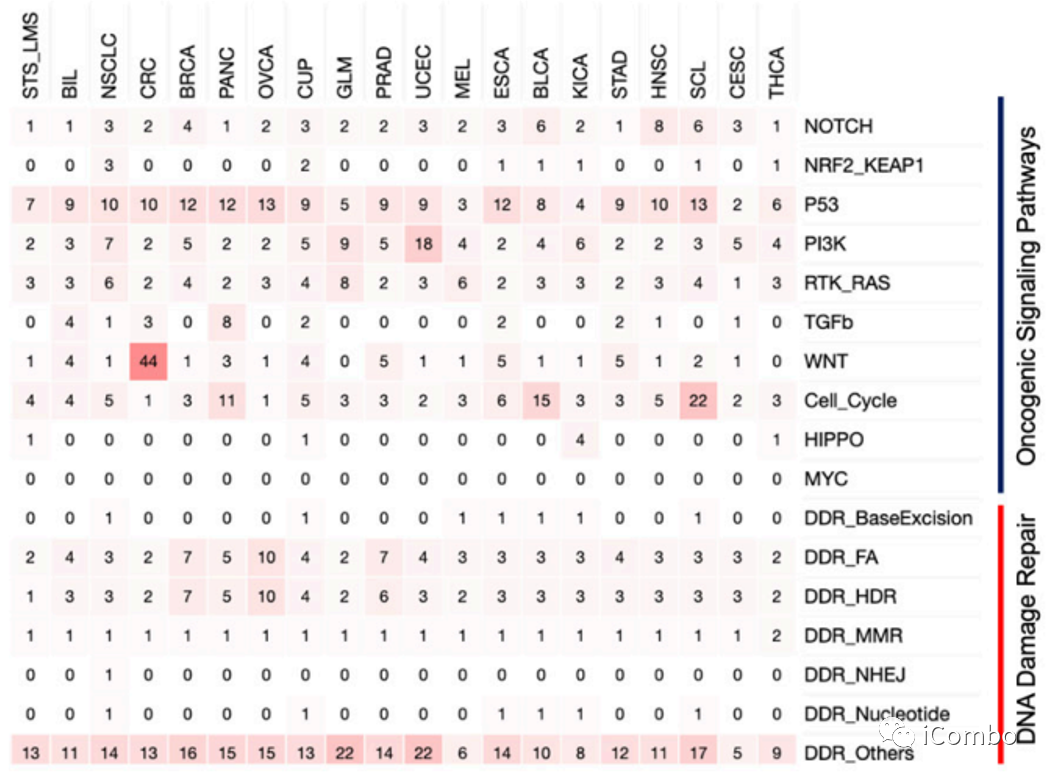
p53通路发生移码突变的频率最高(10%,246252份样本中有24015份),在该通路中移码突变比例最高的肿瘤亚型(按降序排列)为:卵巢癌(13%)、小细胞肺癌(13%)、乳腺癌(12%)、胰腺癌(12%)、食管癌(12%)、非小细胞肺癌(10%)、结直肠癌(10%)....
第二个最常见的途径是PI3K,子宫内膜癌的移码频率最高(18%)。
在细胞周期途径中,小细胞肺癌和膀胱癌是最常见的移码突变的肿瘤亚型(分别为22%和15%)。
所有通路中移码突变频率最高的是结直肠癌(44%)中的 WNT通路
在DNA损伤修复(DDR)途径中,三个途径(损伤传感器、直接修复DR和跨损伤合成TLS)的发生移码突变的频率最高。该通路中移码频率最高的肿瘤亚型依次为(由高到低):胶质母细胞瘤(22%)、子宫内膜癌(22%)、小细胞肺癌(17%)、乳腺癌(16%)、胰腺癌(15%)、卵巢癌(15%)、非小细胞肺癌(14%)、前列腺癌(14%)、食管癌(14%)、软组织肉瘤(13%)、结直肠癌(13%)、原发不明的癌症(13%)、胃癌(12%)、头颈癌(11%)、胆道癌(11%)、膀胱癌(10%)、甲状腺癌(9%)、肾癌(8%)、黑色素瘤(6%)和宫颈癌(5%)。
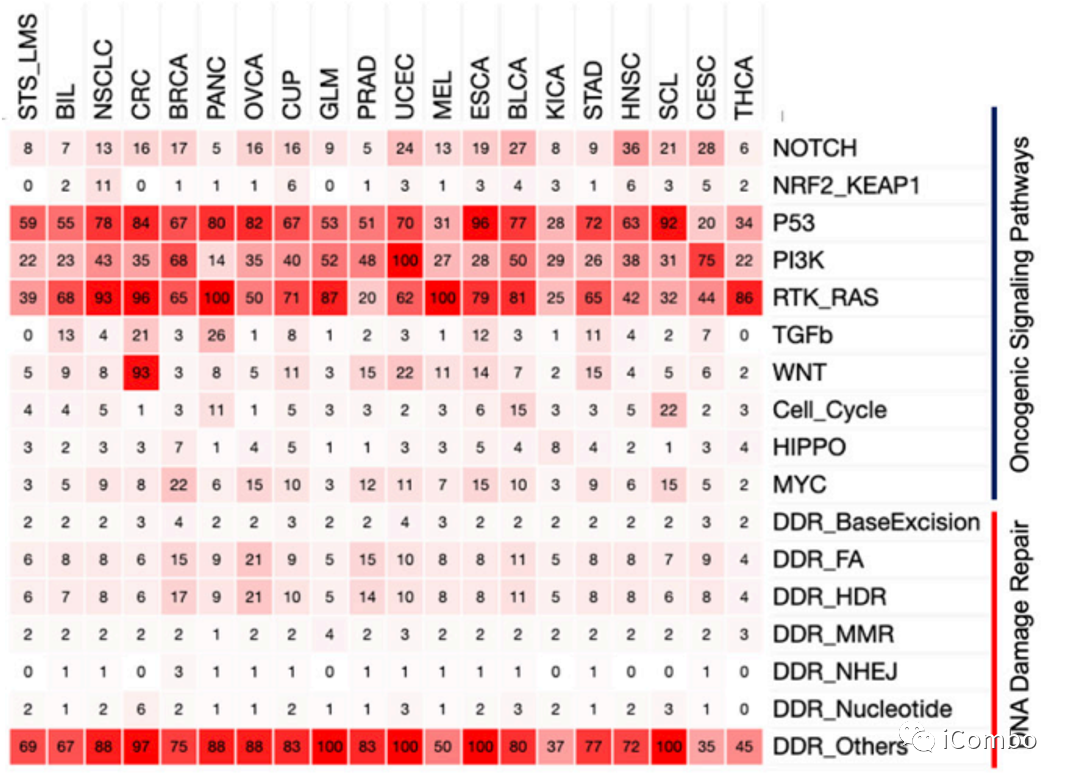
在所有突变中,最常涉及的途径是:RTK-RAS(77%,189,110例)、p53(70%,173,599例)、Cellcycle(60%,147,575例)、PI3K(42%,103,439例)和累积DDR途径。RTK-RAS通路改变频率最高的肿瘤类型依次为(由高到低):黑色素瘤(100%)、胰腺癌(100%)、结直肠癌(96%)、非小细胞肺癌(93%)、胶质母细胞瘤(87%)、甲状腺癌(86%)、膀胱癌(81%)、食管癌(79%)、原发不明的癌症(71%)、胆道癌(68%)、胃癌(65%)、乳腺癌(65%)、子宫内膜癌(62%)、卵巢癌(50%)、宫颈癌(44%)、头颈癌(42%)、软组织肉瘤(39%)、小细胞肺癌(32%)、肾癌(25%)、前列腺癌(20%)。
DISCUSSION
与没有移码突变的肿瘤相比,携带移码突变的肿瘤患者的ORR更高。
在低TMB组,携带移码突变的肿瘤患者中位PFS与那些没有突变的相比有改善。
RTK-RAS作为所有基因组改变频率最高的信号通路并不经常受到移码突变的影响,移码突变在p53通路中更为常见,该通路涉及肿瘤抑制因子TP53和CDKN2A以及MDM2/4癌基因,可能与其在基因组完整性中的作用有关。
在泛癌症队列中有27%的MSS/TMB-L实体肿瘤患者中发现FSs。FS可以作为TMB的补充来预测免疫治疗反应,特别是对于低TMB的肿瘤患者。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#免疫检查点抑制剂# #低突变负荷#
35