Nature:破解造血干细胞培养难题:关键调控因子MYCT1可保持HSCs的干性和扩增能力
2024-06-09 生物探索 生物探索 发表于上海
该研究发现MYCT1是调节人类造血干细胞的关键因子,它通过调控内吞作用和环境感知来维持HSCs的干性。
引言
人造血干细胞(HSCs)在自我更新和移植过程中,受到环境信号的调控。然而,这些过程的具体机制尚不完全清楚,且在体外培养中可靠地扩增功能性HSCs非常具有挑战性。6月5日Nature报道的研究“MYCT1 controls environmental sensing in human haematopoietic stem cells”发现MYC靶标1(MYCT1,也称为MTLC)是调节人类造血干细胞的关键因子,它通过调控内吞作用和环境感知来维持HSCs的干性。MYCT1在未分化的人类造血干细胞及祖细胞(HSPCs)和内皮细胞中选择性表达,但在HSCs培养过程中显著下调。利用慢病毒介导的MYCT1敲低实验表明,MYCT1的缺失会阻止人类胎肝和脐带血(CB)HSPCs的扩增和移植能力,而恢复MYCT1表达则能改善培养的CB HSPCs的扩增和移植能力。单细胞RNA测序结果显示,MYCT1调控HSCs的干性程序及低线粒体活性等关键细胞特性。
MYCT1定位于HSPCs的内体膜,并与囊泡运输调节因子和信号传导机制相互作用。MYCT1的缺失导致HSPCs内吞作用过度和信号响应过度活跃,而恢复MYCT1表达则能平衡培养引起的内吞作用和失调的信号传导。进一步的研究表明,通过筛选低内吞作用率的培养CB HSPCs,可以识别出保留了MYCT1表达和MYCT1调控的HSCs干性程序的细胞。该研究识别了由MYCT1调节的内吞作用和环境感知作为维持人类HSCs干性的必要机制,同时指出MYCT1的沉默是细胞培养引起的一个弱点,可能会影响人类HSCs的扩增功能。
总体而言,HSCs通过响应微环境信号在生命过程中维持血液形成,并能为患有血液恶性肿瘤和遗传性血液疾病的患者提供生命挽救的治疗。然而,HSC移植的可及性受到免疫兼容的骨髓供者难以找到,以及脐带血中HSC数量低的限制。因此,优化细胞培养环境以体外扩增人类HSCs一直是一个长期目标。然而,将人类HSCs从其栖息地转移到培养环境会导致转录组、表观基因组、信号传导、代谢、蛋白质稳态等多方面的广泛变化,从而严重影响HSC的功能。为了最大化体外培养中功能性人类HSCs的产量,需要更好地理解HSC自我更新和移植能力的调控过程,以及它们在培养中受损的原因。该研究揭示了MYCT1作为调控HSCs内吞作用和环境感知的关键因子,对于维持人类HSCs的干性具有重要意义。

造血干细胞(HSCs)是能够自我更新和分化为各种血细胞类型的多能干细胞。它们在维持人体终生的血液生成和免疫功能方面起着至关重要的作用。HSCs的一个显著特点是它们能够响应微环境信号,在自我更新和分化之间进行平衡。然而,HSCs的这些特性在体外培养时往往受到严重影响,导致其功能显著下降。因此,优化HSCs的体外培养条件,以扩增其数量并保持其功能性,一直是干细胞研究的热点。
该研究旨在识别并验证对人类造血干细胞(HSCs)具有重要调控作用的基因,尤其是那些在体外培养过程中能够维持HSCs自我更新和干性的关键因子。研究团队通过RNA测序和单细胞RNA测序等技术手段,发现MYC靶标1(MYCT1,也称为MTLC)在HSCs中具有显著的调控作用。
研究团队对人类发育及出生后不同阶段的造血组织进行RNA测序,分析这些组织中HSCs特异性基因的表达情况。结果显示,MYCT1在未分化的造血干细胞和祖细胞(HSPCs)及内皮细胞中选择性表达,但在HSCs体外培养过程中显著下调。
为了深入探讨MYCT1的功能,研究人员对敲低(knockdown, KD)或过表达(overexpression, OE)MYCT1的人类脐带血(CB)HSPCs进行了单细胞RNA测序。结果表明,MYCT1在调控HSCs干性程序和低线粒体活性方面起着重要作用。
研究团队通过慢病毒介导的方法敲低或恢复MYCT1表达,并观察其对人类胎肝和脐带血HSPCs扩增和移植能力的影响。结果显示,敲低MYCT1显著阻止了HSPCs的扩增和移植能力,而恢复MYCT1表达则显著改善了这些功能。
MYCT1在HSPCs中的表达和功能
RNA测序结果显示,MYCT1在未分化的HSPCs中高表达,但在体外培养过程中显著下调。进一步的实验表明,MYCT1在内体膜中定位,并与囊泡运输调节因子和信号传导机制相互作用。敲低MYCT1导致HSPCs内吞作用过度和信号响应过度活跃,而恢复MYCT1表达则能平衡培养引起的内吞作用和失调的信号传导。
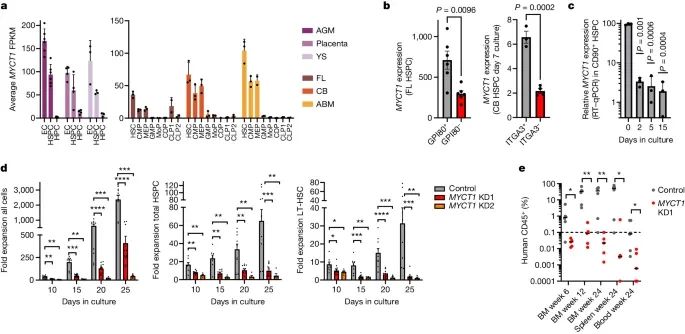
MYCT1 对于人类造血干/祖细胞 (HSPC) 体外扩增和移植至关重要(Credit: Nature)
MYCT1对HSPCs扩增和移植能力的影响
研究表明,敲低MYCT1显著阻止了人类胎肝和脐带血HSPCs的扩增和移植能力,而恢复MYCT1表达则显著改善了这些功能。在小鼠模型中的移植实验进一步验证了这一点,恢复MYCT1表达的HSPCs在移植后表现出更高的多系血液重建能力。
MYCT1对HSCs干性程序的调控
单细胞RNA测序结果显示,MYCT1在调控HSCs干性程序和低线粒体活性方面起着重要作用。MYCT1缺失导致HSCs干性标志基因(如MLLT3, HIF1A, MEIS1)的表达显著下降,而过表达MYCT1则能恢复这些基因的表达。此外,MYCT1缺失还导致线粒体活性和氧化磷酸化(OXPHOS)相关基因的过度表达,这与HSCs功能下降相关。
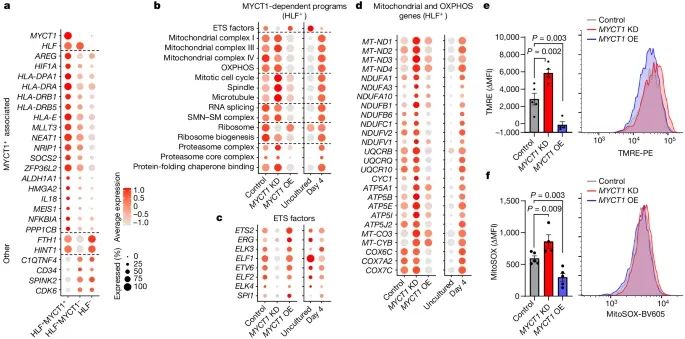
MYCT1 调控与人类造血干细胞 (HSC) 功能相关的调节程序(Credit: Nature)
MYCT1对内吞作用的调控
研究发现,MYCT1定位于HSPCs的内体膜,并与内吞作用相关的蛋白质相互作用。敲低MYCT1导致HSPCs内吞作用过度,而过表达MYCT1则能抑制这种过度的内吞作用。在体外培养过程中,恢复MYCT1表达能有效抑制HSPCs的过度内吞作用,并保持其干性。
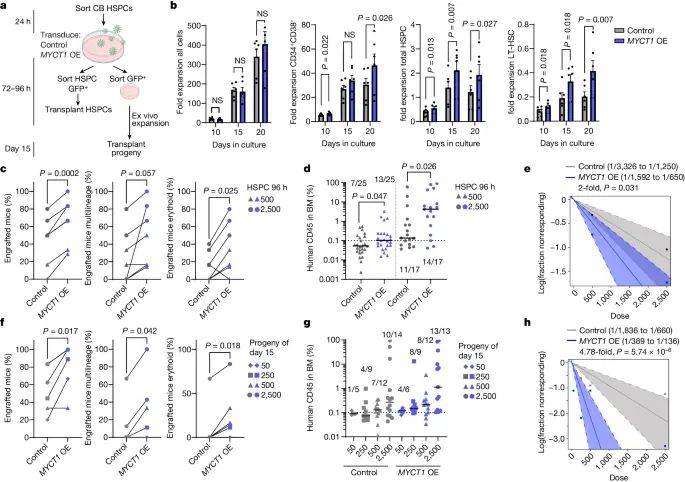
恢复培养的人类造血干/祖细胞 (HSPC) 中的 MYCT1 表达可改善其体外扩增和移植能力(Credit: Nature)
这项研究揭示了MYCT1作为调控HSCs内吞作用和环境感知的关键因子,对于维持人类HSCs的干性具有重要意义。通过识别并验证MYCT1的功能,研究团队为优化HSCs的体外培养条件提供了新的思路和策略。这一发现不仅有助于提高HSCs的体外扩增效率,还为HSCs的临床应用提供了新的潜在靶点,有望解决HSCs移植中供体短缺的问题。
总的来说,该研究通过系统性的RNA测序和单细胞RNA测序分析,识别并验证了MYCT1在调控人类造血干细胞中的关键作用。MYCT1通过调控内吞作用和环境感知,维持HSCs的干性,并在HSCs的体外培养和移植中发挥重要作用。未来的研究将进一步探讨MYCT1的上游调控因子及其在其他模型中的作用,以期为HSCs的临床应用提供更加全面的理论依据和技术支持。
通过该研究的深入分析,不仅揭示了HSCs在环境感知和内吞作用中的复杂机制,还为优化HSCs的体外培养条件提供了新的思路。这一发现有望推动HSCs的临床应用,解决当前HSCs移植中面临的挑战,为患者带来更多的治疗希望。
原文链接
Aguadé-Gorgorió J, Jami-Alahmadi Y, Calvanese V, Kardouh M, Fares I, Johnson H, Rezek V, Ma F, Magnusson M, Wang Y, Shin JE, Nance KJ, Goodridge HS, Liebscher S, Schenke-Layland K, Crooks GM, Wohlschlegel JA, Mikkola HKA. MYCT1 controls environmental sensing in human haematopoietic stem cells. Nature. 2024 Jun 5. doi: 10.1038/s41586-024-07478-x. Epub ahead of print. PMID: 38839950.
https://www.nature.com/articles/s41586-024-07478-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#造血干细胞# #内吞作用# #MYCT1# #环境感知#
27