IVD前沿丨卵巢癌的早期诊断新技术
2024-03-04 小桔灯网 小桔灯网 发表于上海
本研究的目的是为pDNA中体细胞拷贝数改变(SCNAs)的分析提供实验证据,并将其纳入命名为EVA(早期卵巢癌)测试中,可用于HGSOC的早期诊断。
卵巢癌是最致命的妇科恶性肿瘤,具有侵袭性强、预后差的特点,其中高级别浆液性卵巢癌(highgrade serous disease, HGSOC)是最常见、最致命的,确诊患者有70%以上在确诊后5年内死亡,而I期HGSOC的5年总生存率在90%以上。HGSOC在不同阶段的治愈率差异很大,这使得早期诊断HGSOC有可能提高生存率。多年来,为HGSOC开发早期检测的尝试一直令人失望。一些基于传统诊断方法的筛查研究,如单独或联合经阴道超声测定血浆CA-125,未能降低HGSOC死亡率。最可能的原因是,这些生物标志物的测定不够敏感,无法揭示肿瘤发展的初始阶段。
近日,一组来自意大利的研究团队在杂志Science translational medicine上发表了一篇题为“Genomic instability analysis in DNA from Papanicolaou test provides proof-of-principle early diagnosis of high-grade serous ovarian cancer”的文章。本研究的目的是为pDNA中体细胞拷贝数改变(SCNAs)的分析提供实验证据,并将其纳入命名为EVA(早期卵巢癌)测试中,可用于HGSOC的早期诊断。

图片来源:Science translational medicine
主要内容
HGSOC病例与健康女性对照的特点
本研究选择了回顾性和多中心收集的250份巴氏涂片,来自113名随后被诊断为HGSOC的妇女(pre-HGSOC)在不同时间点的样本,以及77名常规妇科筛查期间收集的健康妇女(HW)。pre-HGSOC在诊断时的中位年龄为60岁左右,接受巴氏涂片的HW的中位年龄为43岁。因为巴氏试验分析不再推荐绝经后妇女,很难收集年龄与pre-HGSOC妇女相似的HW的巴氏涂片。在撰写本文时,所有HW仍然活着,没有妇科肿瘤或任何其他肿瘤或其他妇科炎症性疾病的证据。从收集档案样本到诊断HGSOC的时间,pre-HGSOC为0个月~ 13.6年。
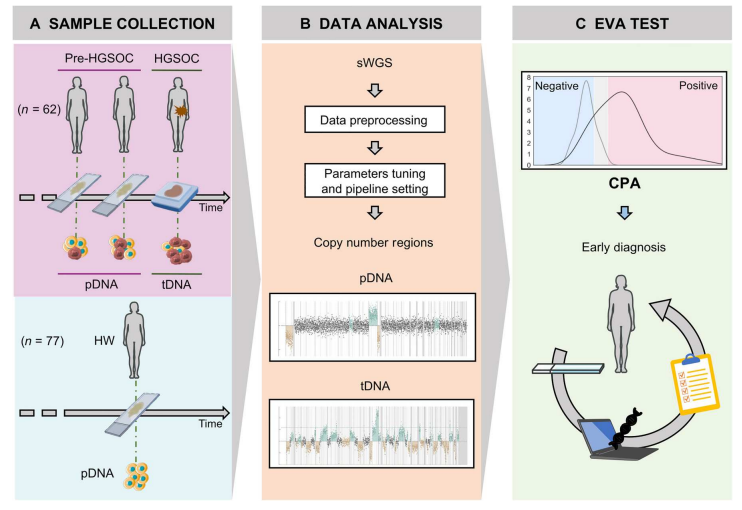
EVA测试流程。图片来源:Science translational medicine
pDNA中体细胞拷贝数改变(SCNAs)分析
作者使用了低深度全基因组测序(sWGS)方法来检测从肿瘤样本纯化的DNA (tDNA)和pre-HGSOC pDNA中的SCNA。首先评估了tDNA中的全局SCNA特征。使用GISTIC 软件进行分析,证实了tDNA异质SCNA,3q26.31/8q24.12和16q21/ 12q24.13分别是最常拷贝数升高或下降的基因组区域。
然后,为了证明巴氏涂片中存在来自肿瘤细胞的DNA,作者研究了整个pDNA组中SCNA的存在。大部分(89%)pDNA中可检测到SCNA,包括广泛染色体区域的拷贝数升高或下降。下图描述了pre-HGSOC女性(ID:1240-11) tDNA和三个不同时间点pDNA的拷贝数概况。tDNA的特点是在所有染色体上都有大量的基因组畸变,而pDNAs则表现出大部分是整倍体基因组,拷贝数升高或下降区域很少。在所有时间点的pDNAs和tDNA样本中都可以检测到16号染色体(p11.1位点)拷贝数下降(下图)。从病理学角度来看,16号染色体上拷贝数下降已被报道为HGSOC的早期基因组改变。总之,数据显示,pre-HGSOC样本的pDNA基因组特征是SCNAs和TP53的致病性突变。这些异常在诊断前6年收集的样本中可见。
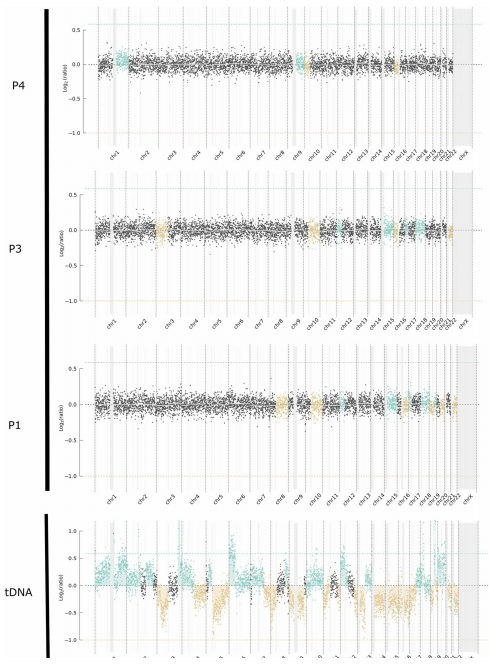
tDNA与诊断前不同时间点pDNA拷贝数谱比较。
图片来源:Science translational medicine
EVA测试:测量pDNA中SCNA的整体景观
分析巴氏涂片整体基因组的不稳定性,而不是分析单个SCNA可能有助于区分HW和pre-HGSOC的妇女。作为整体基因组不稳定性的衡量标准,作者使用了先前发表的拷贝数谱异常(CPA)评分。
基于TCGA-OV HGSOC染色体最常改变区域的CPA,HW与pre-HGSOC pDNA的CPA分布有统计学差异(下图A)。这些分布定义了三个不同的区间:(i)第一个区间(0 ≤CPA < 0.0887)包括来自20个HW的pDNA (80 %)和11个pre-HGSOC的pDNA(17%),代表SCNA-negative。(ii)第二个区间(0.0887≤ CPA < 0.11207)包括来自5个HW的pDNA (20%)和10个pre-HGSOC的患者(15%),代表了不能确定。(iii)第三区间(CPA ≥0.11207)包括44个pre-HGSOC pDNA (68%),代表SCNA-positive。在此假设下,特异性为100%,灵敏度为67.69%,准确率为76.67%。
使用全基因组而非区域特异性方法重复了整个分析,CPA分布呈现出三个不同的区间:(i) 0 ≤CPA < 0.52372, (ii) 0.52372 CPA <0.61,(iii) CPA≥0.61,与之前TCGA-OV的结果类似(下图B)。在这种情况下,特异性、敏感性和准确性分别为96.00%、75.38%和81.11%。这一发现表明,尽管HGSOC基因组中的SCNA谱高度可变,但在pDNA中鉴定非整倍体区域依然可行,可使用EVA测试进行早期疾病检测。

HW和pre-HGSOC中CPA值的分布。
图片来源:Science translational medicine
纵向分析CPA以追踪基因组不稳定性演化
最后,为了系统地检查每个患者的临床病史中基因组不稳定性的演变,根据巴氏涂片收集的时间绘制了pre-HGSOC pDNAs中测量的CPA值。下图描述了pre-HGSOC是CPA值(根据全基因组方法测量)在很长时间内的演变,从很短(t = 0)到肿瘤发病前11年。这表明染色体不稳定的时间相对较长。总体而言,pre-HGSOC pDNAs样品: 75.4%(49 / 65)显示存在非整倍体基因组,15.4%(10 / 65)显示存在二倍体基因组,9.2%(6 / 65)为“不确定”。非整倍体基因组的存在可以在诊断前9年通过CPA分析检测到。与CPA分析结果一致,进一步的纵向证据证明TP53致病变异可以在宫颈内拭子中检测到诊断前至9年。
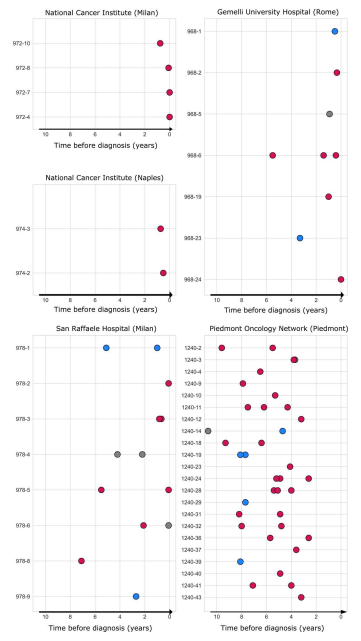
基因组不稳定性的演化。
图片来源:Science translational medicine
总结与讨论
作者通过对来自巴氏样本的DNA进行低通全基因组测序,以拷贝数异常(CPA)的方式检测基因组不稳定性。从pre-HGSOC妇女的巴氏试验样本中提取的DNA CPA值明显高于健康妇女,该方法可以在诊断前9年检测到HGSOC的存在。将CPA评分纳入EVA(早期卵巢癌)检测,其敏感性为75%,特异性为96%,准确性为81%。这项原理证明研究表明,通过分析宫颈内膜涂片DNA的基因组改变,早期诊断HGSOC是可行的。但此研究也有以下局限性:(i)它是回顾性的,样本量有限;(ii)样本不是在标准化时间点收集的,限制了随时间评估EVA测试性能的可能性;(iii)pre-HGSOC和HW之间的年龄中位数存在差异。
基于sWGS的EVA测试成本低廉,并且易于整合到已经在进行的大规模筛查项目中,用于早期发现宫颈癌。EVA检测的特异性为96%,这意味着每10万名接受检测的女性中可能有4000例假阳性病例。然而,该方法的相对简单性和成本效益使得对同一患者进行连续分析(例如每6个月或每年一次)可行,这将减少假阳性的数量。总之,此研究为基于子宫颈涂片提取DNA基因组不稳定性模式的早期检测HGSOC的新方法提供了基础。由于HGSOC患者的低生存率通常与诊断延迟有关,因此本文提出的方法的应用可能会对该肿瘤的死亡率产生显著影响。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#卵巢癌# #高级别浆液性卵巢癌# #pDNA#
31