Circ Res 天津医科大学李广平教授、刘彤教授与何金龙教授合作揭示动脉粥样硬化防治新策略
2024-03-11 论道心血管 论道心血管 发表于上海
研究揭示CNP通过调控巨噬细胞炎症反应进而抑制动脉粥样硬化并促进斑块稳定的作用及分子机制,为动脉粥样硬化的防治提供了新的研究思路和治疗策略。
动脉粥样硬化是众多心血管疾病的共同病理基础以及重要诱发因素,随着其病程的进展将导致脑卒中、冠心病以及下肢动脉疾病致残等。尽管近几十年来动脉粥样硬化性心血管疾病(Atherosclerotic cardiovascular disease, ASCVD)患者的预后得到极大改善,但ASCVD仍然是全球疾病发病和死亡的首要原因。巨噬细胞在受损血管壁的聚集是动脉粥样硬化发病机制中的一个关键过程,它不仅可以吞噬沉积的正常及修饰的脂蛋白形成泡沫细胞,导致血管壁脂肪条纹的形成,还可以受到氧化的磷脂和胆固醇结晶等刺激,促进血管局部炎症反应。
2024年3月8日,天津医科大学第二医院李广平/刘彤教授和天津医科大学何金龙教授合作在Circulation Research发表题为“CNP ameliorates macrophage inflammatory response and atherosclerosis”的研究论文,揭示CNP通过调控巨噬细胞炎症反应进而抑制动脉粥样硬化并促进斑块稳定的作用及分子机制,为动脉粥样硬化的防治提供了新的研究思路和治疗策略。

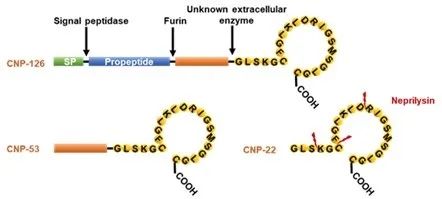
CNP (C-type natriuretic peptide)是一段包含22个氨基酸的肽段,由NPPC (Natriuretic peptide precursor C)剪切而来。细胞外,CNP可以进一步被脑啡肽酶(Neprilysin)剪切氨基端疏水残基而失活,Sacubitril作为脑啡肽酶抑制剂能够显著升高血浆中CNP水平。CNP可以通过作用于内皮细胞和平滑肌细胞参与血管张力和全身血压的慢性调控,还可以通过促进内皮细胞血管新生参与血管重构的调控。尽管与CNP同属一个家族的心房利钠肽(Atrial natriuretic peptide, ANP)和脑钠肽(Brain natriuretic peptide, BNP)相关研究较多,但目前对CNP的相关研究仍然存在很大空白,尤其CNP对于巨噬细胞功能的调控以及其在动脉粥样硬化疾病中的作用尚不清楚。
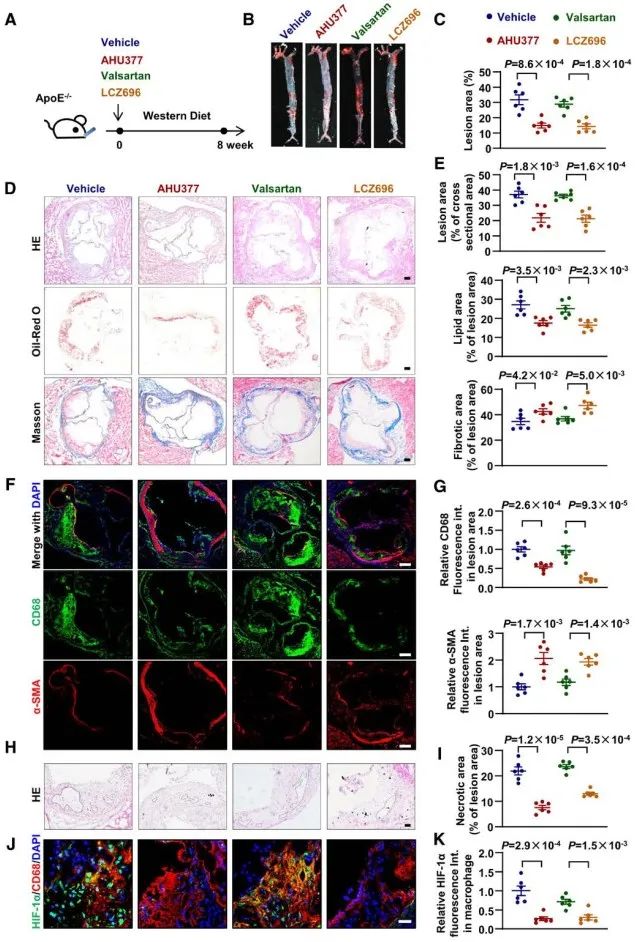
为探究CNP与动脉粥样硬化疾病的相关性,该研究通过分析急性冠脉综合征(Acute coronary syndrome, ACS)患者血浆中CNP的含量与冠状动脉造影结果,数据显示血浆CNP的含量与冠状动脉狭窄程度呈负相关。随后在西方饮食喂养的ApoE-/-小鼠动脉粥样硬化斑块中染色发现,CNP主要聚集在斑块巨噬细胞而非内皮细胞或者平滑肌细胞中,同时随着西方饮食喂养时间的延长以及动脉粥样硬化的进展,斑块中巨噬细胞中CNP的含量逐渐降低。

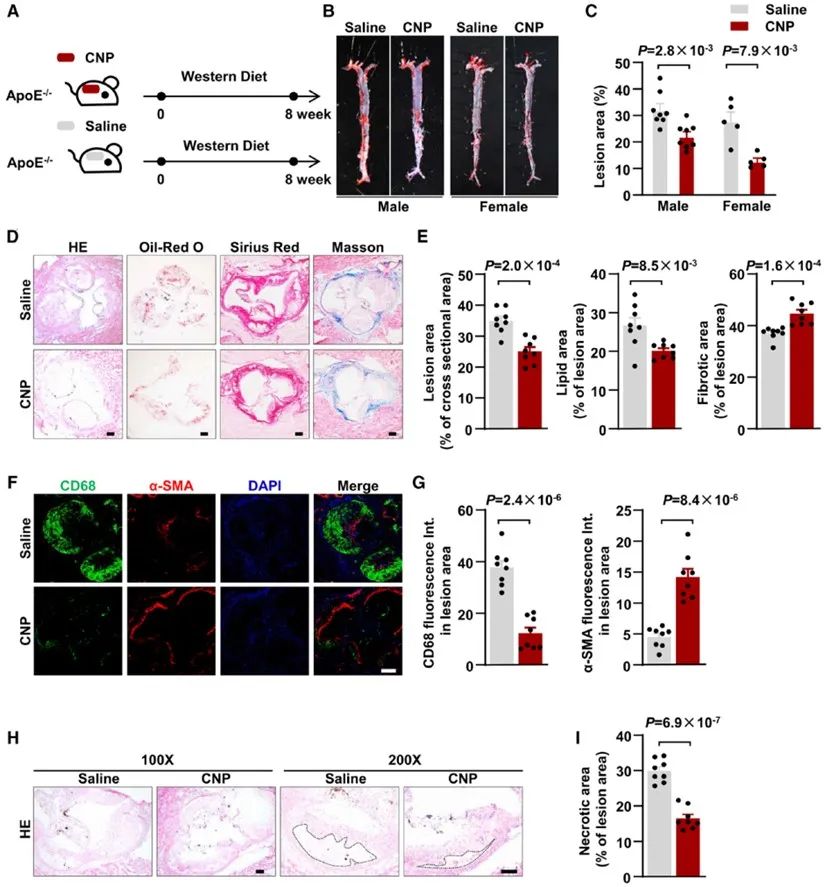
随后,研究人员在雌性和雄性ApoE-/-小鼠中构建西方饮食喂养诱导的动脉粥样硬化模型,并采用植入皮下缓释泵的方式给予小鼠CNP处理,结果显示处理8周后,CNP灌注在雌雄小鼠中均可以显著减轻主动脉流出道动脉粥样硬化斑块的形成并减少斑块坏死核心、促进斑块的稳定性。
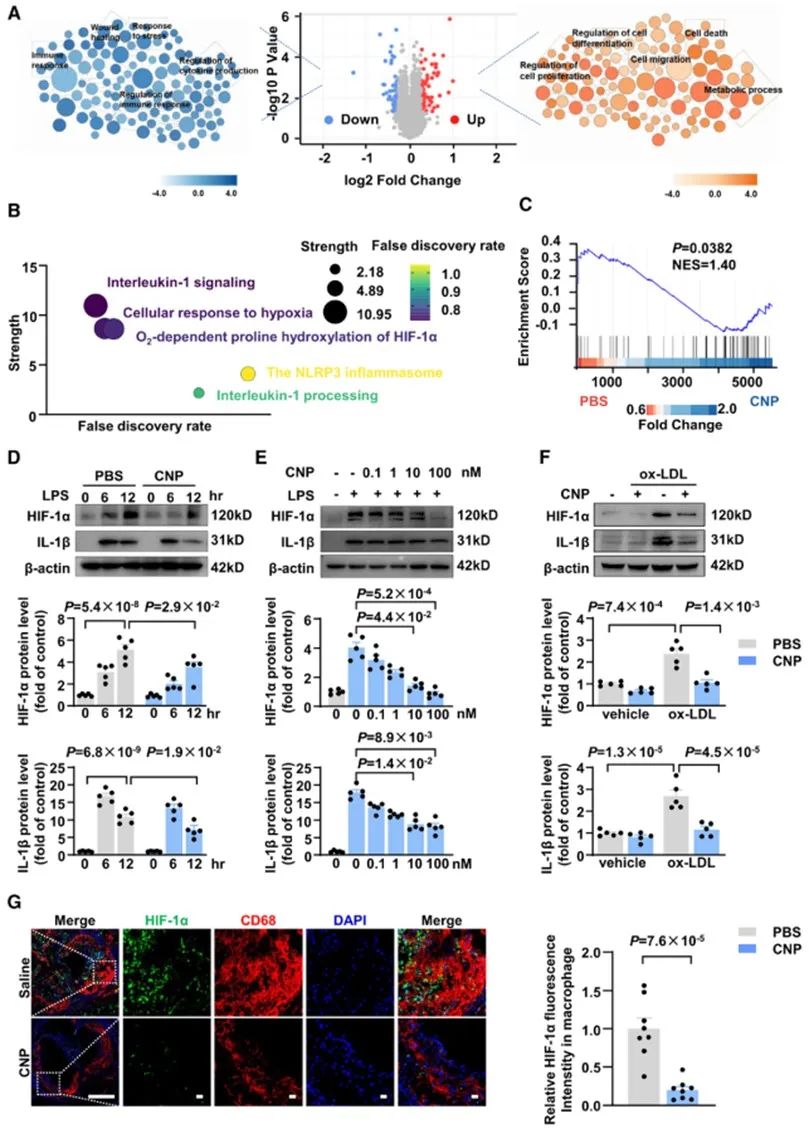
为探究CNP对于巨噬细胞的功能调控以及作用机制,研究人员对CNP处理后的小鼠原代巨噬细胞进行了蛋白组学分析,得到68个显著上调蛋白和64个显著下调的蛋白。基于差异蛋白的GO分析和通路富集分析,提示CNP的保护性作用可能与抑制HIF-1α介导的IL-1β的表达有关。随后在体外细胞实验中发现,CNP处理可以降低LPS、氧化低密度脂蛋白或缺氧等刺激因素诱导的HIF-1α以及IL-1β的升高。在体实验中也同样检测到CNP的处理可以显著降低动脉粥样硬化斑块中巨噬细胞中HIF-1α表达。
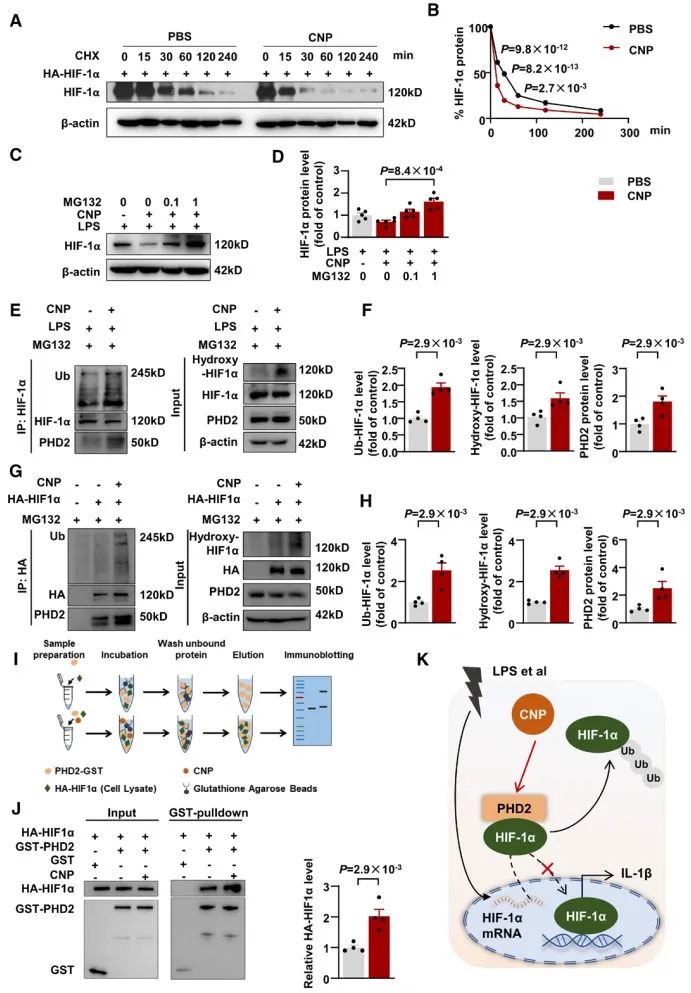
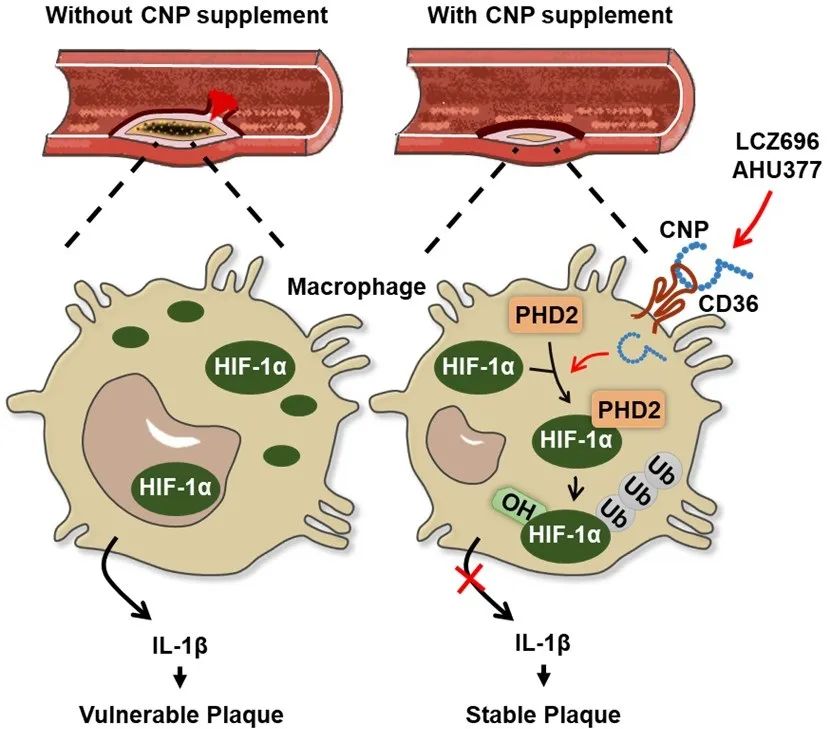
HIF-1α是细胞感受和适应O2水平变化的转录因子,Gregg Semenza、Peter Ratcliffe和William Kaelin由于发现HIF及其作用机制的杰出贡献而分享了2019年诺贝尔生理学或医学奖。在常氧状态下,HIF-1α受到PHD1/2/3 (Prolyl hydroxylase domain-containing protein 1/2/3)作用发生羟基化修饰,随后VHL (von Hippel–Lindau)识别羟基化的HIF-1α,继而被cullin2 E3连接酶复合体泛素化后进入蛋白酶体降解。研究人员进一步探究机制发现,CNP处理可以增加HIF-1α的泛素化修饰水平,并促进PHD2与HIF-1α结合。CNP又是如何进入巨噬细胞的呢?研究者发现CD36敲除,而非CNP经典受体NPR-B/C的敲除,可以逆转CNP对于HIF-1α的调控以及CNP的保护性作用,提示巨噬细胞CD36可以介导CNP的内吞。
为进一步拓展该发现的临床治疗意义,研究者提出了一种新的动脉粥样硬化防治策略。LCZ696是由脑啡肽酶抑制剂前体药物AHU377/Sacubitril和缬沙坦两种成分构成的合剂,摄入人体后经代谢可分解缬沙坦和活性成分LBQ657。LBQ657则可通过抑制内源性利钠肽降解,使循环中利钠肽水平升高。目前,LCZ696是临床上用于治疗心力衰竭的首选药物之一,但是否可以抑制动脉粥样硬化的进展尚不清楚。研究者发现给予小鼠LCZ696灌胃处理可以增加血浆中CNP的含量,且可以显著抑制西方饮食诱导ApoE-/-小鼠的动脉粥样硬化斑块的形成。
综上所述,该研究阐明CNP可由巨噬细胞表面受体CD36介导进入细胞,通过促进PHD2与HIF-1α的结合导致HIF-1α泛素化修饰以及蛋白酶体途径降解,进而抑制巨噬细胞炎症反应,最终抑制动脉粥样硬化形成并促进斑块稳定性。
天津医科大学第二医院鲍乾坤副研究员和天津医科大学博士毕业生张邦滢为本文共同第一作者。天津医科大学何金龙教授、天津医科大学第二医院李广平教授和刘彤教授为本文通讯作者。课题得到了天津医科大学第二医院车京津主任、刘行博士、袁梦博士、张跃博士,Arizona State University魏闻博士以及天津医科大学朱毅教授等的大力帮助与支持。该工作获得国家自然科学基金、天津市临床医学重点学科(专科)建设项目等项目资助。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.123.324086
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#动脉粥样硬化# #CNP# #斑块稳定#
80