Nature Communications:刘芝华/陈洪岩/苏建忠团队发表食管鳞癌lncRNA转录图谱并揭示其在临床诊断的潜力
2023-07-16 测序中国 测序中国 发表于上海
研究团队基于ESCC患者配对肿瘤和邻近正常组织的全转录组数据鉴定了6个lncRNA诊断特征,并在多中心跨平台队列中验证了其有效性,MLMRPscore在区分ESCC与正常对照方面表现优良。
食道癌(EC)是一种严重威胁人类健康的消化系统恶性肿瘤,分为食管腺癌(EAC)和食管鳞状细胞癌(ESCC)两种组织学亚型。中国ESCC的发病率较高,约占总EC病例的90%。ESCC早期症状并不明显,多数患者确诊时已是中晚期,其预后较差、5年生存率较低。目前,内镜筛查和早期干预是降低ESCC发病率和死亡率的有效方法。但目前内窥镜筛查多在中国的高风险地区进行。因此,亟需开发可靠的生物标志物以应用于ESCC的早期检测和筛查。
长度超200个核苷酸的长链非编码RNA(lncRNA)被认为是转录调控、染色质重组和转录后调控的关键介质,其表达谱范围广、肿瘤特异性高及在循环体液中稳定性强,在筛选肿瘤诊断和预后标志物方面具有独特优势。但目前仍缺乏对ESCC从组织到体液活检的lncRNA诊断生物标志物进行系统、全面的研究。
近日,中国医学科学院北京协和医学院刘芝华、陈洪岩团队与温州医科大学苏建忠团队合作,在Nature Communications上发表了题为“The transcriptional landscape and diagnostic potential of long non-coding RNAs in esophageal squamous cell carcinoma”的文章。研究团队基于ESCC患者配对肿瘤和邻近正常组织的全转录组数据鉴定了6个lncRNA诊断特征(MLMRPscore),并在多中心跨平台队列中验证了其有效性,MLMRPscore在区分ESCC与正常对照方面表现优良。此外,该研究还发现了5个具有非侵入性诊断潜力的lncRNA,其显示出优于或与当前临床血清学标志物相当的诊断准确性。

文章发表在Nature Communications
研究团队开展了一项多中心、跨平台的lncRNA生物标志物在ESCC诊断中的临床发现和验证研究(图1)。在发现阶段,对来自山西肿瘤医院的93例ESCC患者(SCH发现队列)进行了全基因组筛选,以确定候选lncRNA生物标志物。通过整合多个lncRNA生物标志物,研究团队开发了一个恶性肿瘤风险概率模型“MLMRPscore”,以识别SCH发现队列中的ESCC。在验证阶段,利用不同的多中心和跨平台回顾性队列评估、检测了MLMRPscore的诊断性能,包括三个内部队列(SCH验证队列、CAMS组织队列和CAMS血浆队列),以及4个外部队列(You队列、TCGA-GTEx队列、2个Li队列)。
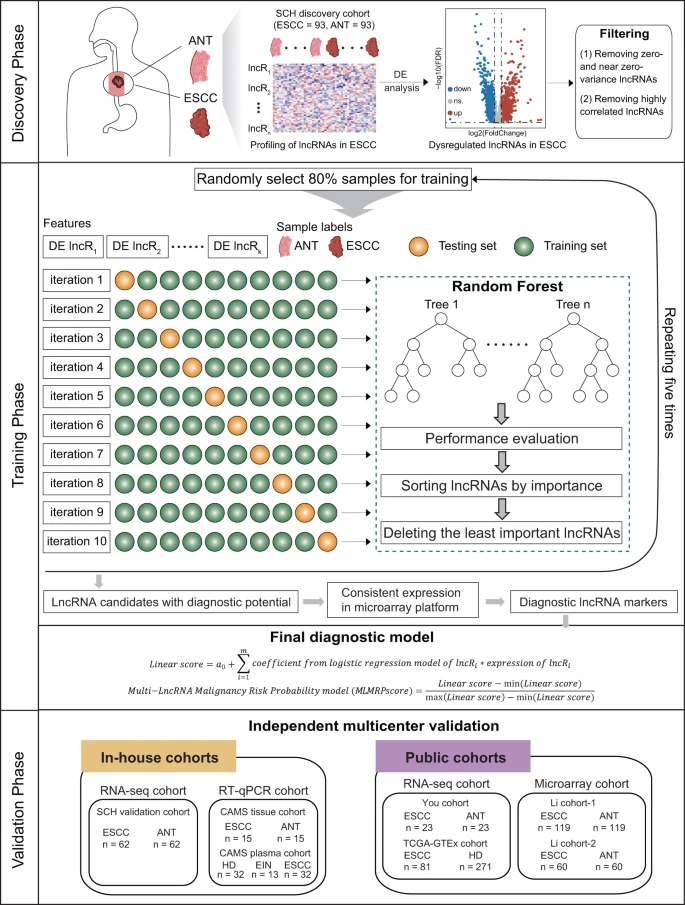
图1. 研究设计流程图。
为鉴定与ESCC相关的lncRNA,研究团队分析了SCH发现队列中93名ESCC患者的配对肿瘤和邻近正常组织的全基因组lncRNA表达图谱(图2),鉴定出2103个差异表达的lncRNA(DElncRNA)。经RF-RFE算法分析、微阵列平台验证,研究团队共确定了6种lncRNA生物标志物,即AP003548.1、PGM5-AS1、ADAMTS9-AS1、MIR503HG、LINC01082和LINC03016。相对于邻近的非癌症组织,在ESCC中,MIR503HG过表达,其余5个lncRNAs表达下调。此外,与6种lncRNA生物标志物共表达的mRNA在许多已知的癌症相关途径中富集。
上述结果证明了6种lncRNA生物标志物在ESCC发病机制中的生物学相关性,并强调了其作为ESCC诊断检测方法的潜力。
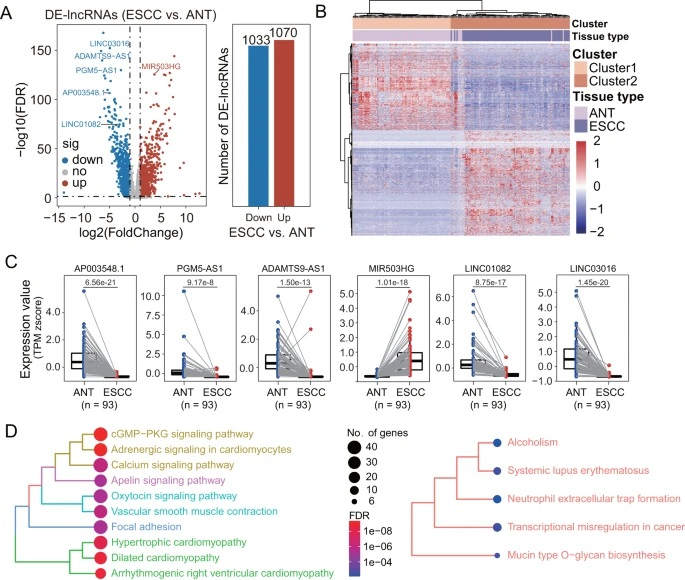
图2. 与ESCC相关的lncRNA生物标志物。
为建立一个临床通用的基于lncRNA的恶性肿瘤概率模型以评估ESCC发生的风险概率,研究团队整合了上述6个lncRNA生物标志物,构建了一个多lncRNA诊断特征(MLMRPscore)。经内部SCH队列验证,MLMRPscore在区分ESCC和非癌组织方面表现出优异的性能,AUC为1.0。
接下来,研究团队使用RT-qPCR检测了CAMS队列15对ESCC和邻近非癌组织中6个lncRNA的表达水平,验证了MLMRPscore的性能。与SCH发现及验证队列检测的表达模式一致,在ESCC组织标本中,5个lncRNA显著下调,一个lncRNA显著上调。MLMRPscore的AUC为0.978、灵敏度为93.33%,特异性为93.33%。这些结果证实了MLMRPscore在组织标本中性能稳健、诊断潜力优越。
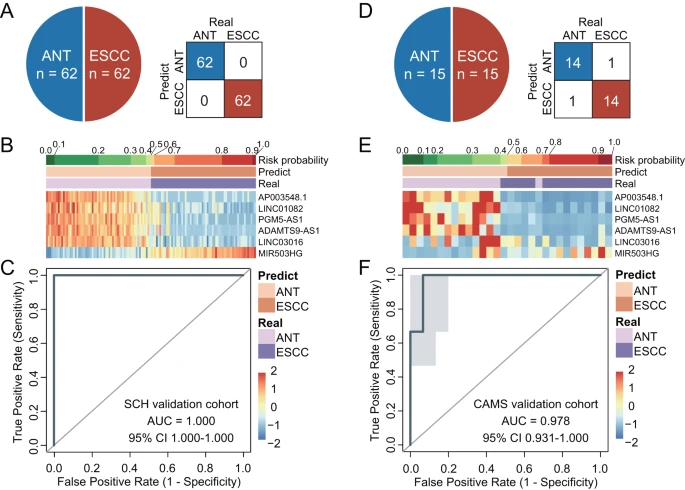
图3. 用于ESCC的多lncRNA诊断特征(MLMRP score)的开发和验证。
为独立验证MLMRPscore,研究团队在四个不同平台的完全盲性外部队列中检测MLMRPscore的诊断性能。结果显示,MLMRPscore能良好区分四个队列中的ESCC组织样本和匹配正常对照,其AUC分别为0.968、0.951、0.997和1.0。与内部验证队列相同,6个lncRNA生物标志物在外部验证队列显示出一致的失调表达模式。上述多中心跨平台的验证研究再次显示了MLMRPscore可靠、强大的诊断功效。
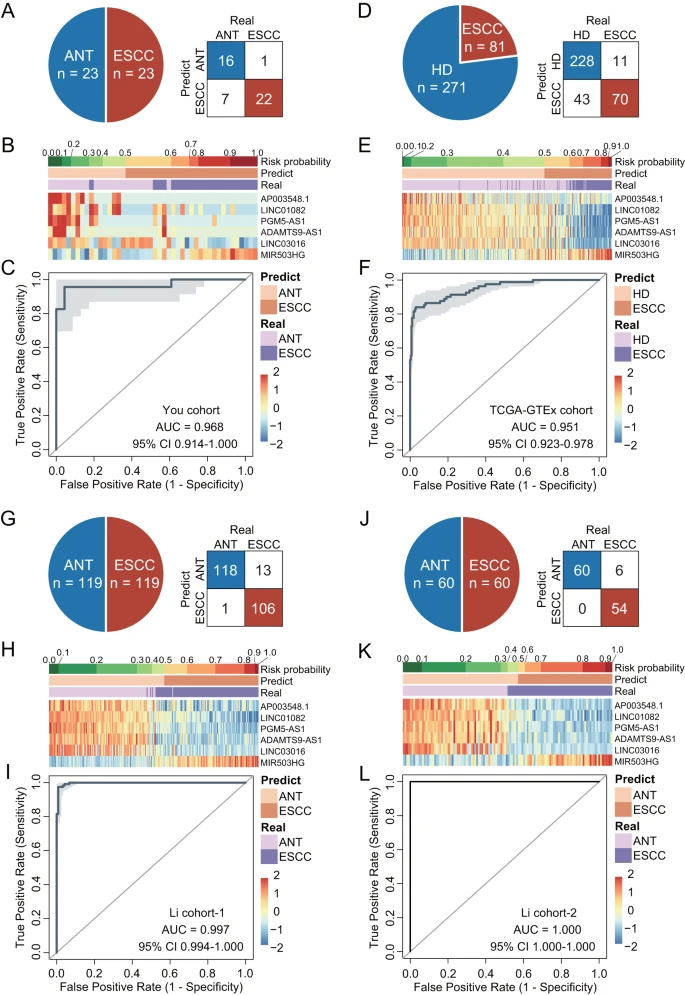
图4. MLMRPscore的独立验证结果。
早期肿瘤诊断对于降低死亡率和改善ESCC预后至关重要。因此,研究团队将患者分为I期、II期(早期)和III期、IV期(晚期),并评估了MLMRPscore的早期诊断性能。结果显示,MLMRPscore在区分早期I和II ESCC病例与正常对照方面也显示出优异的诊断性能。在内部队列中,MLMRPscore的AUC为1.000、0.973;外部队列中,AUC为1.000、0.944、0.999及1.000。这些发现共同证明,MLMRPscore可作为一种有前途的早期诊断工具。
为探索基于组织的lncRNA生物标志物的无创潜力,研究团队检测了CAMS队列中6个lncRNA生物标志物的表达水平,发现其中有5个显示出一致的表达失调模式。通过将这5个lncRNA生物标志物与常规肿瘤标志物(SCC-Ag、CEA和CYFRA21-1)的诊断性能进行比较,发现lncRNA生物标志物在识别ESCC或皮内瘤变患者方面表现出更优越或相当的诊断准确性。上述结果表明,lncRNA生物标志物可能具有作为ESCC早期检测的非侵入性工具的潜力。
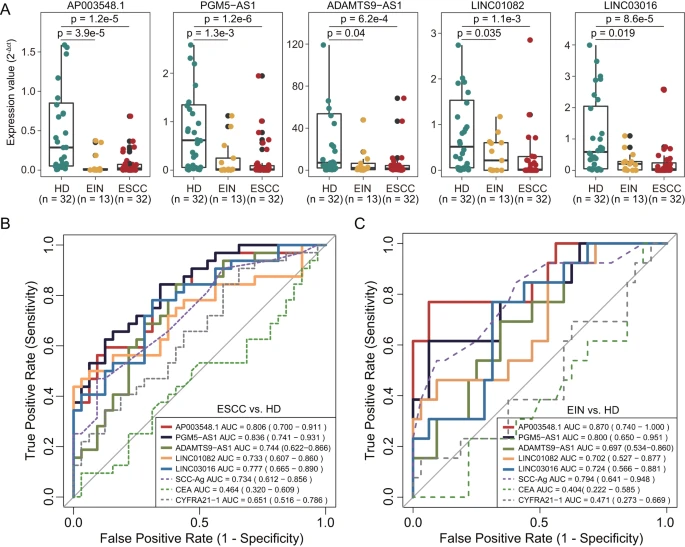
图5. lncRNA生物标志物在血浆队列中的表现。
最后,为评估lncRNA生物标志物的临床益处,研究团队进行了DCA曲线分析,以确定将lncRNA生物标志物纳入临床决策是否利大于弊。分析结果显示,在一定阈值概率范围内,lncRNA生物标志物净受益更高。这些结果表明,与对所有病例进行干预或不干预相比,lncRNA生物标志物有可能通过降低物理伤害和误诊的风险,提供更大的临床获益。
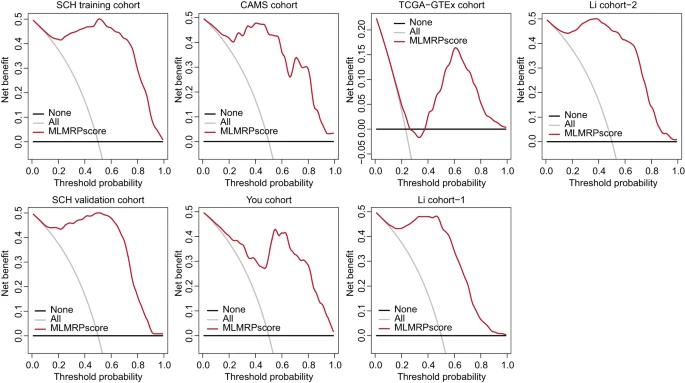
图6. lncRNA生物标志物比现有筛选方法具备实质性的优势。
综上所述,研究团队利用系统、多中心、跨平台的临床生物标志物发现和验证框架,开发了一个稳定而强大的多lncRNA诊断特征(MLMRPscore),能够准确识别ESCC患者,包括临床队列中的早期肿瘤,并在不同的独立队列中对其进行了验证。基于MLMRPscore的5种循环lncRNA在识别ESCC和EIN患者方面表现出稳健的性能,为未来无创ESCC检测方法奠定了基础。
参考文献:
Zhou, M., Bao, S., Gong, T. et al. The transcriptional landscape and diagnostic potential of long non-coding RNAs in esophageal squamous cell carcinoma. Nat Commun 14, 3799 (2023). https://doi.org/10.1038/s41467-023-39530-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













