论著|rh-CSF1改善缺糖缺氧损伤神经元线粒体功能和细胞凋亡
14小时前 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于陕西省
本研究在以往研究基础上进一步通过OGD损伤细胞模型,探讨rh-CSF1对神经元线粒体功能、氧化应激反应及细胞凋亡的影响,进一步明确rh-CSF1改善神经元损伤的分子机制。
摘 要
目的 探讨集落刺激因子-1(colony stimulating factor-1,CSF1)抑制氧糖剥夺(oxygen-glucose deprivation,OGD)神经元凋亡的作用机制。
方法 采用大鼠原代大脑皮质神经元,分为OGD损伤神经元模型组(OGD组,n=3)、重组人CSF1(recombined human CSF1,rh-CSF1)干预组(rh-CSF1组,n=3)、对照组(n=3)。测定3组神经元凋亡率和其中三磷酸腺苷(adenosine triphosphate, ATP)含量,活性氧簇水平、线粒体膜电位和线粒体脱氧核糖核酸(deoxyribonucleic acid,DNA)拷贝数,检测线粒体内丙二醛含量和超氧化物歧化酶活性。
结果 OGD组模型进行基线评估,结果示神经元凋亡率、活性氧簇、线粒体内丙二醛水平、线粒体膜电位、线粒体DNA拷贝数、ATP含量、线粒体内超氧化物歧化酶活性与对照组有统计学差异 (P<0.01)。rh-CSF1干预可提高OGD损伤后神经元的线粒体膜电位(0.55±0.03 vs. 0.43±0.06,P<0.01)、线粒体DNA拷贝数(0.88±0.05 vs. 0.72±0.06,P<0. 05)、ATP含量[(15.70±0.99)mmol/mg vs.(11.70±1.00)mmol/mg,P<0. 01)]和线粒体内超氧化物歧化酶活性[(18.47±1.38)U/mg vs. 14.78±1.81)U/mg,P<0.05)],降低活性氧簇(3.64±0.21 vs. 4.45±0.33,P<0.05)和线粒体内丙二醛水平[(2.13±0.19)mmol/mg vs.(2.78±0.20)mmol/mg,P<0.05)],减轻神经元凋亡率。
结论 rh-CSF1可能通过改善线粒体功能、减轻氧化应激及抑制细胞凋亡,从而改善OGD诱导损伤神经元的受损程度。
关键词
集落刺激因子-1;缺糖缺氧;凋亡;氧化应激;线粒体功能;缺血性脑卒中
缺血性脑卒中主要与细胞凋亡、神经炎症、铁死亡、能量代谢障碍、自噬、兴奋性氨基酸毒性作用等多种病理机制相关[1-4]。线粒体将葡萄糖等有机物氧化生成三磷酸腺苷(adenosine triphosphate, ATP),为细胞提供能量,并在凋亡、氧化应激、Ca2+稳态等方面发挥重要功能[5-6]。因此,线粒体功能异常是缺血性脑卒中病理进程中的关键一环。集落刺激因子-1(colony stimulating factor-1,CSF1)是一种诱导造血干细胞分化成巨噬细胞或其他相关细胞类型的分泌型细胞因子。神经元氧糖剥夺(oxygen-glucose deprivation,OGD)模型是模拟体内缺血性脑损伤的经典细胞模型。我们在前期研究中发现重组人CSF1(recombined human CSF1,rh-CSF1)可以通过减轻氧化应激、神经炎症及神经元凋亡,改善OGD模型鼠的神经功能损伤,减少脑梗死面积[7-8]。本研究在以往研究基础上进一步通过OGD损伤细胞模型,探讨rh-CSF1对神经元线粒体功能、氧化应激反应及细胞凋亡的影响,进一步明确rh-CSF1改善神经元损伤的分子机制。
1 材料与方法
1.1 研究对象
出生24 h内的Sprague-Dawley大鼠幼崽(乳鼠,16~22 g)80只,饲养在贵州医科大学实验动物中心[SYXK(黔)2018-0001]。饲养环境受控为温度(21±2)℃,相对湿度55%±5%,12 h光照/黑暗交替。实验期间,幼鼠可以随意获取母乳。实验程序均按照美国国立卫生研究院实验动物护理和使用指南进行,并经贵州省人民医院动物伦理委员会审核批准(批号:2021-2024)。主要试剂:高糖和无糖杜氏改良Eagle培养基(Dulbecco’s modified eagle medium,DMEM)(Gibco,美国);胎牛血清(Gibco,美国);胰蛋白酶(上海碧云天生物技术有限公司,中国);B27(Gibco,美国);Neurobasal培养基(Gibco,美国);L-谷氨酰胺(Gibco,美国);无糖Earle’s平衡盐溶液和阿糖胞苷(Sigma-Aldrich,美国);人微管相关蛋白2(human microtubule-associated protein 2,MAP2)一抗(Proteintech 17490-1-AP,中国);荧光二抗(Proteintech,中国);Annexin V -FITC流式凋亡试剂盒(杭州联科生物技术股份有限公司,中国);rh-CSF1(北京义翘神州科技股份有限公司,中国);细胞线粒体分离试剂盒、ATP检测试剂盒、活性氧簇(reactive oxygen species,ROS)检测试剂盒、JC-1线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒和BCA(bicinchoninic Acid,BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,中国);超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒和丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程研究所,中国);DNA提取试剂盒和qPCR SYBR Green Master Mix试剂盒(南京诺唯赞生物科技股份有限公司,中国)。引物设计和合成由上海碧云天生物技术有限公司完成。
1.2 方法
1.2.1 OGD神经元损伤模型构建及rh-CSF1干预处理 从乳鼠中分离、消化获得原代SD大鼠皮质神经元用于体外实验。经MAP2免疫染色鉴定后,使用三气培养箱和无糖DMEM培养基建立OGD损伤神经元细胞模型[7]。将原代神经元分为3组,每组重复次数3次。对照组,正常高糖DMEM培养基培养1 h后更换为含DMSO的Neurobasal培养基继续培养24 h;OGD组,在无氧环境中使用无糖DMEM培养基培养1 h后更换为含DMSO的Neurobasal培养基继续培养24 h;rh-CSF1组,在无氧环境中使用无糖DMEM培养基培养1 h后更换为含50 mg/L rh-CSF1的Neurobasal培养基继续培养24 h。
1.2.2 流式细胞检测凋亡 6孔板培养原代神经元,处理后胰酶消化细胞,转移细胞到离心管内,2000 r/min离心5 min,弃上清,使用PBS重悬细胞并计数。取约10万重悬细胞,2000 r/min离心5 min,弃上清,加入Annexin V-FITC结合液重悬细胞,随后先后加入Annexin V-FITC溶液和碘化丙啶染色液,混匀后室温避光孵育10 min,进行流式细胞仪检测。细胞凋亡流式图中十字坐标划分的4个区域:UL 区为细胞坏死、LL 区为细胞存活、LR 区为早期凋亡、UR 区为晚期凋亡,凋亡率(%)=LR区+UR 区。
1.2.3 MMP检测 6孔板培养原代神经元,处理后收集细胞,1500 r/min离心5 min,用含血清和酚红的细胞培养液重悬;加入JC-1 染色工作液,37 ℃孵育20 min;1500 r/min 4 ℃离心4 min,沉淀细胞,用JC-1染色缓冲液洗涤细胞;流式细胞仪检测 JC-1单体和JC-1聚合物。
1.2.4 细胞内ATP水平检测 收集细胞,裂解后16000 r/min离心10 min,取上清,按照ATP检测试剂盒说明书中操作步骤使用酶标仪检测光密度值,BCA蛋白浓度试剂盒测定各组培养液蛋白浓度,计算出各组细胞内ATP水平。
1.2.5 qPCR检测线粒体 DNA 拷贝数 6孔板培养原代神经元,处理后收集细胞,收集DNA,qPCR检测线粒体基因MT-ND1(正向引物5'-GGCTATATACAACTACGCAAAGGC-3',反向引物 5'-GGTAGATGTGGCGGGTTTTAGG-3')和参考基因ACTB(正向引物5'-TCACCCACACTGTGCCCATCTACGA-3',反向引物 5'-TCGGTGAGGATCTTCATGAGGTA-3')DNA的Ct值,以2-ΔΔCt代表线粒体DNA拷贝数。反应体系:2×SYBR Green Master Mix 10 μL,10 μmol/L引物各0.4 μL,DNA样本2 μL,去离子水6.8 μL,共20 μL。采用标准的扩增程序,95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,共40个循环。
1.2.6 ROS检测 6孔板培养原代神经元,处理后收集细胞,加入含10 μmol/L DCFH-DA的无血清培养基,37 ℃孵育20 min后离心,洗涤细胞3次,再用PBS重新悬浮进行荧光测定,按照FITC荧光检测条件测定。
1.2.7 细胞线粒体的提取分离及线粒体SOD及MDA检测 收集细胞,按照细胞线粒体分离试剂盒操作,将得到的线粒体按照SOD和MDA试剂盒说明书操作,检测各组线粒体内SOD酶活性和MDA水平。
1.3 统计学方法 应用SPSS 22. 0进行统计分析,以均数±标准差(x±s)表示计量资料。使用单因素方差分析进行组间比较,事后检验应用LSD法。检验水准α=0.05。
2 结果
2.1 神经元的培养及鉴定 培养1 d的神经元呈圆形或椭圆形,有1~2个突触(图1A);培养6 d的神经元胞体增大,出现一个由神经突触形成的网状结构(图1B)。在7 d原代培养的细胞中,MAP2免疫组织化学染色鉴定为神经元(图1C)。
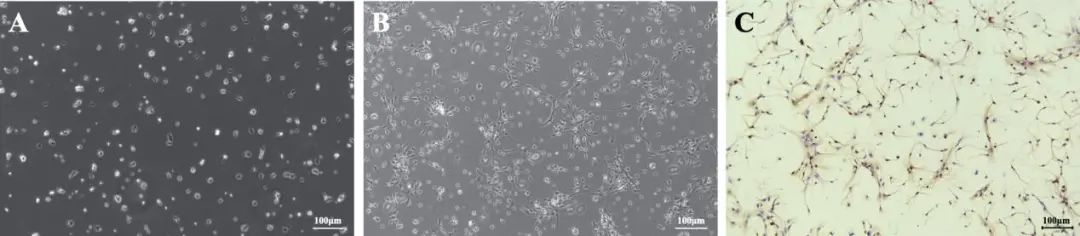
图1 神经元的培养与鉴定 A:培养1 d的神经元;B:培养6 d的神经元;C:MAP2免疫组化鉴定神经元,标尺100 μm。Fig.1 Neuron culture and identification
2.2 rh-CSF1减轻OGD损伤神经元模型的细胞凋亡 各组间神经元凋亡率存在差异(F=144.829,P<0.001,图2)。其中OGD组神经元凋亡率较对照组明显增高[(17.04%±1.30%) vs.(4.92%±0.03%),P<0.001];rh-CSF1组与OGD组相比,受损神经元的凋亡率显著降低[(10.12%±0.79%) vs.(4.92%±0.03%),P<0.001]。
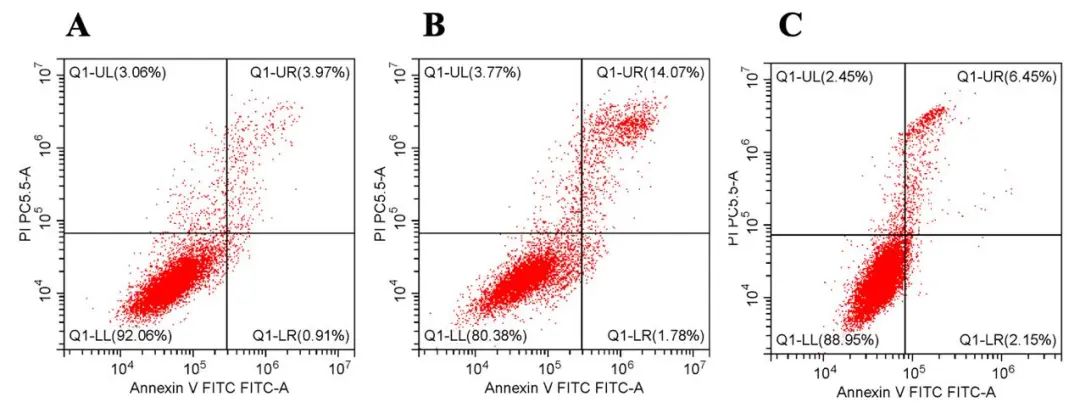
图2 rh-CSF1对OGD损伤神经元凋亡率的影响 A:对照组;B:OGD组;C:rh-CSF1组。Fig.2 Effect of rh-CSF1 on the apoptosis rate of OGD-injured neurons
2.3 rh-CSF1改善OGD损伤神经元模型的线粒体功能 各组间MMP水平(F=16.314,P=0.004,图3)、线粒体DNA拷贝数(F=12.781,P=0.007)、ATP含量(F=54.130,P<0.001)存在差异。OGD组与对照组比较,OGD损伤后神经元细胞模型中MMP水平(0.43±0.06 vs. 0.60±0.01,P=0.001)、线粒体DNA拷贝数(0.72±0.06 vs. 1.05±0.12,P=0.002)和ATP含量[(11.70±1.00)mmol/mg vs. (22.18±1.64)mmol/mg,P<0.001]显著降低。rh-CSF1组与OGD组相比,rh-CSF1处理后MMP水平(0.55±0.03 vs. 0.43±0.06,P=0.008)、线粒体DNA拷贝数(0.88±0.05 vs. 0.72±0.06,P=0.049)及ATP含量[(15.70±0.99)mmol/mg vs.(11.70±1.00)mmol/mg,P=0.008] 增高。
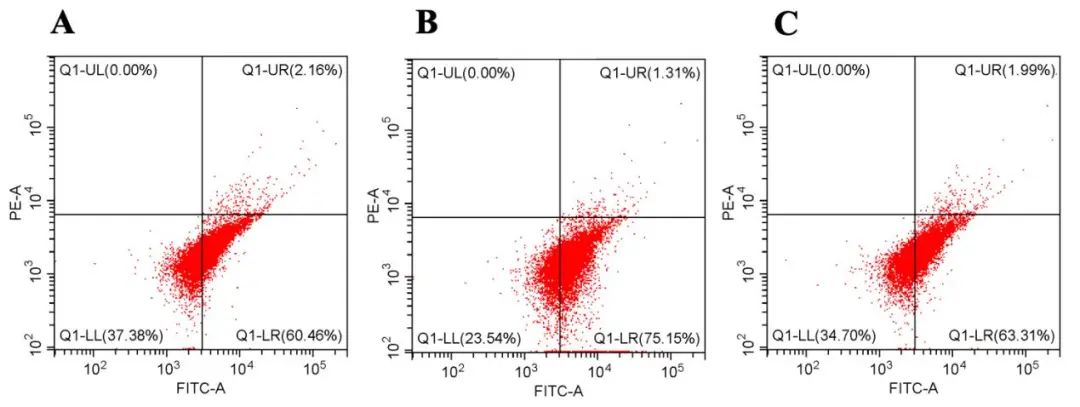
图3 rh-CSF1对OGD损伤神经元线粒体功能的影响 A:对照组的MMP检测结果;B:OGD组的MMP检测结果;C:rh-CSF1组的MMP检测结果。Fig.3 Effect of rh-CSF1 on mitochondrial function in OGD-injured neurons
2.4 rh-CSF1改善OGD损伤的神经元模型的氧化应激损伤 各组间ROS(F=14.008,P=0.005,图4)、线粒体内MDA水平(F=34.405,P=0.001)、线粒体内SOD水平(F=14.623,P=0.005)存在差异。OGD组与对照组比较,OGD损伤后的神经元细胞模型中ROS(4.45±0.33 vs. 2.73±0.56,P=0.002)和线粒体内MDA水平[(2.78±0.20)mmol/mg vs. (1.61±0.13)mmol/mg,P<0.001]升高,而线粒体内SOD水平[(14.78±1.81)U/mg vs. (21.95±1.65)U/mg,P=0.002]下降。rh-CSF1组与OGD组相比,rh-CSF1处理后, ROS(3.64±0.21 vs. 4.45±0.33,P=0.046)和线粒体内MDA水平[(2.13±0.19)mmol/mg vs. (2.78±0.20)mmol/mg,P=0.004]降低,而线粒体内SOD水平[(18.47±1.38)U/mg vs. (14.78±1.81)U/mg,P=0.032]升高。
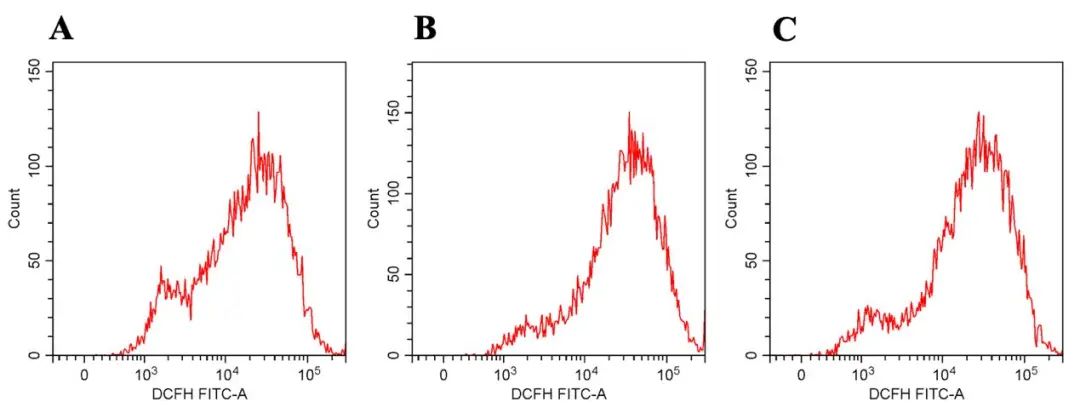
图4 rh-CSF1对OGD损伤神经元氧化应激反应的影响 A:对照组的线粒体内ROS检测结果;B:OGD组的线粒体内ROS检测结果;C:rh-CSF1组的线粒体内ROS检测结果。Fig.4 Effect of rh-CSF1 on oxidative stress response of OGD-injured neurons
3 讨论
缺血性脑卒中发病机制十分复杂,能量代谢障碍、钙超载、细胞凋亡、自噬、炎症反应和大脑类淋巴系统异常等共同参与了病理生理过程[2,9]。探究影响缺血性脑卒中的发病机制及找到有效的干预靶点,对改善缺血性脑卒中患者的临床疗效及预后至关重要。基于既往研究,改善神经元线粒体功能可能减轻缺血性脑卒中后神经元损伤,从而减轻神经功能缺损[10-11]。本研究通过rh-CSF1干预OGD损伤细胞模型,进一步明确rh-CSF1减轻缺血性脑卒中后神经元损伤的作用机制。本研究发现OGD组与对照组神经元相比,OGD组神经元中线粒体膜电位、线粒体DNA拷贝数、ATP含量和线粒体内SOD活性降低,ROS水平、线粒体内MDA水平和凋亡率增高,提示OGD导致神经元发生氧化应激反应,损伤线粒体功能,发生细胞凋亡。这一结果可能是由于缺血性脑卒中后ROS水平增高,当高于抗氧化防御系统清除速度时,就会发生氧化应激,使得线粒体膜电位降低,导致线粒体膜间隙中的蛋白(AIF、Cyto C等)释放,促进神经元凋亡[12]。这一结果也与其他研究一样,证实了线粒体功能障碍在缺血性脑卒中的病理过程中起着至关重要的作用[13-14]。CSF1是一种诱导造血干细胞分化为巨噬细胞或其他相关细胞类型的分泌型细胞因子。在大脑中,CSF1主要由先天免疫细胞(星形胶质细胞、小胶质细胞和少突胶质细胞)表达[15-16]。研究发现,敲除CSF1后小鼠骨细胞发生凋亡,氧化应激加重骨细胞死亡,CSF1可以通过减轻氧化应激维持骨细胞的稳态[17]。本研究则发现,rh-CSF1干预OGD损伤神经元模型可改善受损神经元的线粒体功能,观察到rh-CSF1干预OGD损伤神经元模型中线粒体DNA拷贝数、线粒体膜电位、ATP水平增加,同时,ROS及线粒体内SOD水平降低,线粒体内MDA含量增加,提示rh-CSF1通过改善线粒体功能,从而减轻神经元受损后的氧化应激反应。本课题组在前期研究工作中还发现在缺血缺氧性脑病模型鼠中,CSF1可通过减轻神经炎症反应及细胞凋亡,改善的神经功能缺损及脑梗死面积 [7-8],在细胞实验中也发现CSF1可以影响OGD损伤神经元的凋亡相关蛋白水平[18]。本研究进一步在细胞模型中证实rh-CSF1干预可抑制OGD损伤后神经元模型的细胞凋亡。放眼于CSF1的研究发现CSF1在多种神经系统疾病中发挥重要神经保护作用:如CSF1可通过减轻神经炎症改善创伤后脑损伤动物模型的认知功能障碍[19];研究发现CSF1可诱导CD11c+小胶质细胞增多,改善实验性自身免疫性脑脊髓炎的神经功能缺损并减少脱髓鞘程度[20];CSF1还能降低阿尔茨海默病转基因小鼠模型的神经元损伤,从而改善该模型的认知功能障碍[21]。因此,对于CSF1在神经系统多种疾病中的神经保护作用,值得未来进一步在各种疾病中展开深入探究,为临床神经系统疾病的治疗提供更多的理论依据。本研究结果则为CSF1作为缺血性脑卒中治疗新靶点提供了有力的实验证据。
参考文献:
1. BAYRAKTUTAN U. Endothelial progenitor cells: potential novel therapeutics for ischaemic stroke[J]. PharmacolRes,2019,144:181-191.
2. WANG Y, JUN YUN H, DING Y, et al. Montelukast sodium protects against focal cerebral ischemic injury by regulating inflammatory reaction via promoting microglia polarization[J]. Brain Res, 2023,1817: 148498.
3. AJOOLABADY A,WANG S,KROEMER G,et al. Targeting autophagy in ischemic stroke: From molecular mechanisms to clinical therapeutics[J]. Pharmacol Ther, 2021, 225: 107848.
4. HU X, BAO Y, LI M, et al. The role of ferroptosis and its mechanism in ischemic stroke[J]. Exp Neurol, 2024, 372: 114630.
5. SHE R,LIU D,LIAO J,et al. Mitochondrial dysfunctions induce PANoptosis and ferroptosis in cerebral ischemia/reperfusion injury: from pathology to therapeutic potential[J]. Front Cell Neurosci, 2023, 17: 1191629.
6. HAO P, ZHANG J, KUAI J, et al. TAT-PEP Alleviated Cognitive Impairment by Alleviating Neuronal Mitochondria Damage and Apoptosis After Cerebral Ischemic Reperfusion Injury[J]. Mol Neurobiol, 2023, 60(10): 5655-5671.
7. HU X, LI S, DOYCHEVA D M, et al. Rh-CSF1 Attenuates Oxidative Stress and Neuronal Apoptosis via the CSF1R/PLCG2/PKA/UCP2 Signaling Pathway in a Rat Model of Neonatal HIE[J]. Oxid Med Cell Longev, 2020, 2020: 6801587.
8. HU X, LI S, DOYCHEVA D M, et al. Rh-CSF1 attenuates neuroinflammation via the CSF1R/PLCG2/ PKCε pathway in a rat model of neonatal HIE[J]. J Neuroinflammation, 2020, 17(1): 182.
9. 古锦敏, 肖佩仪, 邢世会. 大脑类淋巴系统与脑卒中研究进展[J]. 中国神经精神疾病杂志, 2021, 47(2):109-112.
10. SONG M, ZHOU Y, FAN X. Mitochondrial Quality and Quantity Control: Mitophagy Is a Potential Therapeutic Target for Ischemic Stroke[J]. Mol Neurobiol, 2022, 59(5): 3110-3123.
11. AN H, ZHOU B, JI X. Mitochondrial quality control in acute ischemic stroke[J]. J Cereb Blood Flow Metab, 2021, 41(12):3157-3170.
12. LI Y, LI X, XU S, et al. 1,25-D3 attenuates cerebral ischemia injury by regulating mitochondrial metabolism via the AMPK/AKT/GSK3β pathway[J]. Front Aging Neurosci, 2022, 14: 1015453.
13. LI Y, WANG Y, YANG W, et al. ROS-responsive exogenous functional mitochondria can rescue neural cells post-ischemic stroke[J]. Front Cell Dev Biol, 2023, 11: 1207748.
14. WEN B, XU K, HUANG R, et al. Preserving mitochondrial function by inhibiting GRP75 ameliorates neuron injury under ischemic stroke[J]. Mol Med Rep, 2022, 25(5): 165.
15. DE I, MAKLAKOVA V, LITSCHER S, et al. Microglial responses to CSF1 overexpression do not promote the expansion of other glial lineages[J]. J Neuroinflammation, 2021, 18(1): 162.
16. CHITU V, BIUNDO F, STANLEY ER. Colony stimulating factors in the nervous system[J]. Semin Immunol, 2021, 54: 101511.
17. WERNER S L,SHARMA R, WOODRUFF K, et al. CSF-1 in Osteocytes Inhibits Nox4-mediated Oxidative Stress and Promotes Normal Bone Homeostasis[J]. JBMR Plus, 2019, 4(7): e10080.
18. 司玮, 杨媛媛, 刘蕊, 等. 集落刺激因子-1通过CSF1R/ PLCG2/ERK/Nrf2信号通路减轻缺血缺氧性脑病大鼠神经元凋亡的观察研究[J]. 中国病理生理杂志, 2022, 38(2): 267-275.
19. LI L, YERRA L, CHANG B, et al. Acute and late administration of colony stimulating factor 1 attenuates chronic cognitive impairment following mild traumatic brain injury in mice[J]. Brain Behav Immun, 2021, 94: 274-288.
20. WLODARCZYK A, BENMAMAR-BADEL A, CÉDILE O,et al. CSF1R Stimulation Promotes Increased Neuroprotection by CD11c+ Microglia in EAE[J]. Front Cell Neurosci, 2019, 12: 523.
21. LUO J, ELWOOD F, BRITSCHGI M, et al. Colony-stimulating factor 1 receptor (CSF1R) signaling in injured neurons facilitates protection and survival[J]. J Exp Med, 2013, 210(1): 157-172.
【引用格式】刘蕊,范宽,张鹏举,等. rh-CSF1改善缺糖缺氧损伤神经元线粒体功能和细胞凋亡[J]. 中国神经精神疾病杂志,2024,50(8):489-494.
【Cite this article】LIU R,FAN K,ZHANG P J,et al.The rh-CSF1 improves mitochondrial function and cell apoptosis in neurons under oxygen-glucose deprivation[J]. Chin J Nervous Mental Dis,2024,50(8):489-494.
DOI:10.3969/j.issn.1002-0152.2024.08.006
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#氧化应激# #缺血性脑卒中# #线粒体功能# #集落刺激因子-1# #缺糖缺氧#
6