重磅!BNT162b2 mRNA新冠疫苗复必泰2期临床试验结果发布
2022-05-31 MedSci原创 MedSci原创
此次研究结果对于评估mRNA新冠疫苗在中国大陆人群中免疫原性和安全性具有里程碑意义。
5月19日,BNT162b2 mRNA新冠疫苗2期临床研究的结果发布在柳叶刀预印本平台(Preprints with THE LANCET)[1]。这是首个发布的mRNA新冠疫苗在中国人群中进行的2期临床研究数据。试验结果首次证明,间隔21天接种2剂BNT162b2在健康或患有稳定的基础疾病的中国成年人中可诱导强烈的免疫应答,并且安全性良好。
mRNA疫苗已在全球100多个国家和地区用于新冠肺炎的预防接种,但在我国仅在港澳台地区紧急使用或正式批准,大陆还没有获批使用的mRNA疫苗。因此此次研究结果对于评估mRNA新冠疫苗在中国大陆人群中免疫原性和安全性具有里程碑意义。
这项试验采用随机、双盲、安慰剂对照的研究设计,由江苏省疾病预防控制中心主导执行。在2020年12月5日至2021年1月9日期间招募了959例18-85岁中国受试者。受试者按年龄分为2组(18-55岁和56-85岁),并以3:1的比例随机接种2剂BNT162b2(30μg)或安慰剂(BNT162b2组720例;安慰剂组239例)。
值得关注的是,研究中有5.1%的受试者至少患有一种Charlson合并症指数疾病,如糖尿病、脑血管疾病及慢阻肺等,还包括了11.6%的肥胖受试者。这些人群也被定义为“风险受试者”,并分析了该人群对BNT162b2的免疫原性反应及相关不良反应。
此次发布的数据是随访至第2剂接种后1个月的分析结果:
BNT162b2可诱导强烈的免疫应答
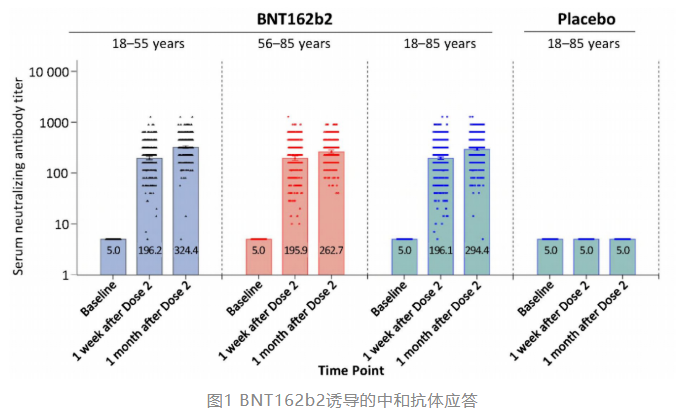
在活病毒微量中和试验中,所有接种2剂BNT162b2受试者均显示出较强的中和抗体应答,50%中和抗体GMT为294.4(95%CI;281.1-308.4)。在两个年龄组中,第二剂接种后1个月的中和抗体水平均高于接种后1周。老年组在第二剂接种后1个月的中和抗体水平低于年轻组(图1)。BNT162b2组的血清阳转率接近100%(18-55岁:99.2%;56-85岁:98.8%)。
这项试验中BNT162b2诱导的中和抗体水平与之前开展的两项1/2期临床试验结果一致[2,3],在全球关键2/3临床试验中,BNT162b2诱导的抗体应答转化为对COVID-19的95%有效性[4]。
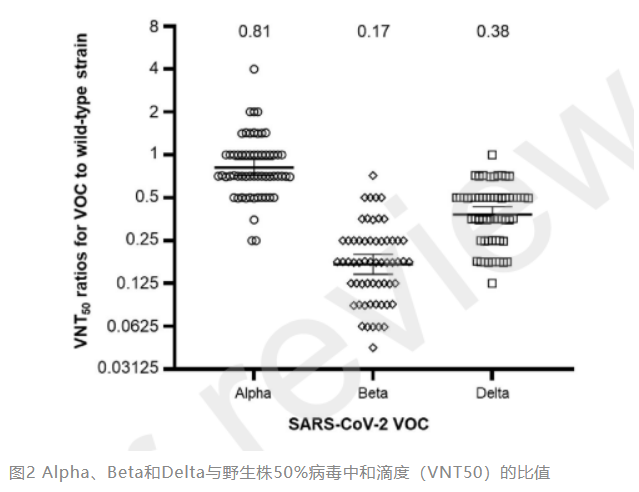
研究者还开展了针对VOC变异株的交叉中和试验。第2剂接种后1个月,BNT162b2受试者血清均可有效中和Alpha、Beta和Delta变异株。受试者血清对Alpha变异株的中和抗体水平较野生株略微降低,但对Beta和Delta变异株的降低更为显著。与野生株相比,Alpha、Beta和Delta变异株的50%中和抗体比值分别为0.81、0.17和0.38(图2)。
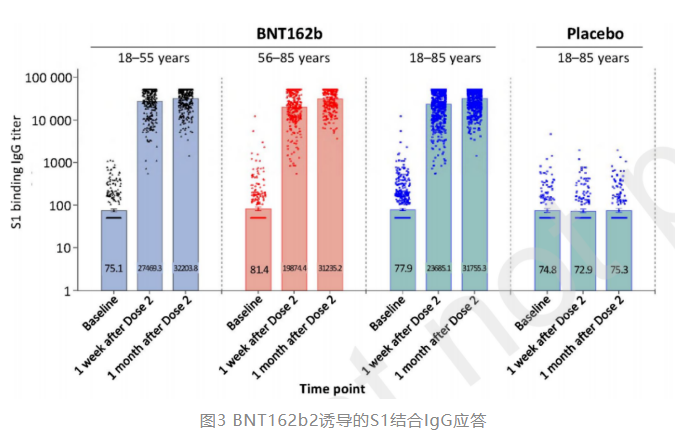
在诱导S1结合IgG抗体方面,BNT162b2组同样诱导了更高的S1结合IgG抗体滴度达到31755.3(图3)。两个年龄组均观察到S1结合IgG抗体与中和抗体滴度呈正相关。
研究者采集了74例BNT162b2受试者血样探索其诱导的T细胞免疫应答。在第2剂接种后一周,BNT162b2受试者中检测到强烈的S特异性T细胞应答。当用包含S蛋白S1(氨基酸1-633)和S2(氨基酸634-1273)有重叠的肽池刺激细胞时,每10万个外周血单核细胞(PBMC)的IFNγ斑点计数几何平均值分别为73.5和73.7,高于阳性对照的回忆抗原(CEF)肽池的响应(16.9)(图4)。在两个年龄组中均引起强烈的IFNγ反应,大多数(79.5%)BNT162b2受试者的T细胞应答为阳性。

BNT162b2安全性良好
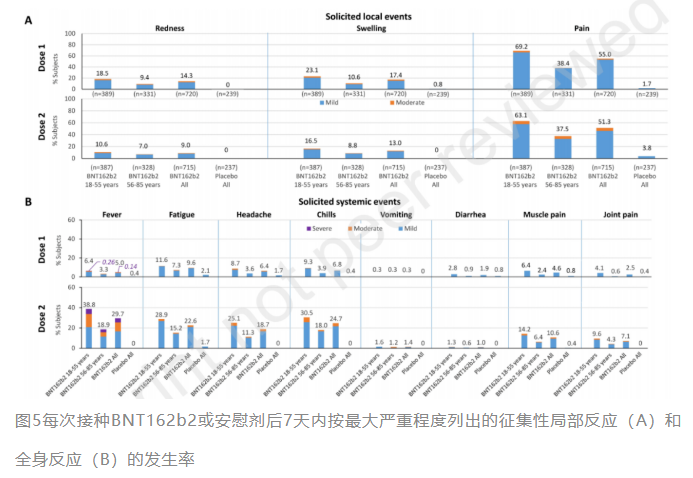
作为新的疫苗技术路线,mRNA疫苗的安全性一直以来备受关注。本研究结果显示BNT162b2的反应原性与全球关键性2/3期试验中观察到的一致[4]。每剂接种后7天内BNT162b2受试者的征集性局部和全身事件比安慰剂接种者更常见。年轻组比老年组更常见。在非风险人群中的发生率更高。
BNT162b2受试者每剂接种后7天内报告的所有征集性局部事件均为轻度或中度,第1剂接种后的发生率高于第2剂,注射部位疼痛最为常见。征集性局部事件均为一过性,在接种后7-14天之间,仅报告了2例疼痛的局部反应。
绝大多数7天内发生的征集性全身性事件与接种相关且严重程度为轻度或中度。大多数为一过性在1-3天内消失,接种后7-14天很少发生(BNT162b2组2例,安慰剂组3例)。与局部事件相反,第2剂接种后比第1剂发生率更高或更严重。
发热是最常见的征集性全身事件,但出现3级发热的BNT162b2受试者很少,且大多为一过性。对于镇痛药/退烧药的使用,第2剂接种后多于第1剂,18-55岁接种组也多于56-85岁组。与全球关键性2/3期试验发热率相比,本研究中有一定程度的升高,这有可能与发热的分级标准不一致有关。本研究采用中国NMPA分级标准和/或美国FDA分级标准对不良事件进行分级,而全球关键性2/3期试验仅采用美国FDA分级标准[4]。
第2剂接种后1个月内,非征集性不良事件的发生频率相对较低(BNT162b2:11.0%vs安慰剂:8.0%)。未报告与BNT162b2或安慰剂相关的死亡、3级非征集性不良事件或严重不良事件。也未报告BNT162b2相关心脏疾病、心肌炎、心包炎或过敏反应病例。本试验受试者的安全性数据采集将持续至第二次接种后12个月。
总体来说,这项在中国人群中进行的第一项mRNA疫苗2期试验中,BNT162b2可以诱导强烈的SARS-CoV-2中和抗体和特异性T细胞应答,2剂接种后1个月内安全性耐受性良好,表明中国成年人接种BNT162b2预防新冠感染具有有利的风险-获益。此次发布的是第2剂接种后一个月的结果,后续会有更长期研究数据公布。
在应对不断变异的新冠病毒的过程中,mRNA疫苗有着快速研发生产的技术优势。目前国内外众多企业和科研机构都在进行mRNA疫苗的研发,期待有更多有效性和安全性研究数据的发表,也期待更多高效安全的疫苗可以作为我们抗击疫情的武器。
参考文献:
[1]Ai-Min H,Jing-Xin Li,Li Z,et al.Immunogenicity and Safety of BNT162b2 mRNA Vaccine in Chinese Adults:A Randomized Clinical Trial.Available at SSRN:https://ssrn.com/abstract=4114061
[2]Sahin U,Muik A,Vogler I,et al.BNT162b2 vaccine induces neutralizing
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#2期临床#
114
#重磅#
106