【论著】基于非增强CT的影像组学识别动脉致密征阴性的大脑中动脉闭塞的初步研究
2024-06-17 中国脑血管病杂志 中国脑血管病杂志 发表于上海
基于NCCT的影像组学对于识别HAS阴性的急性单侧MCAO具有较好的诊断效能,该结论尚需多中心、大样本研究进一步验证。
摘要:目的 探究基于非增强CT(NCCT)的影像组学识别动脉致密征(HAS)阴性的急性单侧大脑中动脉闭塞(MCAO)的价值。 方法 回顾性连续纳入2015年1月至2023年6月就诊于扬州大学附属医院卒中中心或急诊科,经血管成像[MR血管成像(MRA)或CT血管成像(CTA)或DSA]检查证实的急性单侧MCAO且NCCT表现为HAS阴性的患者80例;在NCCT图像上以每例患者的患侧MCAO段及正常侧对应节段血管作为感兴趣区,共提取108个影像组学特征。使用最小绝对收缩和选择算子(LASSO)筛选关键特征,构建并计算出影像组学评分,分别建立支持向量机(SVM)、光梯度提升机(LightGBM)、梯度提升(GradientBoosting)及自适应提升(AdaBoost)4种影像组学模型以预测MCAO。通过受试者工作特征(ROC)曲线评价不同模型的预测效能,并使用Delong检验方法进行各模型ROC间的比较,最后通过临床决策曲线分析(DCA)评估影像组学模型的应用价值。 结果 基于160根血管的NCCT图像最终筛选出6个关键特征,分别为偏度、能量、 灰度大小区域矩阵(GLSZM)-灰度不均匀性、GLSZM-低灰度区域强调、GLSZM-尺寸区非均匀性标准化、GLSZM-区域熵。SVM模型测试集预测急性单侧MCAO的ROC曲线下面积为0.688 (95%CI:0.497~0.878),精确度为0.688;LightGBM 模型测试集的曲线下面积为0.787(95%CI:0.620~0.955),精确度为0. 781; GradientBoosting模型测试集的曲线下面积为0.654(95% CI:0.457~0.852), 精确度为0.688; AdaBoost模型测试集的曲线下面积为0.707(95% CI:0.515~0.899),精确度为0.750。Delong检验显示,LightGBM模型测试集与GradientBoosting模型测试集间的曲线下面积差异有统计学意义(P=0.040),余模型测试集间曲线下面积差异均无统计学意义(均P>0.05)。DCA显示,LightGBM模型表现较好。结论 基于NCCT的影像组学对于识别HAS阴性的急性单侧MCAO具有较好的诊断效能,该结论尚需多中心、大样本研究进一步验证。
急性缺血性卒中为神经系统常见疾病,亚裔人群中30%~50%的急性缺血性卒中与颅内大血管闭塞有关,尽早识别颅内大血管闭塞从而进行血管内治疗对于改善其预后至关重要。非增强CT(non-contrast computed tomography, NCCT)因操作简便、检查速度快且普及率高而常被用于急性卒中治疗前以排除脑出血等。基于NCCT显示的动脉致密征(hyperdense artery sign,HAS)可以提示颅内大动脉血栓闭塞,该征象对检测动脉内血栓具有很高的特异度(约95% ),但敏感度不高(约50% ), 即HAS阴性患者占有较高比例,其在肉眼上难以提示血管闭塞。因此,如何运用现代医学影像学技术提高HAS阴性患者动脉闭塞的识别率正成为研究的重要方向。影像组学是一种通过对医学影像进行 一阶和高阶图像特征提取和分析,以建立可能提高诊断、预后和预测准确性的研究方法,现有大量研究表明,利用影像组学方法可以提取肉眼难以识别的影像学特征,且有不少研究证实了其在脑血管病诊治领域应用的可行性。因此本研究拟应用影像组学探究HAS阴性的急性单侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)患者NCCT中肉眼难以识别的图像特征,以期为NCCT自动化判别MCAO提供客观影像学依据,实现MCAO所致急性缺血性卒中患者的尽早精准治疗,这对急性缺血性卒中的二级预防具有重要的意义。
1 对象与方法
1.1 对象
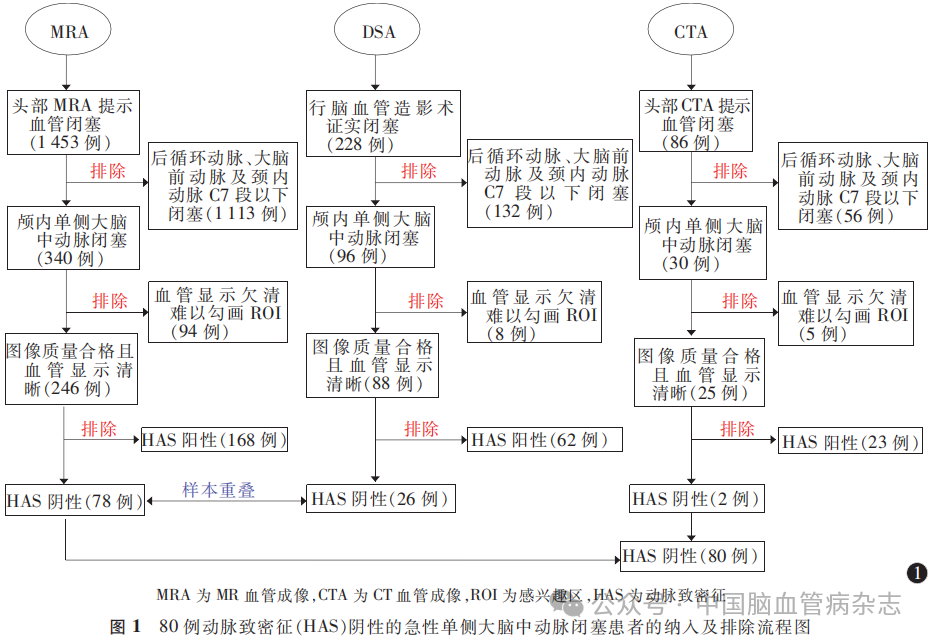
回顾性纳入2015年1月至2023年6月就诊于扬州大学附属医院卒中中心或急诊科的HAS 阴性的急性单侧MCAO连续性病例80 例。本研究方案经扬州大学附属医院伦理委员会批准[伦理审批号: 2022-YKL8-(课02)]。所有患者检查前签署诊疗知情同意书。
纳入标准:(1)年龄≥18岁;(2)患者急性起病, 并经影像学复查证实为急性缺血性卒中,其定义为局灶性脑缺血导致的突发性神经功能障碍或全面神经功能缺损,影像学出现责任病灶或症状、体征持续24h以上;(3)MR血管成像(MRA)和(或)CT血管成像(CTA)和(或)DSA检查证实单侧MCAO,表现为动脉显影中断且远端不显影;(4)出现此次症状的责任血管为影像学所证实的闭塞血管;(5)此次症状出现后24h内进行NCCT检查,且图像适于评估;(6)NCCT扫描与证实血管闭塞的血管成像检查时间间隔≤72h;(7)NCCT 与血管成像(MRA 或CTA或DSA)检查之间未行静脉溶栓或血管内开通等血流恢复治疗。
排除标准:(1)NCCT 图像层厚≥5mm 或闭塞血管显示欠清,难以评估。(2)NCCT上表现为HAS阳性(HAS被定义为比邻近或同等的对侧血管密度更高的动脉征象,其客观指标定义为排除其他病因的HAS段CT值与对侧血管密度差值> 7.55 HU或比值>1. 12;HAS阳性即大血管闭塞患者NCCT图像上存在HAS)。(3)血管闭塞位置位于颈内动脉C7段近端或大脑中动脉M3 段远端。
病例纳入与排除的具体流程见图1。
1.2 资料收集
收集所有患者的一般资料及临床和影像学资料,包括年龄、性别、病史(高血压病、糖尿病、高脂血症、冠心病)、个人史(吸烟史、饮酒史)、实验室检查[D-二聚体(正常参考值:<0.5mg/L)、纤维蛋白原(正常参考值:2.0~4.0g/L)、B型钠尿肽(正常参考值:<100pg/L)]、影像学图像(NCCT、DSA、CTA、MRA等)。
1.3 检查方法
所有患者的NCCT扫描由德国西门子Somatom Definition AS+128排螺旋CT及西门子第三代双源Force CT机完成;层厚为2.0~3.0mm,层数为36~56,管电压120kV,管电流270~450mA,矩阵512×512。
头部MR检查由德国西门子3.0TMR扫描仪完成,其主要应用序列包括:(1)MR T2液体衰减反转恢复(T2-FLAIR)序列。重复时间(time of repetition,TR) 7000ms,回波时间(time of echo,TE)94.0ms,平均值=1,视野(field of view, FOV) 220mm×100mm, 矩阵256×256, 层厚6.0mm。 (2)扩散加权成像。 TR4300ms, TE109ms,平均值=2, FOV=240mm×100mm, 层厚6.0mm。 (3)表观扩散系数。 三维时间飞跃法(three-dimensional time of flight, 3D-TOF) 图像, 最小TR20ms, 反相位下TE3.69ms, FOV=240mm×100mm, 矩阵320×256, 层厚0.7mm。
CTA检查由德国西门子第三代双源Force CT机完成;螺距为3.2,旋转时间0.25s,准直为192.0mm×0.6mm,强度为3级,管电压和管电流采用德国西门子自动调节技术,使用碘海醇注射液60ml为对比剂,采用Bolustracking方法静脉注射,流率4.5ml/s。
DSA检查由德国西门子AXIOM Artis dTADSA完成;常规穿刺右侧股动脉,置入5F或8F导管鞘,使用碘克沙醇注射液为对比剂行选择性脑血管造影。
1.4 图像分割
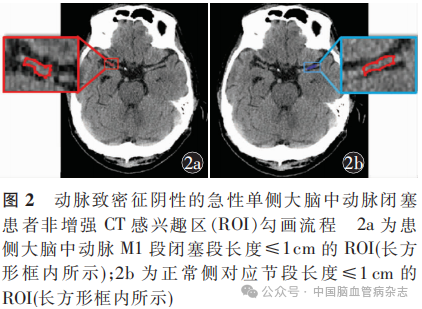
所有患者的NCCT图像由两名分别具有5、10年工作经验的放射科医师进行评估,二者意见不一致时协商决定感兴趣区(region of interest,ROI);使用ITK-SNAP软件(version3.8.0,www. itksnap. org)对照其相应的血管成像结果逐层勾画患侧MCAO段与正常侧血管对应节段长度≤1cm区域作为ROI,窗宽为80HU,窗位为40HU;将患侧(图2a)与正常侧(图2b)ROI分别命名并保存。
1.5 特征提取
使用PyRadiomics软件包(美国, 源代码:http://pyradiomics. readthedocs)的内部特征分析程序提取影像组学特征,该过程符合图像生物标志物标准化倡议。提取特征包括一阶特征和纹理特征,其中纹理特征主要包括灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度游程矩阵(gray level run length matrix,GLRLM)、灰度大小区域矩阵(gray level size zone matrix,GLSZM)、相邻灰度差矩阵(neighbouring gray tone difference matrix,NGTDM)和灰度相关矩阵(gray level dependence matrix,GLDM)特征。
1.6 特征选择与影像模型构建
采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)调节正则化的重要参数———惩罚系数(lambda,λ)来控制模型正则化的程度,只保留对目标变量影响较大的特征(即非零系数的关键特征),而将其他特征的系数变为零, 以提高模型对未知数据的预测能力(即泛化能力),筛选出预测MCAO的关键特征,并得到相应关键特征的加权和(即影像组学评分),以此计算出每个样本的预测得分。使用5折交叉验证方法将160个样本轮流作为训练集和验证集循环5 次,以验证模型对于HAS阴性MACO的预测能力。
使用scikit-learn软件包(法国,https:/ / scikit-learn. org)并从中分别选择了支持向量机(support vector machines,SVM)、光梯度提升机(light gradient boosting machine,LightGBM)、梯度提升(Gradient Boosting)及自适应提升(adaptive boosting, AdaBoost)4种不同类型的算法建立模型(其中SVM属于线性模型,是一种间隔最大化的分类器, 适用于小样本;LightGBM 属于树模型,是基于梯度提升决策树的高效算法,适用于高维特征;而Gradient boosting及AdaBoost 则属于集成学习模型, 分别通过迭代和加权训练多个分类器,以增强集成模型的性能),以平衡各自的优势,减少单一模型的过拟合风险,提高整体的预测准确性和泛化能力,并在模型的构建过程中找到一个最佳λ,在保证较小均方误差(mean-square error,MSE;即真实值与预测值之间的误差)的同时,获得更少的变量。
1.7 统计学分析
应用SPSS26.0 统计学软件分析处理数据,采用K-S方法进行计量资料的正态性检验,符合正态分布的计量资料以x- ± s表示,组间差异性比较采用两样本均数比较的t检验;非正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,组间差异性比较采用非参数秩和检验。分类变量以例数和百分比或率表示,组间差异性比较采用χ2 检验。使用受试者工作特征(receiver operating characteristic, ROC)曲线分析的曲线下面积(area under curve, AUC)评估模型的预测效能,根据约登指数确定ROC曲线的最佳截断值,并计算对应的敏感度、特异度、准确度、阳性预测值及阴性预测值。通过Delong检验进行各模型间的ROC曲线比较,以评价各模型间的差异性,以P<0.05为差异有统计学意义。最后采用临床决策曲线分析(decision curve analysis,DCA)计算预测模型在一定阈值概率范围内的净收益,以评价影像组学模型的临床应用价值。
2 结果
2.1 患者一般资料
共纳入80例患者,男48例,女32例;年龄35~89岁,平均(67±11)岁;其中患有高血压病患者66例(男/女=39/27),糖尿病患者45例(男/女=28/17),高脂血症患者47例(男/女=27/20);既往冠心病史14例(男/女=8/6),吸烟史18例(男/女=16/2),饮酒史12例(男/女=10/2);D-二聚体升高者27例(男/女=11/16),纤维蛋白原升高者8例(男/女=3/5),B型钠尿肽升高者14例(男/女=6/8)。
2.2 特征提取及筛选结果
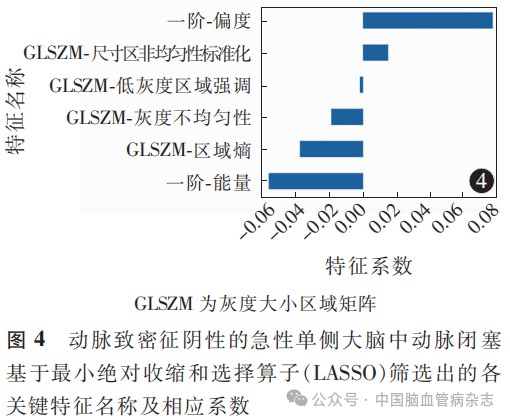
训练集中,从80例患者的动脉闭塞段及正常侧对应节段血管共160根血管的NCCT图像上共提取108个原始特征,随后通过LASSO最终得到6个非零系数的特征(图3a,3b),分别为偏度、能量、GLSZM-灰度不均匀性、GLSZM-低灰度区域强调、GLSZM-尺寸区非均匀性标准化、GLSZM-区域熵。最终生成影像组学评分(图4,5)。影像组学评分=0.5-0.055796×一阶-能量+0.076699×一阶-偏度-0.018756×GLSZM-灰度不均匀性-0.001889×GLSZM-低灰度区域强调+0.014849×GLSZM-尺寸区非均匀性标准化-0.037309×GLSZM-区域熵。


2.3 模型效能评价
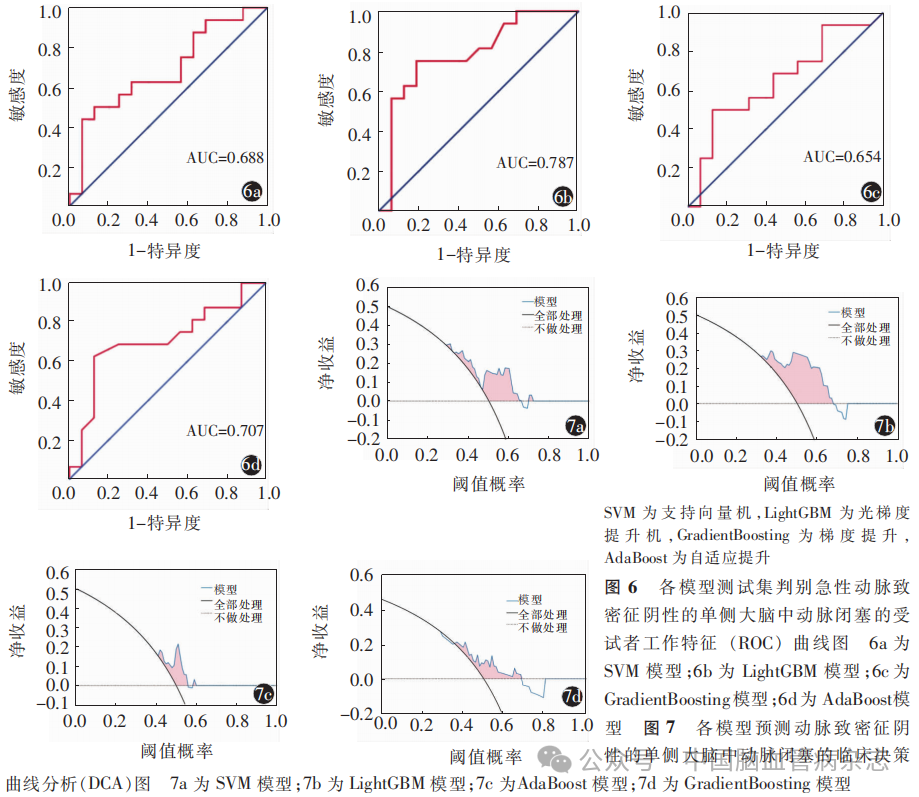
构建的4种预测HAS阴性急性单侧MCAO 的模型中,SVM训练集、测试集模型预测急性单侧MCAO AUC(95%CI)分别为0.833 (0.764~0.903)、 0.688(0.497~0.878)(图6a)。LightGBM 训练集、测试集模型预测急性单侧MCAO的AUC(95%CI)分别为0.851(0.787~0.916)、 0.787(0.620~0.955)(图6b)。GradientBoosting训练集、测试集模型预测急性单侧MCAO的AUC(95%CI)分别为0.969(0.944~0.993)、0.654(0.457~0.852)(图6c)。AdaBoost训练集、测试集模型预测急性单侧MCAO的AUC(95%CI)分别为0.861(0.799~0.924)、0.707(0.515~0.899)(图6d)。见表1。Delong 检验结果显示, LightGBM测试集与GradientBoosting测试集间AUC差异有统计学意义(Z=2.056,P=0.040);其他模型测试集间AUC差异均无统计学意义(均P>0.05)。
DCA 显示,采用影像组学方法尤其是LightGBM模型预测急性单侧MCAO 的临床净收益较高(图7)。
3 讨论
本研究结果显示,在急性单侧MCAO中表现为HAS阴性的血管存在可被提取的影像组学特征,且依此构建的影像组学模型具有较好的诊断效能,各模型结果也在内部数据集中得到验证。
本研究采用LASSO对有显著影响的特征进行筛选,保留了6 个关键特征来构建预测急性单侧MCAO分类模型。本研究纳入的关键特征为2种一阶特征与4种纹理特征,分别为偏度、能量、GLSZM-灰度不均匀性、GLSZM-低灰度区域强调、GLSZM-尺寸区非均匀性标准化、GLSZM-区域熵。其中偏度主要反映了数据平均值分布的不对称性;能量则是对图像中体素值大小的度量;以GLSZM为代表的纹理特征主要反映了测量区域内的可变性(图像纹理的异质性),较低值表示图像中区域之间的同质性更强。这些特征被最终选择为关键特征可能与闭塞血管内的异质性有关,其主要表现为血管闭塞段与正常血管间的成分差异。有研究表明,血栓衰减与红细胞含量呈正相关;亦有研究结果显示, 当血细胞比容升高(如脱水或吸烟)时部分患者会出现假阳性;当CT 切片较厚(≥5 mm)、部分容积效应或血栓富含纤维蛋白多于富含红细胞时亦可能会出现假阴性。因此我们认为,MCAO 发生后,不管是成分不同的血栓或斑块,还是血液瘀滞而导致血管局部形态发生细微的变化(走形僵直、局部变形等),闭塞段血管与对应正常血管间可能存在除HAS以外的差异,即在影像学上或可表现为纹理之间的差异。
既往研究主要探讨基于HAS 的NCCT 诊断MCAO的效能,少有提及表征为HAS阴性MCAO的相关研究。首先宋海锋等的研究结果表明,HAS是颅内大动脉梗死的超早期征象,亦是早期恶化的重要预测因素。其次Mair等和马健的研究结果则表明,HAS的高度特异性一定程度上可以替代血管造影诊断大血管闭塞,但其相对较低的敏感度提示HAS的缺失不能单独用来表明血管通畅;而Koo等及黄明珠等均进行了脑血管CT值定量评估对诊断颅内大血管闭塞效能的相关研究,表明HAS对于颅内大血管闭塞具有诊断价值,且得出了相对精确的最佳截断值,但鲜有研究关注NCCT上HAS阴性的闭塞血管的诊断。若是错误估计部分存在颅内大血管闭塞但却不显示HAS(即HAS 阴性)的患者病情的严重程度,未能及时进行静脉溶栓或血管内治疗,那么患者面对的将是不高的生活质量甚至是死亡等不良后果。本研究结果显示,各个HAS阴性MCAO预测模型训练集均达到了较好的AUC值(均> 0. 8),但测试集结果稍低,这可能是样本量较小所致;但本研究结果表明,HAS 阴性的MCAO与正常血管间存在可被提取为影像组学特征的差异。这表明HAS阴性的MCAO可通过影像组学方法甚至是深度学习方法识别。
本研究的不足和展望:首先,由于本研究纳入病例受主观判断的影响,存在取样偏差;其次,本研究样本量相对较小,患者人群来源相对单一;再次,本研究并未纳入大脑前动脉等其他细小血管,主要原因在于NCCT图像上其相对于全脑过小、与周围脑组织难以区分,且闭塞发病率相对于MCAO 较低, 这使得构建具有良好效能的预测模型存在极大挑战。因此未来尚需多中心、大样本研究进一步验证, 且期待未来经过大量数据优化或技术更新后,可以进一步开发人工智能软件实现自动提取特征、分割及预测HAS阴性的MCAO风险,以期在可疑患者行NCCT检查时初步提示血管闭塞概率,为其所致的急性缺血性卒中患者争取治疗时间,最终改善预后。
综上,本研究结果初步提示,基于NCCT的影像组学可以识别HAS阴性的急性MCAO并早期预测其风险概率,以缩短治疗前时间,对于急性缺血性卒中的二级预防具有重要的意义。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#动脉闭塞# #非增强CT# #动脉致密征#
37