Immunity:发现巨噬细胞识别危险细菌的蛋白“侦察兵”
2012-04-14 towersimper 生物谷
上百万个“好”细菌和谐地存在于健康人肠道内和皮肤上。当有害的细菌攻击时,免疫系统作出反击:派送白细胞去摧毁导致疾病的侵入者。但是白细胞如何辨别哪些细菌是好的以及哪些是坏的呢? 美国西北大学芬伯格医学院(Northwestern University Feinberg School of Medicine)风湿病学研究教授Christian Stehlik领导的研究小组研究了一种白细胞类型---巨
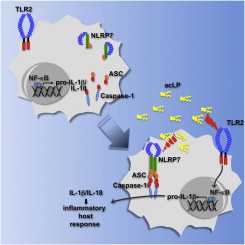
上百万个“好”细菌和谐地存在于健康人肠道内和皮肤上。当有害的细菌攻击时,免疫系统作出反击:派送白细胞去摧毁导致疾病的侵入者。但是白细胞如何辨别哪些细菌是好的以及哪些是坏的呢? 美国西北大学芬伯格医学院(Northwestern University Feinberg School of Medicine)风湿病学研究教授Christian Stehlik领导的研究小组研究了一种白细胞类型---巨噬细胞,在免疫系统中它最早检测并消灭有害细胞。他们发现蛋白NLRP7是巨噬细胞的“侦察兵(scout)”,能够侦别有害的革兰氏阳性细菌如金黄色葡萄球菌和单核细胞增生性李斯特菌(Listeria monocytogenes)细胞壁中的组分。2012年2月23日,这一发现发表在《细胞》子刊Immunity期刊上。 Stehlik与芬伯格医学院医学研究助理教授Andrea Dorfleutner、美国西弗吉尼亚州大学杰出教授Yon Rojanasakul紧密合作开展研究。Stehlik说,“NLRP7一种新的细胞内模式识别受体(pattern recognition receptor),它特异性地识别有害细菌细胞壁中被称作脂肽(lipopeptide)的组分。我们证实激活NLRP7是根除细菌感染所必需的,因为这种根除是通过形成被称作炎性体(inflammasome)的蛋白复合物进行的,而且炎性体含有NLRP7,能够让巨噬细胞释放出有活性的细胞因子IL-1β和IL-18 。” 芬伯格医学院博士后研究员和该研究论文第一作者Sonal Khare说,鉴定出这种蛋白分子是一种复杂的过程,因为巨噬细胞内蛋白家族非常庞大。她说,“总共存在22种可能性的候选分子。为了确定这些蛋白当中是哪一种能够识别巨噬细胞吞噬的细菌,我们不得不移除它们当中每一种蛋白。”通过这种排除过程,研究小组鉴定出NLRP7是所需的蛋白。 Stehlik说,这一发现非常有意义,因为它有助于人们更好地理解免疫系统如何识别诸如李斯特菌(Listeria)和葡萄球菌(Staphylococcus)之类的细菌。李斯特菌能够在未煮熟的肉、蔬菜和诸如哈蜜瓜之类的水果中发现。2011年,李斯特菌被列为美国过去十多年来最为致命性食物污染传染病暴发的原因。金黄色葡萄球菌感染是医院中最为常见的传染病,而且单在美国每年就有50万病人感染上葡萄球菌。耐甲氧西林金黄色葡萄球菌(Methicillin-Resistant Staphylococcus Aureus, MRSA)菌株对人们经常使用的抗生素产生高度耐药性。 理解免疫系统如何识别这些致命的入侵者可能有朝一日导致人们开发出对抗这些感染的新治疗策略。 “下一步与NLRP7和炎性体相关的研究正在开展中”,Stehlik说,“我们正在继续进行研究以便探索这种NLRP7炎性体如何形成的机制。我们想知道我们是否能够操纵这种过程以便使得这一免疫反应更加强烈些。我们也正准备探索利用模式小鼠在体内研究这种免疫反应。” (生物谷:towersimper编译)

doi:10.1016/j.immuni.2012.02.001
PMC:
PMID:
An NLRP7-Containing Inflammasome Mediates Recognition of Microbial Lipopeptides in Human Macrophages
Sonal Khare, Andrea Dorfleutner, Nicole B. Bryan, Chawon Yun, Alexander D. Radian, Lucia de Almeida, Yon Rojanasakul, Christian Stehlik
Cytosolic pathogen- and damage-associated molecular patterns are sensed by pattern recognition receptors, including members of the nucleotide-binding domain and leucine-rich repeat-containing gene family (NLR), which cause inflammasome assembly and caspase-1 activation to promote maturation and release of the inflammatory cytokines interleukin-1β (IL-1β) and IL-18 and induction of pyroptosis. However, the contribution of most of the NLRs to innate immunity, host defense, and inflammasome activation and their specific agonists are still unknown. Here we describe identification and characterization of an NLRP7 inflammasome in human macrophages, which is induced in response to microbial acylated lipopeptides. Activation of NLRP7 promoted ASC-dependent caspase-1 activation, IL-1β and IL-18 maturation, and restriction of intracellular bacterial replication, but not caspase-1-independent secretion of the proinflammatory cytokines IL-6 and tumor necrosis factor-α. Our study therefore increases our currently limited understanding of NLR activation, inflammasome assembly, and maturation of IL-1β and IL-18 in human macrophages.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Immunity#
63