Cell:癌症研究大师撰写明星抑癌基因新故事
2014-04-28 佚名 cell
自15年前被首次发现以来, PTEN 基因已公认在阻止许多癌症的发生发展中起着不可或缺的作用。因此,当 PTEN 缺失或发生突变时,恶性细胞可以不受约束地生长,由此导致癌症形成。 现在,由贝斯以色列女执事医疗中心(Beth Israel Deaconess Medical Center,BIDMC)的研究人员领导的一个研究小组帮助更明确地解释了 PTEN 发挥其抗癌效应的机制
自15年前被首次发现以来, PTEN 基因已公认在阻止许多癌症的发生发展中起着不可或缺的作用。因此,当 PTEN 缺失或发生突变时,恶性细胞可以不受约束地生长,由此导致癌症形成。
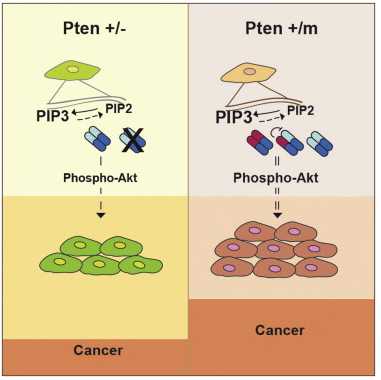
现在,由贝斯以色列女执事医疗中心(Beth Israel Deaconess Medical Center,BIDMC)的研究人员领导的一个研究小组帮助更明确地解释了 PTEN 发挥其抗癌效应的机制,以及 PTEN 缺失或改变是如何让细胞走上癌变过程的。新研究显示 PTEN 缺失和 PTEN 突变并非同义,其不仅提供了有关肿瘤基础生物学的一些重要认识,还为追寻新的抗癌疗法指出了潜在的新方向。这些研究结果在线发表在4月24日的《细胞》(Cell)杂志上。
领导这一研究的是贝斯以色列女执事医疗中心(BIDMC)和哈佛大学医学院的著名癌症遗传学家Pier Paolo Pandolfi 。早在 1994 年 Pandolfi 便开始了肿瘤生物学和遗传学方向的研究生涯,他的研究组曾成功利用小鼠为模型研究并揭示了多种肿瘤发病的分子机理和遗传学机制,包括白血病、淋巴瘤以及前列腺癌等实体肿瘤。2011 年其率先提出的 CeRNA 调控基因表达假说引起了科学界的巨大轰动。
Pandolfi 说:“通过阐析两种特异的 PTEN 突变调控正常 PTEN 蛋白肿瘤抑制功能的方式,我们的研究结果表明,不同的 PTEN 突变通过调控 PTEN 生物学不同的方面促进了肿瘤形成。有证据显示相比于 PTEN 缺失的癌症患者, PTEN 突变癌症患者的结局更差。现在,利用小鼠模型我们证实了情况确是如此。由于 PTEN 突变在各种不同类型的癌症中极为常见,这一研究发现可能有助于为开发出新层次的个体化癌症疗法铺平道路。”
PTEN 基因编码蛋白具有磷酸酶活性,其能够移除其他底物上的磷酸盐。众所周知, PTEN 起作用的几种蛋白,包括脂类和蛋白质与磷酸盐结合时都会促进癌症。因此,当 PTEN 移除它们的磷酸盐时,其发挥肿瘤抑制因子作用阻止了癌症。当 PTEN 突变时,它丧失这一抑制能力,那些促癌基因完好无损并且不再受到抑制。新研究意外地揭示了, PTEN 突变蛋白不仅功能受损(丧失了它的酶功能),它还获得了影响正常 PTEN 蛋白功能的能力,即由此获得了“促癌”功能。
论文的第一作者、 Pandolfi 实验室研究人员 Antonella Papa 博士说:“我们试图比较 PTEN 缺失和 PTEN 突变。我们想知道在 PTEN 不表达以及 PTEN 表达,但在它的序列中编码了突变这两种情况下结局是否会有差异。结果表明答案是yes。”
这一科学团队构建出了几个转基因小鼠品系来模拟人类癌症患者中发现的 PTEN 突变。 Papa 说:“所有小鼠和人类都有两个拷贝的 PTEN 基因。我们研究中的一些转基因小鼠具有一个包含了一种癌症相关突变( PTEN C124S或 PTEN G129E)的 PTEN 基因拷贝,以及一个正常的拷贝。其他的小鼠则只有一个正常的 PTEN 基因拷贝,第二个拷贝被删除。
研究人员发现,相比于删除一个 PTEN 基因拷贝的小鼠,具有突变 PTEN 基因的小鼠更容易罹患肿瘤。他们还发现, PTEN C124S或 PTEN G129E生成的突变蛋白结合并抑制了正常基因拷贝生成的 PTEN 蛋白。
Papa 说:“这非常的令人惊讶,因为我们本预计会减少肿瘤形成。与之相反,我们发现 PTEN 以一种二聚体形式存在,在这种新构象中突变蛋白阻止了正常蛋白发挥功能。在分子水平上,这促进了 PTEN 的靶蛋白:Akt生成和活化,导致了小鼠体内肿瘤形成增多。”Akt信号通路具有调控细胞生长、分裂和代谢的作用,当 PTEN 被阻止抑制Akt之时,该信号通路会过度活化。因此,靶向Akt和它的信号通路有可能是 PTEN 突变患者的一种有效治疗策略,当前影响这一信号通路的一些抑制剂已在测试和开发之中。
Pandolfi 说:“这定义了有关 PTEN 功能和调控的一种新运作模式,告诉了我们可以利用 PTEN 突变状态来确定哪些癌症患者有可能从更早期、更积极的治疗干预中获益,并最终获得更好的预后。我们的研究结果或许有助于根据 PTEN 基因的不同遗传改变,来更好地鉴别及分级患者以及他们对于治疗的反应。重要的是,我们的研究表明应该基于肿瘤包含的非常特异的突变类型来制定抗癌疗法。这为精准施药增加了新的一层复杂性,但也提供了新机遇。我想说的是,基于这些深入的遗传分析,这个故事提供了一个最佳的例子解释为什么迫切需要个体化癌症医疗。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CEL#
57
#抑癌#
62
#Cell#
54
#抑癌基因#
0
#癌基因#
68
#癌症研究#
52