JITC:瑞基奥仑赛治疗R/R CNS淋巴瘤的中国多中心回顾性分析
2024-05-31 聊聊血液 聊聊血液 发表于上海
上海交通大学医学院附属瑞金医院糜坚青教授牵头一项多中心回顾性研究,分析了中国12家中心接受瑞基奥仑赛注射液治疗R/R CNSL的真实世界经验。
瑞基奥仑赛中国RWS
复发/难治性(R/R)中枢神经系统淋巴瘤(CNSL)的预后极差,中位总生存期(OS)仅4个月左右。瑞基奥仑赛注射液(Relmacabtagene autoeucel,relma-cell)在关键RELIANCE研究中显示出显著的疗效和可管理的安全性,但其在真实世界的应用尚无已发表数据,特别是对CNS受累的患者。此外,CAR-T治疗亚洲R/R CSNL患者的报道也较为缺乏。
上海交通大学医学院附属瑞金医院糜坚青教授牵头一项多中心回顾性研究,分析了中国12家中心接受瑞基奥仑赛注射液治疗R/R CNSL的真实世界经验。该研究是商业化瑞基奥仑赛治疗R/R CNSL的首个也是最大样本的真实世界研究,是该领域全球研究的重要部分,并可为亚洲工作组提供区域参考。研究结果近日发表于《Journal for ImmunoTherapy of Cancer》。

研究结果
该真实世界研究纳入中国12家中心接受商业化瑞基奥仑赛注射液治疗的R/R CNSL患者,患者均≥18岁且组织学确诊为CD19+ R/R CNSL,既往接受过系统治疗,包括含CD20单抗的免疫化疗和大剂量甲氨蝶呤为基础的治疗。
患者人口统计学和临床特征
该研究共纳入22例R/R原发性或继发性CNS弥漫性大B细胞淋巴瘤(DLBCL)患者,包括12例原发性CNSL和10例继发性CNSL(表1)。患者中位年龄56岁,45.5%为>60岁,半数患者的KPS评分≤60。在GCB亚型中,有3例(3/13,23.1%)为“双打击”淋巴瘤(DHL)或“三打击”淋巴瘤,而non-GCB患者只有1例(1/9,11.1%)为DHL。既往治疗的中位数为2线。72.7%为原发难治。
在22例接受输注的患者中,有8例(36.4%)将其作为巩固策略,这些患者在单采前持续完全缓解(CR)或部分缓解(PR),但评估为高危患者,包括原发难治性疾病、既往多线治疗、三打击或不适合ASCT。20例患者接受桥接治疗,大部分患者疾病得到控制,即输注(第0天)前,5/22例患者为CR(22.7%), 5/22例患者PR(22.7%), 9/22例患者疾病稳定(SD)(40.9%),3/22例患者疾病进展(PD)(13.7%)。在可测量疾病的17/22例患者中,大多数有脑实质受累,其中2例单纯脊髓受累,1例经MRI和CSF证实为孤立性柔脑膜病。
治疗结局
单采到输注中位间隔32天。13例(59.1%)患者接受单次CAR-T细胞输注,9例患者接受ASCT联合CAR-T细胞输注(ASCT在-3天进行)。18例(81.8%)患者在输注后中位31天接受联合其他药物治疗(联合治疗由医生判断),中位持续时间为180天,联合治疗包括使用单靶点或双靶点药物,包括BTKi (n=15)、PD-1抑制剂(n=5)或来那度胺(n=4)。
最佳总缓解率(ORR)为90.9%,最佳CR率为68.2%。22例(100%)患者均获得CNS缓解,其中16例(72.7%)患者获得CNS最佳CR。中位至缓解时间为1个月。
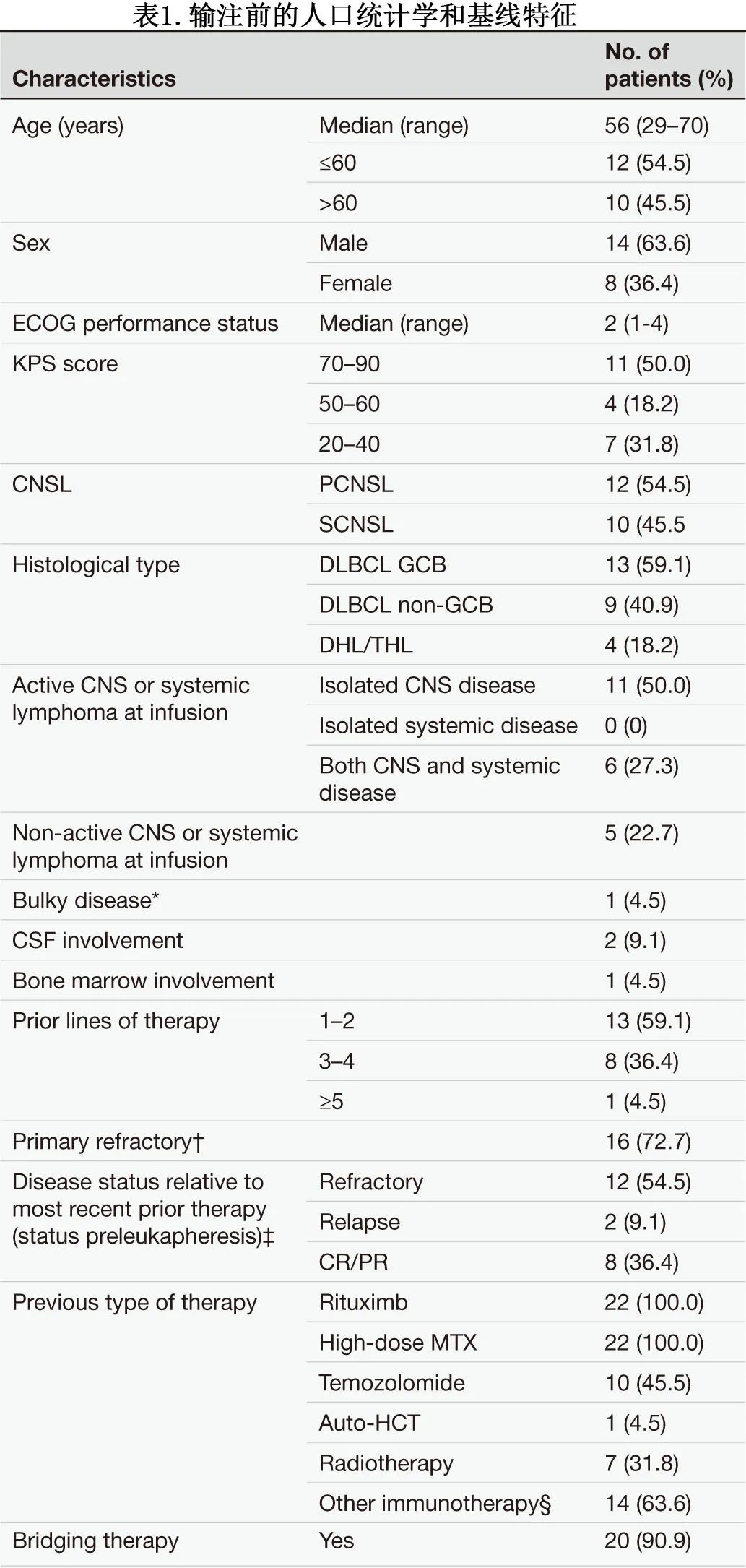
中位随访316天,在16例达到CNS缓解的患者中,13例(81.3%)仍存活并持续缓解,其中8例(50.0%)的CNS缓解持续超过1年。总体而言,6例(27.3%)患者放射学证实疾病进展(PD),包括4例在6个月内进展(1例孤立性全身性PD,3例中枢神经系统PD, 2例同时发生全身性和中枢神经系统PD), 3例因快速进展而在2周内死亡。1年无进展生存率(PFS)、缓解持续时间(DOR)和总生存率(OS)分别为64.4%、71.5%和79.2%,中位PFS、DOR和OS均未达到。随时间变化的个人缓解情况见图1。
预后分析
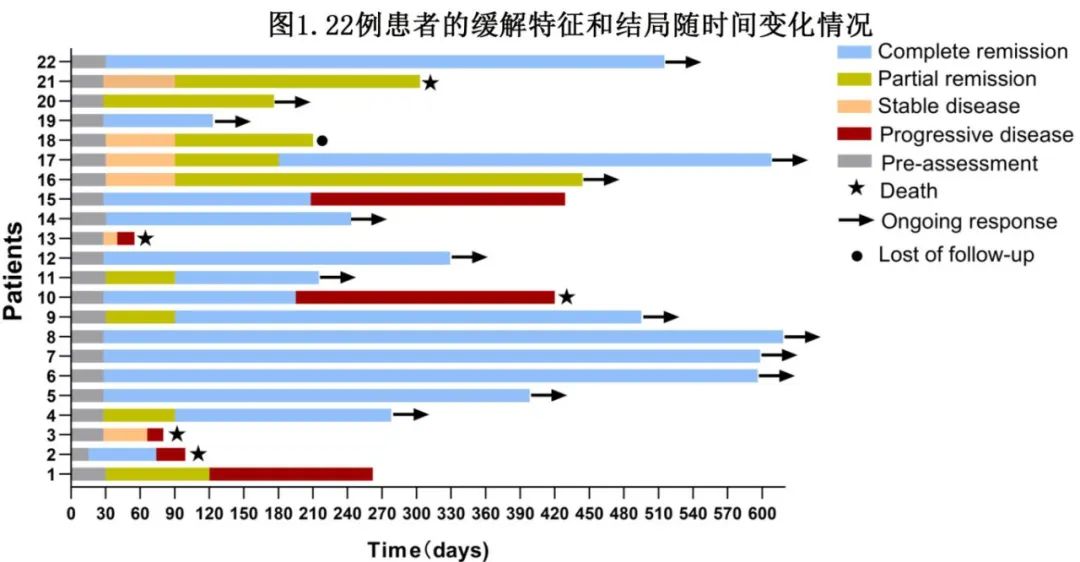
在不同亚组中均有疗效,包括年龄、性别、细胞来源亚型、CNSL疾病性质(PCNSL vs SCNSL)、高危基因型和既往治疗线数等。此外,全身受累是PFS的预测因素(p=0.02),同样,输注时的疾病状态(CR vs PR vs SD/PD)似乎与预后相关。所有输注前非活动性疾病患者在3个月时均维持CR,且具有生存优势,1年PFS为100%,而SD/PD患者的失败风险更高,1年PFS为46.9%。此外,根据输注方式(ASCT+CAR -T与单次CAR-T输注),结局无显著差异,ASCT+CAR-T组的临床结果稍差,包括最佳CR(55.6% vs 76.9%,p=0.28)和1年PFS (62.2% vs 67.3%,p=0.51)。在主要终点方面,输注后3个月非CR似乎预示较差预后,估计1年PFS分别为83.3%和37.0% (p=0.03)。
患者对既往末线治疗的反应(即单采前的反应)对短期和长期结局都有重大影响。单采前持续CR或PR患者(n=8)比R/R患者缓解率更佳(3个月CR率:p=0.01;最佳CR率:p=0.02),所有8例患者在末次随访前均保持CR,其中5例在12个月以上无进展,而对既往末线治疗R/R对PFS和DOR产生显著不利影响(1年PFS:PR/CR为100.0% vs R/R为41.7%,p=0.02;1年DOR:100.0% vs 50%,p=0.03,图2A、B),对OS的不利因素呈临界显著(1年OS: 100.0% vs 65.5%,p=0.05,图2C)。
安全性和耐受性
如表2所示,报告了5例死亡(22.7%),其中3例(13.6%)死亡归因于疾病进展,2例(9.1%)死亡归因于非复发原因(COVID-19);无CAR-T相关死亡。16/22(72.7%)的患者发生任何级别的细胞因子释放综合征(CRS),大多数为1级或2级(15/16,93.7%)。8例(36.4%)患者发生任何级别的免疫效应细胞相关神经毒性综合征(ICANS),其中1例(4.5%)为3级。所有神经毒性(NT)病例均与CRS同时报告。无4-5级CRS或NT。为缓解毒性症状,10/22(45.4%)患者接受托珠单抗治疗,其中13.6%接受两次剂量;9/22(40.9%)患者接受类固醇治疗。
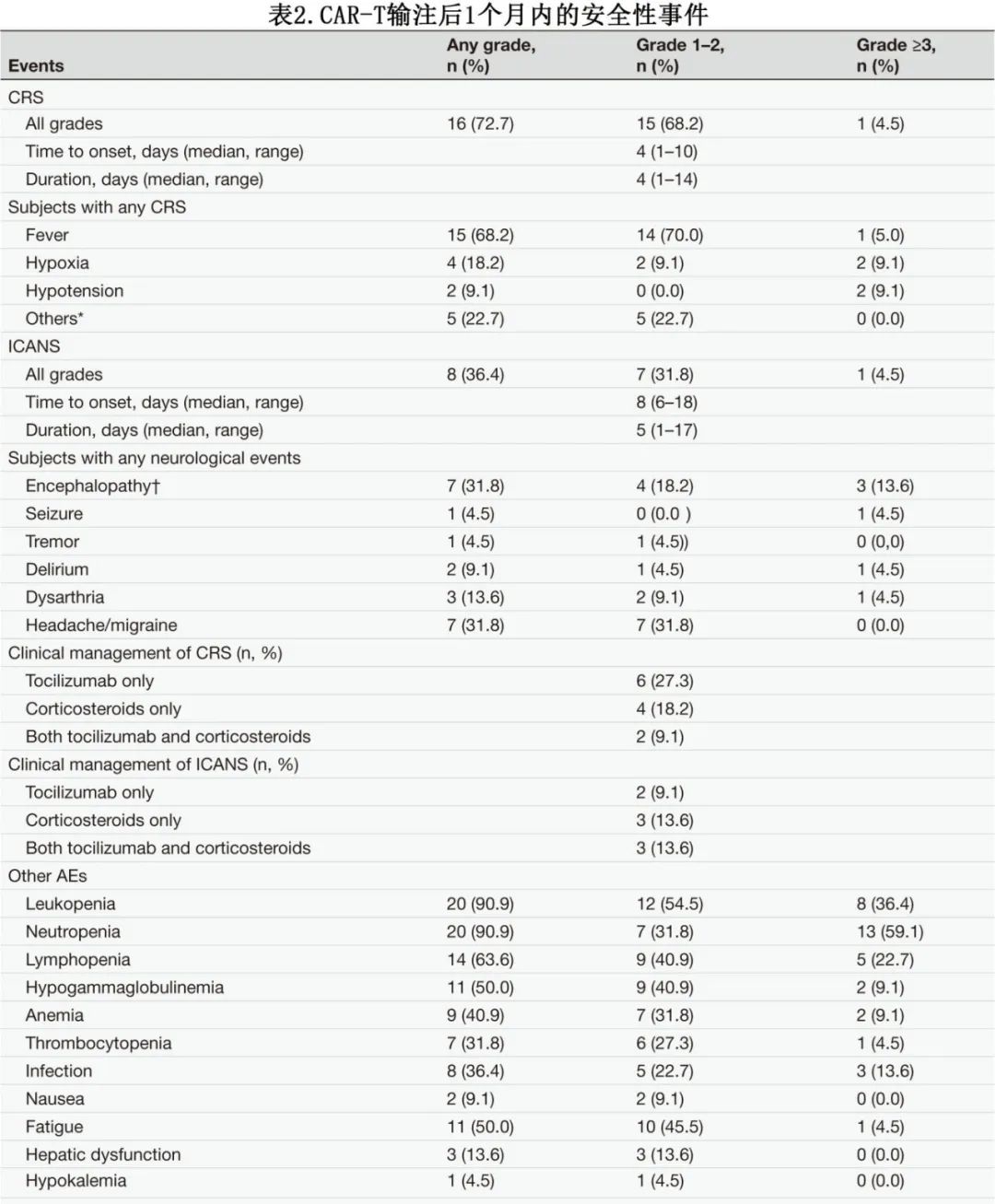
其他重要AE方面,2例患者在输注后≥28天出现≥3级长期血细胞减少。一例患者发生长期3级中性粒细胞减少,持续3个月,但没有证据表明骨髓疾病进展。8例患者报告感染并发症,其中上呼吸道感染5例,COVID-19重症肺炎3例(直接导致2例死亡)。一例患者在输注1年后出现短暂的幻觉,PET/MRI扫描显示持续PR。
CAR-T细胞扩增和CSF转运
在21例可评估的患者中,药代动力学检测显示,在输注后的前28天,瑞基奥仑赛在外周血中显著增加;9/21例(患者#2,#3,#5-#7,#9-#12)通过流式细胞术(FCM)监测,17/21例(患者#1,#5-#9,#11,#13-#22)通过定量PCR (qPCR)。如图3A、B所示,qPCR检测到的CD19 CAR-T细胞峰值中位数为79646.5拷贝/μ DNA,FCM检测到的CD3+CAR+ T细胞峰值中位数为139.8拷贝/µL,至峰值的中位时间为1.43周。在所有8例可评估患者的脑脊液中均鉴定出瑞基奥仑赛(图3C、D)。现有扩增数据表明,无论是否存在全身性淋巴瘤或不可测量疾病,CAR-T细胞都可以进入脑脊液。
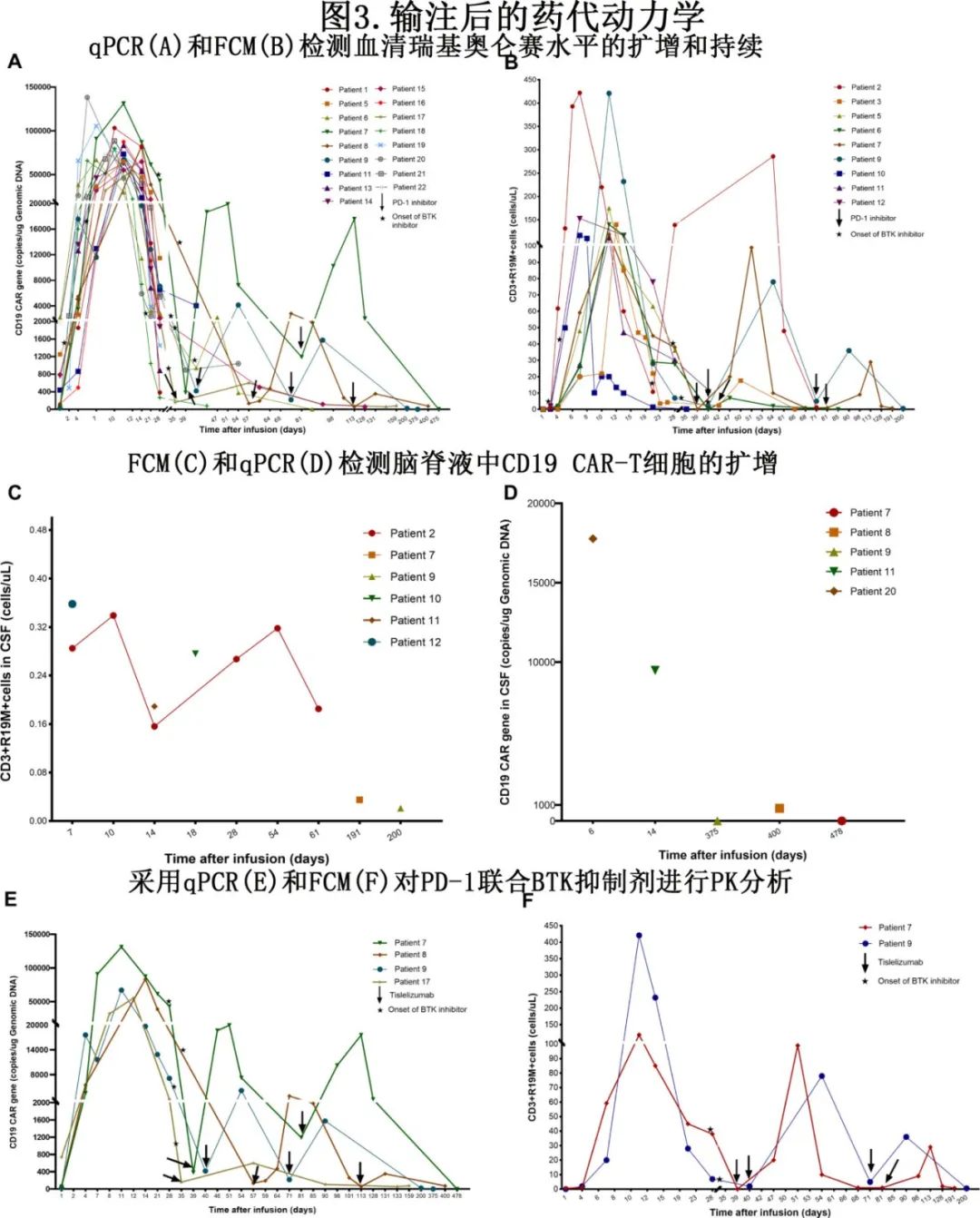
瑞基奥仑赛联合PD-1和BTKi的药代动力学
CAR-T细胞在血液中的持久性随着时间的推移而降低。在单独使用BTK抑制剂或单独使用PD-1抑制剂的可评估患者中,可以观察到循环CAR-T细胞再次扩增。
4名患者同时给予双免疫药物(PD-1抑制剂和BTKi)治疗超过1年。如图3E,F所示,将替雷利珠单抗加入正在接受的BTKi中,在注射替雷利珠单抗后中位数2周,通过qPCR或FCM检测到CAR-T细胞显著再扩增。所有4例患者在15.5个月时保持持久缓解,其中1例患者的疗效进一步改善(SD→PR→CR)。3个月以上患者均可检测到循环瑞基奥仑赛。尽管6个月后,两例患者外周血(0.8和0.55个细胞/µL)和CSF(0.035和0.021个细胞/µL)中通过FCM检测到的CAR-T细胞水平相对较低,甚至从第478天和第375天起不再检测到,但有益临床反应仍在继续。此外,一例患者CAR-T细胞持续时间最长,直到第400天,其脑脊液中的CAR转基因水平远高于血液样本(797 vs 73拷贝/μg DNA)。
CAR-T细胞扩增与缓解和安全性的相关性
作者分析了血清CAR转基因(拷贝数/每微克DNA)与疗效和CRS/ICANS的相关性。在达到最佳CR的可评估患者中,瑞基奥仑赛具有持续时间更长的趋势。与非 CR 患者相比,该相关性与911052拷贝/μg DNA天的中位AUC0-28较高相关 (图4A);AUC0-28定义为瑞基奥仑赛治疗后前28天内血液中 CAR 基因拷贝数蓄积。安全性方面,在发生任何级别神经系统事件的患者中,CAR-T细胞的峰值扩增明显更高;每微克DNA的中位拷贝数为100167,而没有任何NT的患者的中位拷贝数为74019 (p=0.01)。但ICANS的严重程度无显著差异(ICANS分级≥2级vs 1级,中位Cmax:108249 vs 92085,p=0.43)。此外,CAR+ T细胞的AUC0-28与CRS/ICANS的发生或严重程度之间无统计学意义的关联。CAR+ T细胞的峰值水平或AUC0-28与CRS/ICANS持续时间之间没有正面影响(图4B、C)。
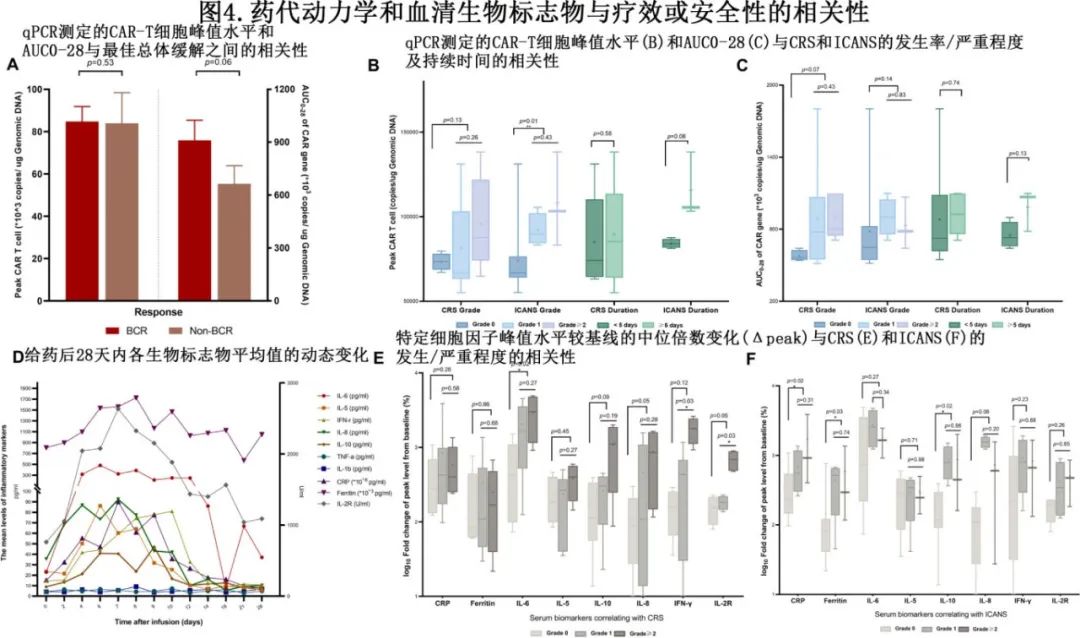
标志物分析
图 4D 显示了白细胞介素 (IL)-2R、IL-6、IL-5、IL-8、IL-10、γ干扰素 (IFN-γ)、CRP和铁蛋白水平的动态波动,但IL-1b和肿瘤坏死因子α (TNF-α) 等细胞因子的水平似乎更低、更平坦。ICANS 方面,CRP(升高11.32倍vs 3.76倍,p=0.02)、铁蛋白(升高5.02倍vs 1.42倍,p=0.03)和 IL-10 水平(升高8.67倍vs 1.76倍,p=0.02)峰值水平较基线的中位倍数变化 (Δpeak) 似乎与 ICANS 的发生相关,但与严重程度无关。此外,CRS的发生与血清 IL-6 的中位Δ峰值水平呈正相关(24.2倍vs 5.63倍,p=0.02)。与1级 CRS 患者相比,高级别CRS(≥2) 患者的血清IFN-γ(17.82倍vs 4.45倍,p=0.03)和可溶性 IL-2 受体 (IL-2R)(6.86倍vs 1.83倍,p=0.03)的中位Δ峰水平显著升高(图4E、F)。
总结
该真实世界研究纳入22例CNSL患者(12例原发性CNSL;10例继发性CNSL),最佳ORR为90.9%,最佳CR率为68.2%。中位随访316天,1年PFS率、DOR和OS率分别为64.4%、71.5%和79.2%。对单采前末次治疗出现持续性CR或PR并接受瑞基奥仑赛作为巩固治疗的患者(n=8)观察到显著的临床获益,1年PFS率为100.0% vs R/R患者41.7% (p=0.02)。此外,就主要终点而言,输注后3个月非CR似乎预示着更差的预后,1年PFS分别为83.3%和37.0% (p=0.03)。CRS发生率为72.7%(3级:4.5%),免疫效应细胞相关神经毒性综合征发生率为36.4%(3级:4.5%)。将PD-1抑制剂(替雷利珠单抗)加入正在接受的BTKi中,在中位2周后,通过定量PCR或流式细胞术检测到CAR-T细胞显著再扩增。
该研究证明瑞基奥仑赛治疗 CNSL 具有临床意义的疗效和可接受的安全性,并再次证实免疫制剂(如 BTKi 或 PD-1 抑制剂)对 CAR-T 细胞再扩增的获益且进一步改善缓解。可以假设的是,CAR-T联合双重免疫制剂具有潜在的协同效应。此外,该研究建议早期使用 CAR-T细胞治疗作为挽救治疗敏感患者的巩固治疗,并为未来的策略提供了动力和启发。
还需要更大样本量的进一步研究来验证该研究的发现。但更重要的问题在于,需要随机前瞻研究来比较 CAR-T 与 ASCT 对挽救治疗有效的 R/R CNSL 患者的疗效,从而进一步明确CAR-T作为巩固策略的作用。
参考文献
Yu W, Huang L, Mei H, et al. Real-world experience of commercial relmacabtagene autoleucel (relma-cel) for relapsed/refractory central nervous system lymphoma: a multicenter retrospective analysis of patients in China.Journal for ImmunoTherapy of Cancer 2024;12:e008553.doi:10.1136/jitc-2023-008553
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#中枢神经系统淋巴瘤# #瑞基奥仑赛# #CNSL#
92