PNAS:痴呆治疗新策略!源于β-arrestin2和tau的正反馈调控
2023-02-13 brainnew神内神外 brainnew神内神外 发表于安徽省
额颞叶痴呆(FTLD)是发病率仅次于阿尔茨海默病(AD)的非血管性痴呆,在临床上常被误诊为AD,其病理基础尚未确定。
额颞叶痴呆(FTLD)是发病率仅次于阿尔茨海默病(AD)的非血管性痴呆,在临床上常被误诊为AD,其病理基础尚未确定。像AD一样,常见的FTLD (FTLD-tau)在受影响神经元脑区(大脑皮层和颞叶皮层神经细胞)表现出过度磷酸化tau的蛋白积累。与AD不同的是,FTLD神经元中没有Aβ积累。实际上,在AD中tau也是必不可少的Aβ传导神经毒性的因素,tau蛋白比Aβ与认知障碍相关性更显著。研究显示,G蛋白偶联受体(GPCRs)在AD发病机制中发挥着重要的作用,在动物模型中,神经元表达或激活多种具有不同结构、内源性激动剂和细胞信号传导作用的GPCRs会促进Aβ和tau的发生和积累。目前尚不清楚外源性GPCRs如何影响AD中Aβ和tau的致病过程和神经退行变性。

GPCR激动剂作用后,大多数GPCR被G蛋白偶联的受体激酶磷酸化,而磷酸化的受体是arrestin结合的底物。这些蛋白在物理上介于受体和G蛋白之间,从而使活化的受体与功能受体部分解偶联。这种现象被认为是调节细胞复杂信号环境内功能的机制。此外,由于arrestin蛋白充当多功能衔接子和支架蛋白,还诱导受体内在化并促进其他信号。Arrestin构成了四个同源蛋白的小家族,分别称为Arrestin1,Arrestin2(β-arrestin1),Arrestin3(β-arrestin2)和Arrestin4。虽然Arrestin1和Arrestin4仅与少数受体结合(视紫红质和颜色视蛋白)并在特定细胞类型中表达,但β-arrestin1和β-arrestin2在大脑和脾脏中表达水平最高。β-Arrestins在细胞中以三种不同的状态存在:1)游离未结合,2)GPCR结合和3)微管结合,每种都有可能具有不同的信号传导能力。
先前的研究表明,β-arrestin2在AD大脑中增加。此外,内源性β-arrestin2通过物理相互作用促进Aβ的产生和沉积。然而,尚不清楚β-arrestin2在AD中或在没有Aβ积累的FTLD中如何影响病理Tau和神经变性。Stephen B. Liggett团队在PNAS上发表论文,发现在额颞叶痴呆中β-arrestin2寡聚物阻碍了病理性tau蛋白的清除并且增加tau蛋白的积累,引入β-arrestin2的突变体可以作为额颞叶痴呆的潜在治疗方法。
首先,作者在FTLD-tau患者额叶皮质和Tau-P301S AD转基因小鼠皮质脑中发现β-Arrestin2蛋白和mRNA水平升高,tau积累和β-Arrestin2呈现正相关,但是在小鼠Tau-P301S没有发现Aβ积累,并且进一步在Tau-P301S小鼠分离的原代海马神经元中证实了β-Arrestin2升高。在稳定表达tau的Hela细胞(Hela-V5-tau细胞)中,转入β-arrestin2后显著增加总tau和磷酸化tau表达,敲除β-arrestin2降低了总tau,β-arrestin2可以提高tau的稳定性。
作者进一步将tau P301S转基因小鼠与β-arrestin2-/-(Arrb2-/-)小鼠杂交,发现在7月龄tau P301S/Arrb2+/-和P301S/Arrb2-/-的海马和皮层中不溶性的tau明显低于tau P301S小鼠,但是可溶性的tau没有变化。作者进一步检测了双脉冲易化(PPF)和长时程增强(LTP),发现tau P301S小鼠的PPF和LTP显著受损,然而P301S/Arrb2+/-和P301S/Arrb2-/- 小鼠的LTP恢复到几乎与WT相同的水平。
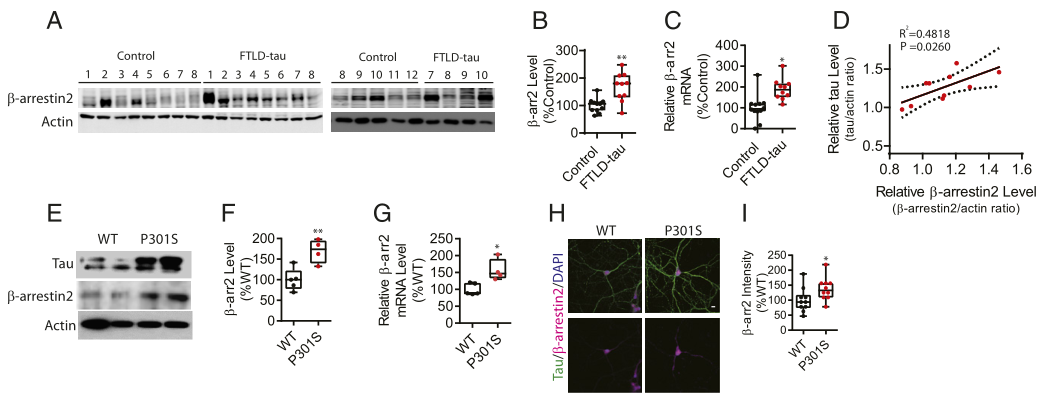
图1. FTLD-Tau患者和Tau-P301S转基因小鼠脑β-Arrestin2水平升高
β-arrestin2在多种细胞类型中都是一种寡聚体。肌醇六磷酸酯(IP6)通过在头尾结构中连接相邻分子来增强β- arrestin2的自聚集。β-arrestin2的N端和C端带正电荷的精氨酸和赖氨酸残基对IP6结合和聚集都很重要。作者通过将β-arrestin2 N末端结构域突变体(β-arrestin2ΔIP6N)和一个C端结构域突变体(β-arrestin2ΔIP6C),检测其对tau稳定性和病理性tau蛋白的影响,发现β-arrestin2ΔIP6C 和ΔIP6CN可以降低tau P301S皮层原代神经元中50%的tau蛋白沉积。鉴于IP6和GPCR结合位点的在物理上是重叠的,β-arrestin2与激活的GPCR和IP6结合是互斥的,这表明在寡聚体形式的β-arrestin2除了与GPCR结合之外还有其他作用。
过度磷酸化的tau被认为是通过自噬溶酶体途径清除的。为了了解β-arrestin2使Tau体内稳定和积累的机制是否和自噬相关,作者使用了Baf A(一种溶酶体的抑制剂,同时激活自噬并促进LC3的积累)。HeLa-V5-tau细胞中的β-arrestin2显著抑制Baf A诱导的LC3增多,提示β-arrestin2抑制LC3或上游的自噬。P62 / SQSTM1是关键的自噬底物受体,可以通过连接tau或Aβ与LC3来调节自噬体的形成。最近的一项研究表明p62的表达与不溶性tau的清除有关。作者为了观察p62的动态变化在HeLa-V5-tau细胞中转入GFP-p62。β-arrestin2的过表达显着降低了GFP-p62稳态和baf A处理后的p62的表达,这表明β-arrestin2从靶底物到溶酶体抑制p62的量。作者使用mCherry-EGFP-p62报告蛋白复合物检测了自噬流,该报告蛋白利用了EGFP对低PH值的敏感和mCherry对PH值的不敏感的特性,因此在自噬体和溶酶体结合后EGFP绿色荧光消失只显示出mCherry的红色荧光。结果显示,β-arrestin2使mCherry荧光降低,β-arrestin2的突变体使mCherry荧光显著升高。Co-IP实验结果证明,β-arrestin2与p62形成复合物, p62自聚集N末端PB1结构域对于其底物受体活性至关重要使其与泛素化的底物具有更多的相互作用位点,并同时与多种LC3蛋白结合。因此,作者测试了β-arrestin2是否影响p62的自身相互作用。结果显示,β-arrestin2降低了p62的GFP-p62和HA-p62的自聚集,但单独使用β-arrestin2ΔIP6C和β-arrestin2ΔIP6N都无法降低HA-p62和GFP-p62的相互作用。
研究有表明纯化的重组p62可自发形成球状寡聚体,作者将β-arrestin2和p62与β-arrestin2混合通过原子力显微镜(AFM)观察,重组的p62自发形成直径在5到100 nm之间的球形颗粒,当p62与β-arrestin2混合时,颗粒的尺寸大大减小,表明β-arrestin2通过抑制p62自聚集可减少p62的大小。Baf A处理后,GFP-p62显著升高,但是β-arrestin2降低了GFP-p62,有趣的是,β-arrestin2ΔIP6C 和 β-arrestin2 ΔIP6N提高了GFP-p62,表明β-arrestin2突变体通过增加了p62,从而增加了自噬流。
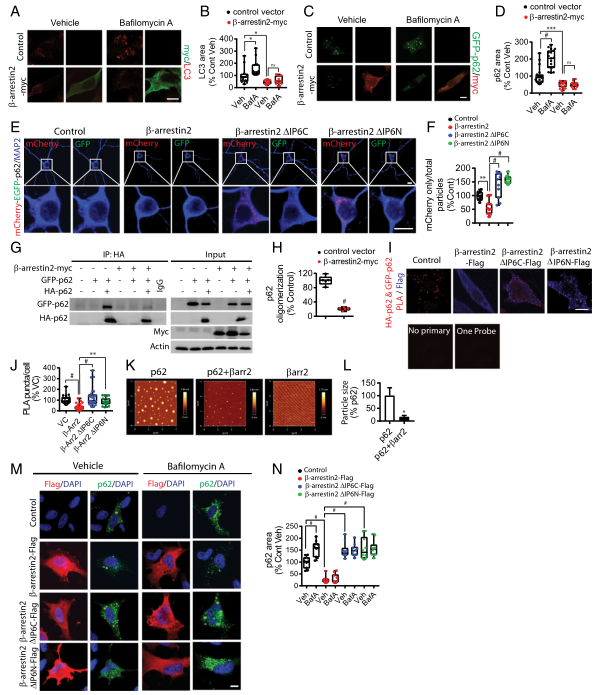
图2. β-arrestin2寡聚体抑制p62介导的tau降解
以上结果表明,病理性Tau积累需要β-arrestin2的寡聚体,而突变β-arrestin2s不会形成寡聚体,因此作者以β-arrestin2ΔIP6C和β-arrestin2ΔIP6N突变体作为一种潜在的治疗方法。将含有GFP-β-arrestin2ΔIP6N和GFP-β-arrestin2ΔIP6C的AAV病毒注射入5月龄的Tau P301S小鼠海马中。结果显示,突变型β-arrestin2注射可显着降低不可溶tau蛋白,治疗的机制是在Tau P301S小鼠有效减少tau中内源性神经元β-arrestin2的寡聚体。
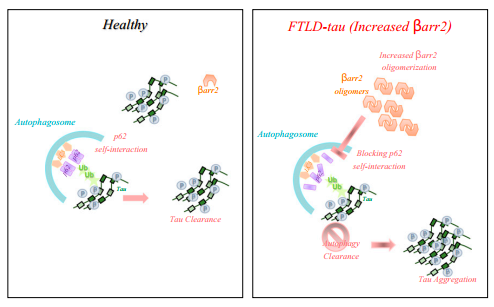
图 3. β-arrestin2促进FTLD-Tau模型
根据本文的结论,抑制β-arrestin2寡聚的作用不仅抑制了新的Tau缠结,而且通过这种机制增强tau清除率。本文关注了Tau-FTLD中β-arrestin2和tau的正反馈回路,β-arrestin2可以上调tau,而tau可以上调β-arrestin2。在FTLD-Tau脑中,β-arrestin2寡聚体增加,抑制p62介导的自噬,导致错误折叠/聚集的Tau无法有效清除。β-arrestin2ΔIP6N和ΔIP6C突变体不会形成寡聚物,可以作为FTLD的一种潜在的治疗方法。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










学习新知识,新理论
82
老年性痴呆,未来还是希望借助神经电生理吧,也许更为有效!
82