Nat Rev Neurol. 阿尔茨海默病中的神经炎症和小胶质细胞激活互作相关
2022-09-14 brainnew神内神外 brainnew神内神外
阿尔茨海默病(AD)是最常见的神经退行性疾病,目前流行的淀粉样蛋白级联假说认为,脑内淀粉样蛋白-β(Aβ)的沉积是AD发病的起始事件,但众多证据不支持该假说。
阿尔茨海默病(AD)是最常见的神经退行性疾病,目前流行的淀粉样蛋白级联假说认为,脑内淀粉样蛋白-β(Aβ)的沉积是AD发病的起始事件,但众多证据不支持该假说。AD患者炎症标志物水平升高以及先天免疫功能相关的AD风险基因的发现提示神经炎症在AD的发病机制中起着重要作用。本文就神经炎症与淀粉样蛋白和tau病理之间的相互关系以及神经炎症对AD疾病轨迹的影响作一综述,特别关注小胶质细胞作为神经炎症的主要参与者,并讨论在不同条件下观察到的小胶质细胞表型的时空变化,以及如何将这些细胞调节为AD的治疗策略。

1.AD的经典特征
长期以来,AD中 Aβ积累被认为是AD发病机制中的中心和初始事件。淀粉样前体蛋白(APP)被裂解生成β肽,相互结合形成β寡聚体、聚合物,最终形成不可溶的淀粉样斑块。在这些不同的形式中,Aβ寡聚体被认为对神经细胞毒性最强。淀粉样蛋白级联假说假设,Aβ水平的升高导致AD的后续病理事件。
AD的另一个特征是神经纤维病理,包括由tau聚集形成的神经炎性斑块、神经纤维缠结。正常修饰的tau蛋白具有稳定微管、调节轴突运输和维持DNA结构稳定的作用。而tau的病理修饰可导致其从微管中脱离,导致突触丢失、神经元功能障碍和tau聚集。与淀粉样蛋白沉积相比,tau蛋白在新皮层的积累被认为发生较晚,但与AD患者的认知能力下降密切相关。
2.神经炎症及其主要参与者
神经炎症是指中枢神经系统内的炎症反应,由感染、创伤、缺血和毒素累积等病理性损伤引起。神经炎症过程中促炎细胞因子大量产生,如白介素(IL-1β、IL-6、 IL-18)、肿瘤坏死因子(TNF)、趋化因子配体 (CCL1、CCL5)、小分子信使(前列腺素、NO、活性氧)等。参与这一过程的先天免疫细胞主要是小胶质细胞和星形胶质细胞。然而在神经退行性疾病中,神经炎症往往是一种无法自行解决的慢性过程,被认为是疾病的重要驱动因素,与多种促炎因子的作用和血脑屏障有关。
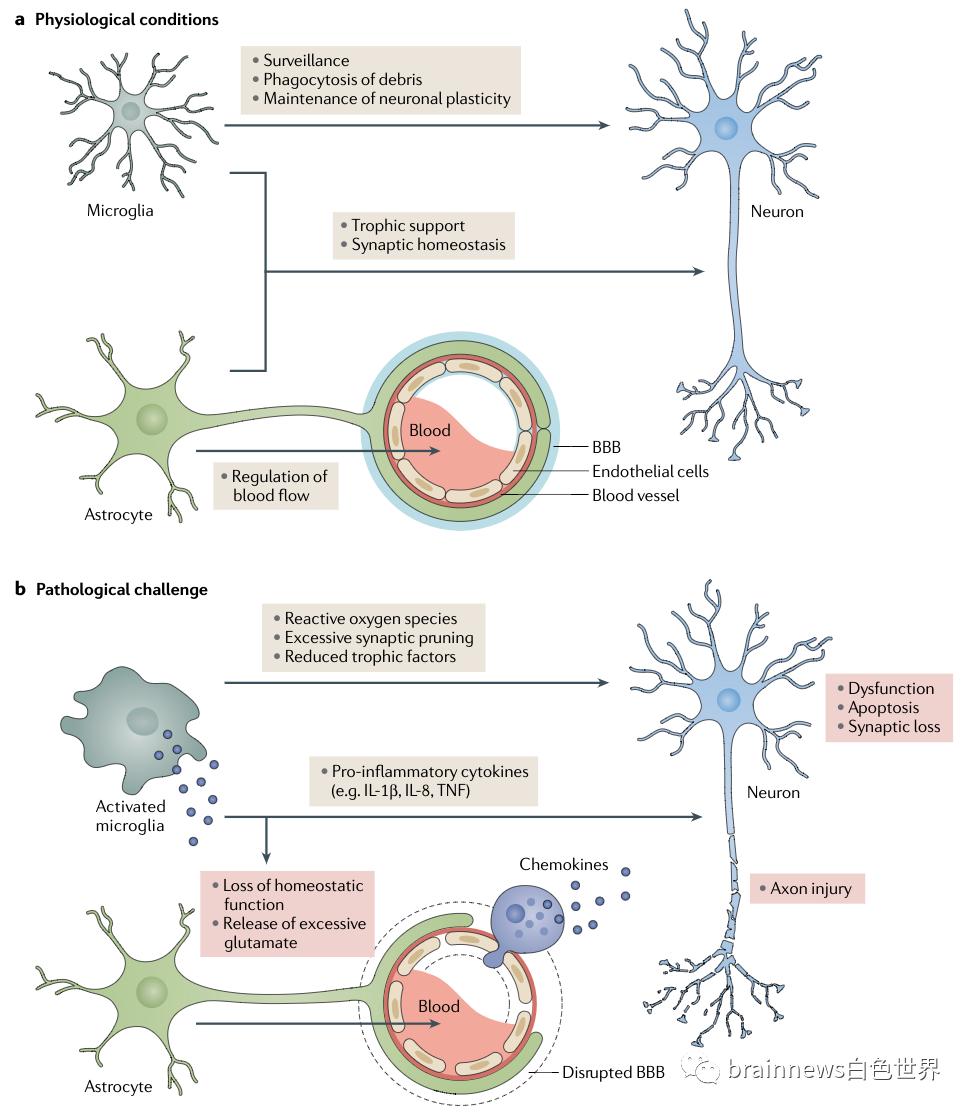
图1胶质细胞的生理功能
3.小胶质细胞的发育和功能
小胶质细胞是存在于中枢神经系统的髓系先天免疫细胞,在发育性突触修剪、神经元凋亡、突触可塑性维持和免疫监视等方面发挥重要作用。通过持续监测中枢神经系统的微环境,感知损伤信号,介导小胶质细胞对损伤部位的反应。在存在内源性或外源性病理损伤的情况下,各类小胶质细胞表面受体可以识别病原体、细胞碎片或异常蛋白并诱导小胶质细胞激活。被激活的小胶质细胞通过胞饮作用、吞噬作用或受体介导的内吞作用将这些致病因素内化,并试图通过内吞途径进行降解,激活相关基因模块的表达,包括神经炎症主要成分趋化因子受体和干扰素。一旦免疫刺激被消除,这个过程就会消失。然而,老年脑中的小胶质细胞存在功能损伤,易于持续激活,这可能是神经退行性疾病的发病机制。
有趣的是,患病大脑中的小胶质细胞形态也因疾病的空间位置和阶段而变化。营养不良小胶质细胞的出现早于tau的病理发展,可溶性高磷酸化tau蛋白被认为导致小胶质细胞表型改变,使免疫监测功能丧失,并通过神经原纤维缠结的形成促进疾病进展。这些发现表明,小胶质细胞的表型变化,包括形态学、蛋白质组学特征和行为的改变,与疾病进展相关。
对AD小鼠模型的转录组研究表明,小胶质细胞从稳态过渡到疾病相关状态与AD疾病进展是平行的。向疾病相关的小胶质细胞(DAM)的过渡与稳态基因的下调和已知的AD风险基因的上调有关,包括载脂蛋白E (APOE)、髓细胞受体2 (TREM2)和TYRO蛋白酪氨酸激酶结合蛋白(TYROBP)。小胶质细胞的激活分为两步,第一步不依赖于TREM2,第二步依赖于TREM2,强调了TREM2在神经退行性疾病发病机制中的重要作用。最近的研究揭示了比DAM更多样的小胶质细胞亚群,这意味着小胶质细胞群对淀粉样蛋白和tau蛋白的反应不同,并且建立了小胶质细胞基因表达谱的参考数据库。值得注意的是,小胶质细胞在大脑中存在着相当大的空间异质性,体现在密度和功能标记和转录组图谱上。
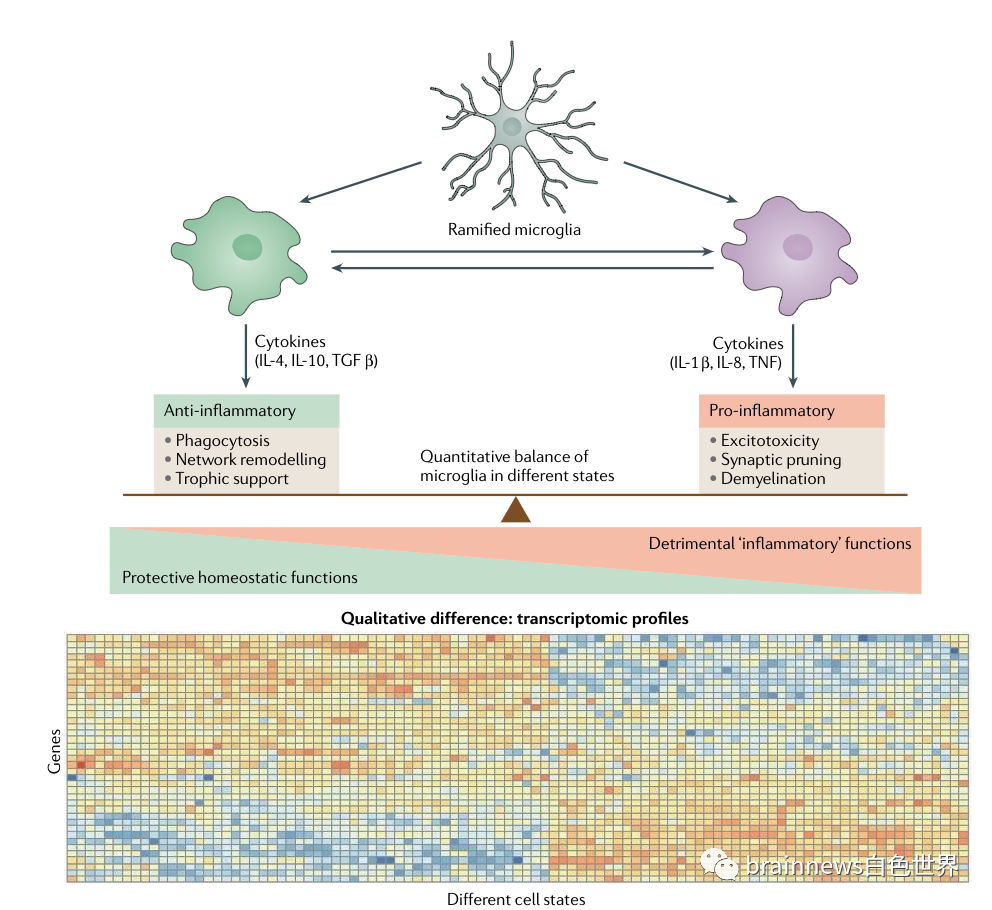
图2 不同表型的小胶质细胞
Aβ、tau和反应性小胶质细胞的相互作用与淀粉样斑块共定位,表明AD的这一重要病理标志与神经胶质细胞存在相互作用。在所有的Aβ聚合物中,较小的Aβ寡聚物远比较大的Aβ寡聚物具有更强的诱导小胶质细胞反应的能力和更高的神经毒性。小胶质细胞识别不同形式Aβ的受体多为模式识别受体,反过来,这些受体激活诱导小胶质细胞表型改变其分子途径。研究表明,TREM2信号通路可促进小胶质细胞增殖、吞噬和细胞因子分泌,调节小胶质细胞代谢和存活。TREM2是药理调节的一个诱人的靶点,但应谨慎,因为TREM2是小胶质细胞激活和表型改变的重要上游分子,其功能的改变可能对AD中有益和有害的小胶质细胞功能产生影响。
培养的小胶质细胞中有Aβ聚集物证实激活的小胶质细胞的吞噬功能。然而,吞噬后Aβ聚集物的降解是相当缓慢的,所以提出小胶质细胞在Aβ清除的有效性问题。自噬被认为是Aβ纤维降解的重要过程之一,体外研究表明,小胶质细胞对不同的A外的反应是不同的。小胶质细胞吞噬原纤维而不是寡聚物,但是后者是诱导炎症细胞因子的产生主要Aβ形式,并抑制原纤维A制的吞噬。进一步的研究还发现,唐氏综合症或AD患者中,在淀粉样斑块附近有少量表达TREM2和CD68的小胶质细胞,这表明斑块相关的小胶质细胞有一种受损的吞噬功能。有趣的是,这种营养不良的变化也与衰老有关,这也是AD默认的风险因素,暗示功能失调的小胶质细胞在AD病理发展中发挥作用。小胶质细胞可能不仅间接促进Aβ的生成,还可能促进淀粉样斑块的生成。
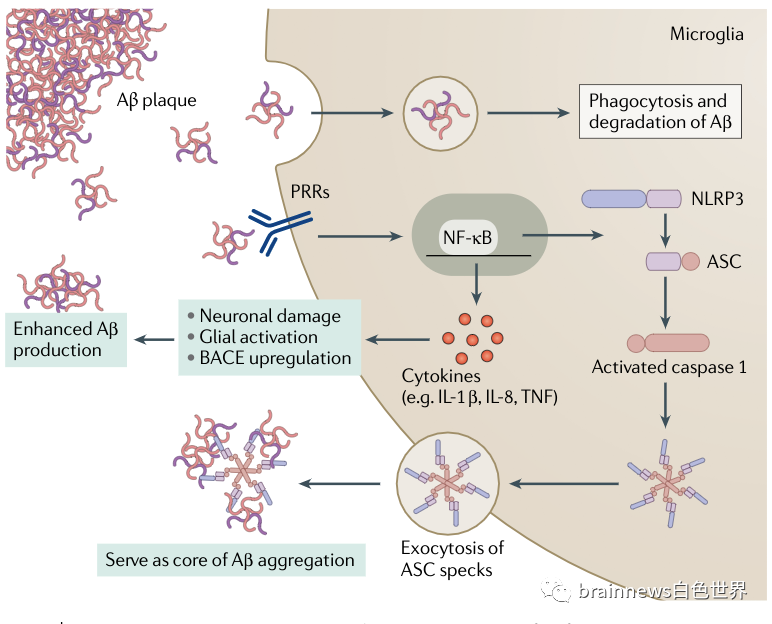
图3 小胶质细胞对淀粉样蛋白β物种的反应
相互作用的复杂性可能是由于小胶质细胞对不同刺激的不同反应所致。小胶质细胞的激活似乎可以抵抗轻度认知功能障碍(MCI))患者病情的恶化,但在tau病理占主导地位的AD阶段起相反的作用。临床影像学研究通过海马体积和葡萄糖代谢评估了AD患者的小胶质细胞激活与大脑结构完整性和功能活动呈负相关。研究发现,Aβ激活的小胶质细胞可产生神经毒性细胞因子和趋化因子,包括TNF、IL-6、IL-1胶和CCL2,随后导致神经功能障碍和死亡。此外,通过补体途径激活的小胶质细胞可以不恰当地吞噬突触,导致突触早期缺失和长时程增强(LTP)的损伤。神经通路特异性偏好的异常突触修剪也可能导致神经退行性变和tau有规律分布。这些发现促使我们进一步研究AD MCI期至晚期痴呆期神经炎症的动态变化。
现有的证据支持神经慢性炎症模型。随着年龄的增长,慢性背景炎症提供了一个初始的温和刺激,导致小胶质细胞启动,随后在AD的临床前阶段可能出现小胶质细胞活化峰值,伴随着Aβ沉积的出现。在AD晚期,A期清除率低下,结合tau聚集,会损害小胶质细胞的防御功能,并引发持续的有害小胶质细胞激活过程。初始反应的有效性、持续性受个体易感性的影响,这可能会使小胶质细胞倾向于防御能力受损、向晚期有害状态转化的趋势增加的表型。这一过程可能是由小胶质细胞对微环境和毒性刺激所引起的表型变化所驱动的。
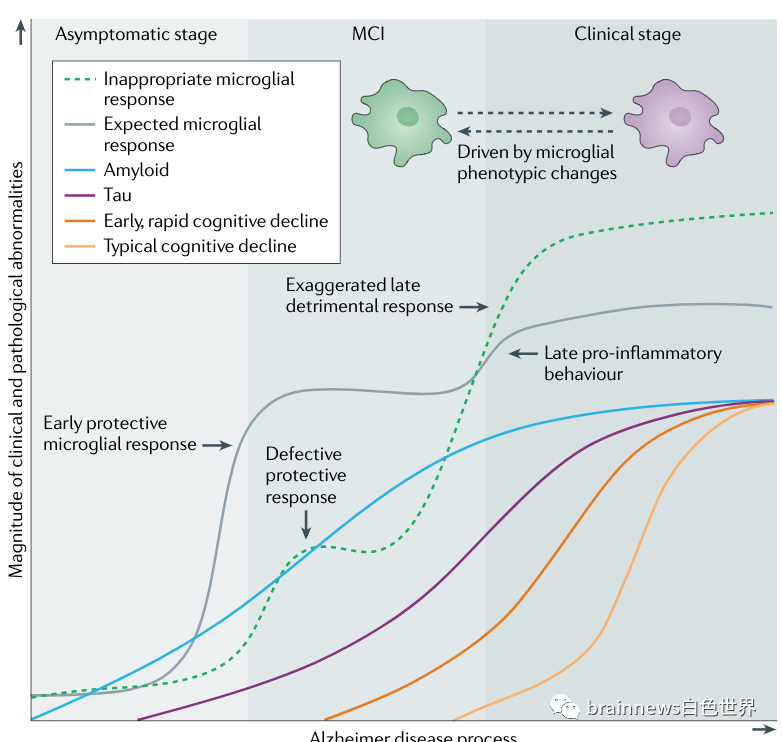
图4 小胶质细胞活化的动态变化影响阿尔茨海默病的进展
4.干预方式
了解小胶质细胞在AD轨迹上的作用使我们能够以三种不同的方式进行干预:首先,通过抑制小胶质细胞的促炎特性来限制小胶质细胞激活的有害影响;第二,通过调节小胶质细胞表型的改变来支持抗炎特性;第三,通过在疾病过程的早期影响小胶质细胞启动。
一项初步的临床研究调查了皮下注射IFNβ1a(重组人干扰素β1a)对早期AD患者的神经炎症的缓解作用,该疗法耐受性良好,结果显示疾病进展有减缓趋势。SIRT1激动剂白藜芦醇,显著降低CSF炎症分子水平,有望减轻AD早期的认知衰退。在临床前研究中,其他抗炎细胞因子(IL-2、IL-4和IL-33),显示出了调节小胶质细胞激活和缓解AD病理的潜力。虽然结果尚未定论,但这些候选药物值得进一步探索。大多数临床前研究都使用病毒载体作为基因表达系统,故这些细胞因子直接进入人体仍然是一个挑战。另一种可能的AD治疗方法是在发病前抑制小胶质细胞的启动。
总之,这篇综述提出了对病理刺激的不同小胶质细胞反应对AD进程有实质性影响,并沿疾病发展轨迹有不同的作用,小胶质细胞反应取决于个体的易感性,并可能受到先前的小胶质细胞启动的影响。在发病前阶段以小胶质细胞启动为目标进行干预,并在发病过程开始时调节大脑中的小胶质细胞反应,作为疾病治疗策略的一部分,这些措施显示出了预防AD病理进程的希望。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#阿尔茨海#
61
#Nat#
100
#神经炎#
80
#阿尔茨#
67
#Neurol#
67
#胶质细胞#
88
#阿尔茨海默#
59
#互作#
77