茅益民教授:共识与实践——药物诱导的自身免疫性肝炎
2022-08-06 消化界 消化界
在可用于诊断和鉴别诊断的特异性的生物标记物被发现前,对伴随自身免疫特征的肝损伤患者进行长期随访,以明确激素或免疫抑制治疗后的反应和撤药后是否复发,是区分特发性AIH和DI-AIH并最终建立正确诊断的关
编者按:
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种原因不明的肝脏慢性炎症坏死性疾病,AIH可由多种原因诱发或触发,药物是其中诱因之一。然而,长期以来AIH的发生被认为与遗传有关,药物的诱发作用一直未受到重视。近年来,随着新药研发和应用的日新月异,人们对于药物性肝损伤(DILI)与药物诱导的自身免疫性肝炎(DI-AIH)的认知逐渐加深。特邀上海交通大学医学院附属仁济医院茅益民教授针对临床实践中DI-AIH与特发性AIH二者的临床鉴别,以及今年3月在欧洲召开的DI-AIH国际专家共识会中达成的共识进行了综述。
药物引发的免疫介导的肝损伤
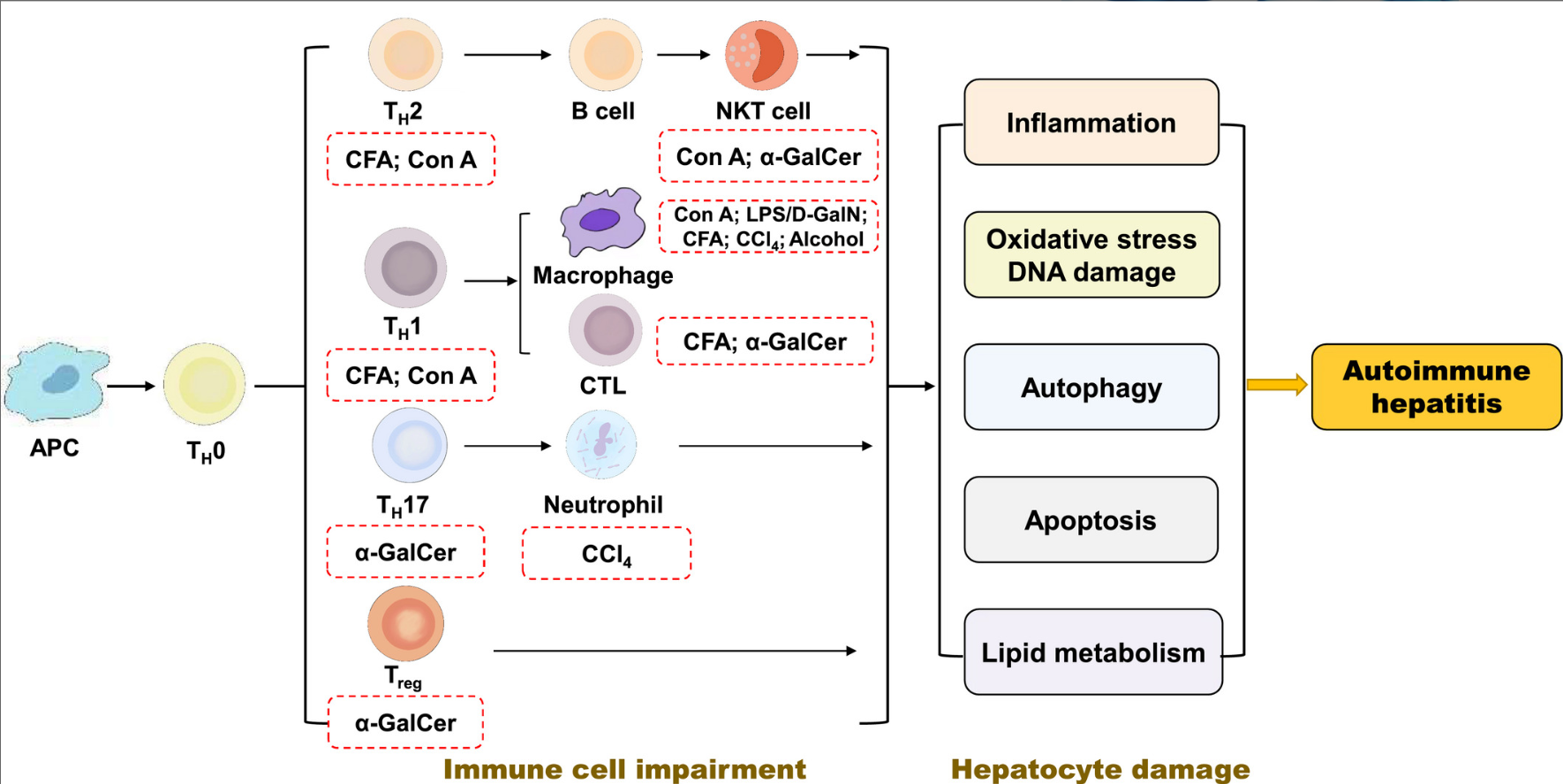
在DILI人群中,部分患者的肝损伤是由免疫介导。临床上,药物引发的免疫介导的肝损伤主要分为两大类型:药物超敏反应综合征和药物诱导的自身免疫性损伤。目前,肿瘤领域的免疫检查点抑制剂相关肝炎也是由免疫介导的。
药物超敏反应综合征:即伴嗜酸性粒细胞增多和系统症状的药物反应(DRESS综合征),肝损伤通常在用药后的较短时间甚至1-2天内发生。患者往往有明显的超敏反应,临床容易识别,可出现发热、皮疹、嗜酸性粒细胞增多和包括肝损伤在内的其他脏器损伤的表现,这是一种严重药物不良反应,死亡率可高达10%,再激发具有极大的风险。
药物诱导的自身免疫性损伤:患者发生包括肝损伤在内的相关脏器损伤的潜伏期不等,可表现为急性、亚急性或慢性肝损伤表型,自身免疫性损伤累及的脏器与特定药物和个体易感性有关,需要注意的是,并非所有患者都有特征性的自身抗体谱出现。因此,药物诱导的自身免疫性损伤,临床上往往比较隐匿,及时识别、建立正确诊断具有很大的挑战性。
DI-AIH与特发性AIH的鉴别诊断
在伴随自身免疫特征的肝损伤患者中,临床上除常规考虑特发性AIH的诊断外,尚需考虑DI-AIH或免疫检查点抑制剂相关肝炎的可能性,对后者而言,采集到详细、足够的病史信息尤其是可疑药物应用史是建立诊断的基础。
已报道的可导致DI-AIH的药物包括:替尼酸(Tienilic Acid)、酚丁、甲基多巴、双肼屈嗪、米诺环素、呋喃妥因、氯苯酰吲酸(Clometacine)、丙硫氧嘧啶、双氯芬酸、异烟肼、英夫利西单抗、干扰素-α、干扰素-β、非诺贝特、他汀类药物、依那西普、阿达木单抗、吲哚美辛、美洛昔康、特比萘芬、伊马替尼、托莫西汀、匹莫林、苯丙香豆素、强力霉素、石蚕属植物(Germander)、海巴戟(Morinda Citrifolia)等。美国FDA警示一些获批的药物可诱发免疫介导的损伤,诸如米诺环素、呋喃妥因、干扰素-β、英夫利西单抗、美曲普汀、伊匹木单抗(Ipilimumab)、帕博利珠单抗(Pembrolizumab)具有肝毒性,可诱发AIH或免疫介导的AIH样肝炎。
特发性AIH的临床特点包括:女性多见,女性和男性的比例为4:1~3:1;ANA、SMA或LKM1等自身抗体阳性;高γ-球蛋白血症;肝脏组织学表现为界面性肝炎,淋巴-浆细胞浸润;多数患者对激素和免疫抑制治疗应答良好,肝脏生化指标和组织学可显著改善;停用激素和免疫抑制治疗后很易复发,1年、2年、3年时的复发率分别为59%、73%和81%。就自然病程而言,特发性AIH往往表现为不明原因反复多次的肝损伤发作;而DILI通常是一次急性的肝损伤发作,在停用可疑药物后肝损伤可恢复,尽管有的患者恢复需相对较长时间,但很少会出现肝损伤反复发作。
由于无已知的生物标志物,即便是做了肝脏组织学检查,在临床实践中往往也很难对特发性AIH和DI-AIH做出明确的鉴别诊断,因此,两者的鉴别诊断绝对是肝病领域中的难点。有研究表明,和伴随自身免疫特征的DILI患者相比,特发性AIH患者的IgG水平更高,自身抗体滴度的水平也更高。然而,孤立性地应用IgG水平和自身抗体滴度去进行鉴别诊断,并不可靠。尽管单独依靠肝脏组织学通常无法直接鉴别两者,但组织学检查可提供有助于鉴别的其他额外信息,结合患者详细的关于肝损伤、可疑药物等的病史信息,可为临床建立正确的诊断提供帮助。2022年1月21日,在比利时布鲁塞尔召开的研讨会上,国际AIH病理小组制定了关于AIH组织病理学的25条声明和推荐意见,包括达到诊断的最低要求、确定AIH诊断可能性的术语、适用于急慢性AIH表现的组织学特征、疾病活动度(分级)和进展(分期)评分等,内容将发表于Liver International杂志。
对每一个伴随自身免疫特征的肝损伤患者,尤其是有可疑药物暴露史的患者,尽管在特发性AIH和DI-AIH间的鉴别诊断非常困难,但目前报道的两者临床特征上的差异有助于临床医生在实践中做出初步判断。与特发性AIH患者相比,DILI患者(无论是否伴随自身免疫特征)发病时的中位数ALT、AST、TBil水平更高,提示肝损伤更为严重。DI-AIH患者,多数(60%以上)急性起病,部分患者可伴有皮疹、发热、嗜酸性粒细胞增多等超敏反应表现,罕见合并自身免疫性疾病,起病时罕见肝硬化,停用激素或免疫抑制治疗后罕见复发,罕见进展至肝硬化;与之相比,特发性AIH患者,急性起病者相对少见(低于20%),罕见超敏反应,14%-44%的患者可合并其他自身免疫性疾病,28%-33%的患者就诊时已发展为肝硬化,停用激素或免疫抑制治疗后复发率高达60%-87%,7%-40%的患者最终会进展为肝硬化。
在可用于诊断和鉴别诊断的特异性的生物标记物被发现前,对伴随自身免疫特征的肝损伤患者进行长期随访,以明确激素或免疫抑制治疗后的反应和撤药后是否复发,是区分特发性AIH和DI-AIH并最终建立正确诊断的关键。
DI-AIH国际专家共识
2022年3月1-3日,在DI-AIH国际共识研讨会上,全球有30多位专家参与讨论,针对DI-AIH如何分类界定、不同亚群的定义以及相关临床管理等议题进行了卓有成效的讨论。最终在此次共识讨论会上达成了如下共识,最终的共识以正式发表为准:
01关于命名
伴随自身免疫特征的免疫介导的药物性肝损伤(imDILI)命名包括:DI-AIH、药物性肝损伤伴随自身免疫性特征(DILI with autoimmune features)、药物诱导的自身免疫样肝炎(DI autoimmune like hepatitis)。
02病例的界定
实验室和(或)组织学检查有自身免疫性特征证据的肝损伤。
03关于发生率
AIH患者中约9%是由药物诱导的;DILI患者中1%-6%为DI-AIH。
04可导致DI-AIH的药物
替尼酸、肼屈嗪、甲基多巴、米诺环素、呋喃妥因、英夫利西单抗、干扰素、他汀类药物、甲泼尼龙片、阿达木单抗、伊马替尼、双氯芬酸等。
05诊断标准
1)尚无特异性实验室指标可用于诊断;
2)自身抗体(ANA、SMA、AMA、LKM、SLA)的检测需要标准化的技术;
3)AIH简化量表可能有助于指导诊断,但仍需要前瞻性研究证实;
4)基因检测并不是常规推荐的方法,但在某些病例中可能会有所帮助;
5)肝组织学检查无法区分DI-AIH和AIH,缺乏浆细胞浸润可能更倾向于DI-AIH的诊断,但这需要前瞻性研究证实。
06因果关系评估
RECAM提高了客观性和专家意见的一致性,但强调了不同药物诱导AIH的差异。其他的工具可能有用,如单核细胞源肝细胞样细胞的体外实验。
07自然病程
DI-AIH可进展为急性肝衰竭,但目前无相应的标志物可以帮助预测,因此,重症的DI-AIH患者应在肝移植中心进行随访评估。
08治疗
1)停用可疑药物;
2)若停用可疑药物后患者肝功能持续恶化,或表现为急性重症肝损伤,可考虑用激素治疗,剂量为0.5-1mg/kg/d,激素治疗前应先进行肝组织学检查,但激素治疗的疗程尚无循证医学证据支持。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











学习学习
52