浆细胞样树突状细胞的生物学
2024-11-07 小药说药 小药说药 发表于上海
本文介绍浆细胞样树突状细胞的作用、人和小鼠的表型及发育、迁移、先天免疫感受器及反应调节等,指出其生物学特性仍有未解之谜,为未来研究提供方向。
前言
浆细胞样树突状细胞(pDCs)是一种独特的树突状细胞亚群,其通过Toll样受体(TLR)7和TLR9识别病毒或自身核酸后产生I型干扰素(IFN-α、IFN-β)。此外,pDCs还可以分泌其他促炎细胞因子和趋化因子,包括IL-6、IL-12、CXCL8、CXCL10、CCL3和CCL4,MHC II类和共刺激分子的表达使pDCs能够向CD4+T细胞呈递抗原。因此,其在免疫系统中发挥着多方面的重要作用。
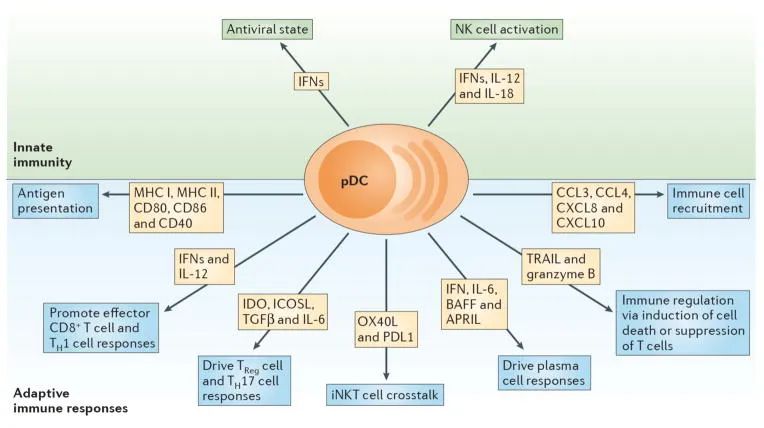
pDCs促进抗病毒免疫反应,并与以I型IFN为特征的自身免疫性疾病的发病机制有关。此外,pDCs也可以诱导耐受性免疫反应。因此,pDCs在抗病毒免疫、自身免疫性疾病和肿瘤的发生发展中发挥重要作用。深入研究pDCs的生物学特性,有助于我们可以更好地理解免疫系统的复杂性,并为开发新的治疗方法提供新的思路。
人和小鼠pDC的表型和发育
人pDCs缺乏谱系相关标记CD3、CD19、CD14、CD16和CD11c的表达,并选择性表达C型凝集素BDCA2(也称为CLEC4C)和Ig超家族受体ILT7,人pDCs也表达CD4、CD68、ILT3和IL-3受体(也称为CD123)。最常用于鉴定小鼠pDCs的标记物是CD11c、B220、Ly6C、骨髓基质抗原2(BST2)和SIGLEC-H,与CD11c−的人类pDCs相比,小鼠pDCs表达中等水平的CD11c。
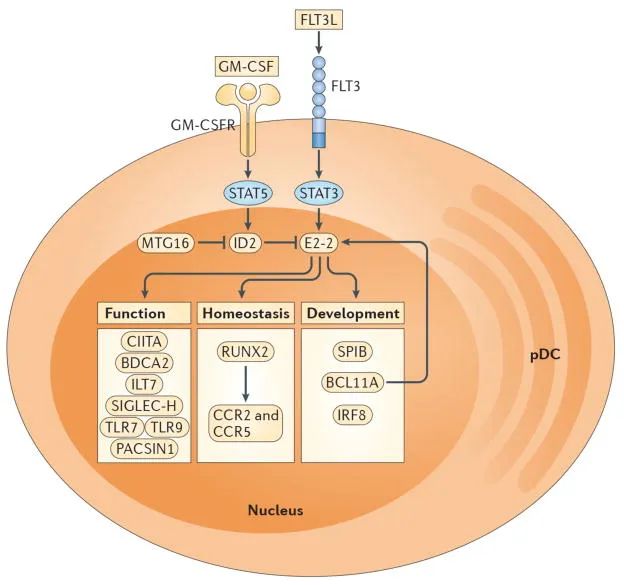
在骨髓中发现了一种常见的DC祖细胞(CDP),它既能产生pDCs,也能产生经典DC(cDCs),但不能产生其他细胞谱系。CDP向pDCs的发育受特定细胞因子和转录因子的调节:FLT3L-STAT3信号传导促进E2-2的表达,E2-2是pDC发育所需的主要转录因子。成熟pDCs中E2-2的缺乏将导致pDCs的丧失或定向分化为cDC样细胞。相比之下,GM-CSF-STAT5信号传导通过诱导E2-2拮抗剂ID2的表达来阻断DC发育过程中pDC的分化。转录辅因子MTG16通过抑制ID2促进pDC分化,限制cDC发育。
此外,SPIB、BCL11A和IRF8是pDC分化和/或存活所必需的,而RUNX2通过趋化因子受体CCR2和CCR5的表达控制pDC稳态,并允许从骨髓中排出。CIITA促进MHC II类表达,BDCA2、ILT7和SIGLEC-H是人或小鼠pDCs选择性表达的标志物,参与调节I型IFN的产生。TLR7、TLR9和PACSIN1使pDC能够识别核酸和病原体,从而导致I型IFN分泌和促炎细胞因子产生。
pDC的迁移
研究表明,pDC的迁移与cDCs的迁移有很大不同。在骨髓中发育后,pDCs在血液中循环,主要通过高内皮微静脉(HEV)到达淋巴结的T细胞区域,而不是通过传入淋巴管。除了次级淋巴器官,pDCs也从血液迁移到外周组织。
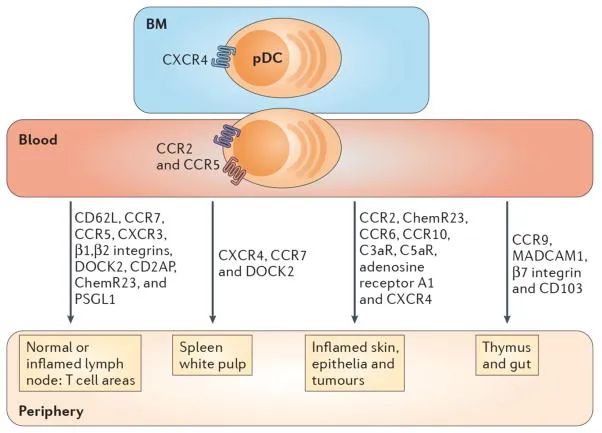
pDCs主要通过CXCR4、CCR7、CCR2等趋化因子受体以及CD62L、PSGL1、β1/β2整合素等粘附分子在体内进行迁移,主要定位于淋巴组织、肠道和肿瘤微环境。CXCR4对于pDCs在骨髓基质生态位中的保留及其发育是必需的,CXCR4和CCR7介导pDCs迁移到脾白髓中,CXCR4还促进pDC向产生CXCL12的肿瘤募集;在炎症期间,CXCR3和CCR5驱动pDC迁移到炎症组织中;CCR2驱动pDCs向皮肤募集; pDC向胸腺和小肠的募集需要CCR9, MAdCAM-1和β7整合素最近被证明可以促进pDC运输到肠上皮内室。
pDC的先天免疫感受器
pDCs对病毒或自身核酸的识别主要由位于内体区室的TLR7和TLR9介导。pDCs中这些受体的激活通过MyD88-IRF7途径分泌I型IFN,并通过MyD88-NF-κB途径产生促炎细胞因子和趋化因子。TLR7检测RNA病毒、内源性RNA和合成寡核苷酸,而TLR9检测含有非甲基化富含CpG的DNA序列、内源性DNA和合成CpG寡核苷酸的DNA病毒。
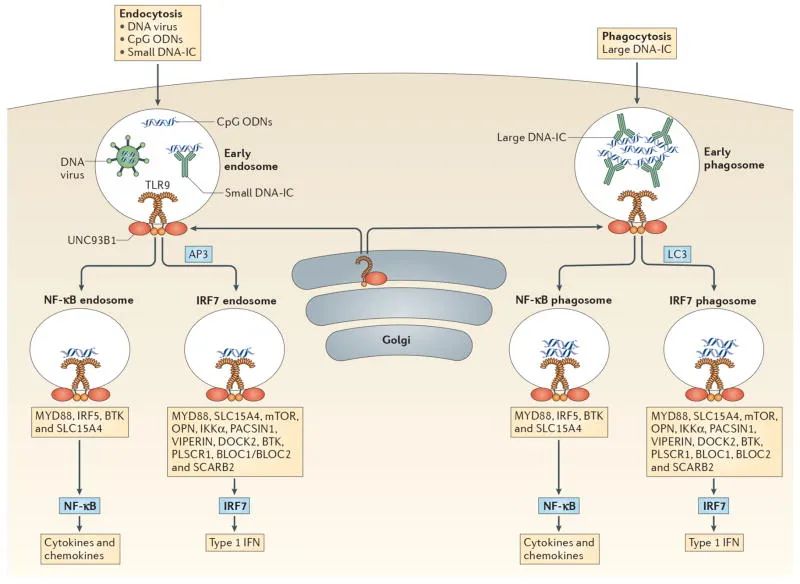
TLR7或TLR9的结合是否导致I型IFN或促炎细胞因子的产生取决于这些TLR与其配体相遇的隔室类型。A型CpG在早期内体中聚集,在那里它们激活诱导I型IFN的MyD88-IRF7通路。相比之下,B型CpG被转移到内溶酶体室,在那里它激活MyD88 NF-κB通路,从而触发共刺激分子的表达和促炎细胞因子的分泌。将TLR9运输到亚细胞室以产生I型IFN依赖于衔接蛋白3(AP3),以及BLOC1和BLOC2蛋白,是pDCs中TLR9信号传导所需的关键成分。
此外,尽管TLR已被确定为参与pDC激活的主要先天受体,但细胞质核酸传感器对pDC产生I型IFN或促炎细胞因子的影响才刚刚开始探索。A型CpG选择性结合DExD/H-box解旋酶36(DHX36),这与IRF7的核转位和pDCs中I型IFN的产生有关。相比之下,B型CpG与DHX9结合,这导致NF-κB活化和pDCs中促炎细胞因子的分泌。
pDC中TLR7/TLR9反应的调节
人和小鼠pDCs表达细胞表面受体,其控制I型IFN产生的幅度和pDC激活状态,以响应TLR7或TLR9配体。这些受体中的许多要么含有细胞内基于酪氨酸的抑制基序(ITIM),要么通过相关的接头传递细胞内信号,通常是DNAX激活蛋白12(DAP12)或FcγR,后者具有细胞内基于酪氨酸的激活基序(ITAM)。与人类pDCs相关的调节受体包括BDCA2、ILT7、NKp44、CD300A/C、DCIR(也称为CLEC4A)、CD32、BST21和白细胞相关免疫球蛋白样受体1(LAIR1)。已被证明调节小鼠pDCs中TLR7和TLR9驱动反应的受体包括SIGLEC-H、BST2、PDC-TREM、Ly49Q、PIR-B和EBI2。
microRNAs和激素也会影响TLR7和TLR9信号传导和pDC功能。配体与TLR7和TLR9结合后,miR-146a的表达被诱导,这抑制了pDCs中NF-κB的激活和TLR介导的信号传导,miR-146a对pDC的严格调控有助于控制pDC过度激活对自身的损害。此外,研究表明,TLR7介导的pDCs信号传导被雌激素增强。值得注意的是,这为观察到的女性pDCs比男性pDCs对HIV的反应产生更多的I型IFN提供了理论基础。
小结
尽管目前已经描述了pDCs的许多免疫功能,但pDCs的生物学特性仍然存在许多未解之谜,需要进一步研究来阐明它们在免疫系统中的具体作用机制,以及它们在人类疾病中的角色。未来的研究可能集中在以下几个方面:阐明pDCs感知病原体和内源性核酸的分子机制;研究pDCs在人类疾病中的具体作用机制;以及开发针对pDCs的治疗方法,以治疗自身免疫性疾病和肿瘤。
参考文献:
1.The multifaceted biology of plasmacytoid dendritic cells. Nat Rev Immunol.2015 Aug;15(8):471-85
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#生物学# #浆细胞样树突状细胞#
41