盘点:近期基因疗法前沿性进展抢先看
2016-06-29 佚名 生物谷
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷或异常引起的疾病,以达到治疗人类疾病的目的。基因疗法的概念最早来自20世纪中期,而且基因疗法被认为是一种革命性的技术,有望治疗几乎任何一种疾病。在新世纪初期,研究者就在一项小规模临床试验中发现逆转录病毒疗法具有一定的临床效力,其可以治疗帮助治疗致死性免疫缺陷障碍的患儿。此前发表在PNAS杂志上的一项研究中,来自麻省总医院的科学家就通过
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷或异常引起的疾病,以达到治疗人类疾病的目的。
基因疗法的概念最早来自20世纪中期,而且基因疗法被认为是一种革命性的技术,有望治疗几乎任何一种疾病。在新世纪初期,研究者就在一项小规模临床试验中发现逆转录病毒疗法具有一定的临床效力,其可以治疗帮助治疗致死性免疫缺陷障碍的患儿。
此前发表在PNAS杂志上的一项研究中,来自麻省总医院的科学家就通过对小鼠模型进行研究,通过单次注射特殊改造基因版本的常用病毒载体,从而达到了抑制化疗耐药卵巢肿瘤生长的目的。
本文中,小编汇总了近期基因疗法的前沿进展,与各位一起学习。

原始新闻阅读:Safer Vectors for Gene Therapy
基因疗法的概念最早来自20世纪中期,而且该疗法被认为是一种革命性的技术有望治疗几乎任何一种疾病。在新世纪初期,研究者就在一项小规模临床试验中发现逆转录病毒疗法具有一定的临床效力,其可以治疗帮助治疗致死性免疫缺陷障碍的患儿。
这项首次试验成功随机便因大量治疗的儿童患上载体相关的白血病而蒙上了阴影,随后研究者就强调了理解载体生物学(媒介生物学)的重要性,从而就可以帮助更为有效、安全且具有特异性的新一代载体,其中基于HIV-1慢病毒属的载体(慢病毒载体)目前正被广泛用于基础和应用研究中。
病毒是一种细胞内的专性寄生微生物,其可以进化成为高效的工具来帮助运输RNA或DNA至靶向细胞中,如今研究者已经鉴别出了多种可以进行特殊基因疗法的病毒,而且也已经开始利用这些重组病毒进行相关研究了,比如在临床和实验室中使用的腺病毒、腺相关病毒(adeno-associated viruses, aav)、疱疹病毒、痘病毒、反转录病毒以及慢病毒。
基于致癌反转录病毒载体的最大优点就是缺少病毒蛋白,这就可以帮助使得病毒进行缺陷型复制并且缺少免疫原性,从某种意义上来讲,这些载体并不能表现出抗载体的免疫反应,而且它们有能力整合到宿主基因组中,引发持续性的基因表达。然而目前存在一种限制,比如病毒颗粒的不稳定性、较低的病毒滴度,不能转化成为非分裂细胞以及出现插入诱变现象,为了克服这些缺点,研究人员基于慢病毒开发出了新型的载体,这就可以促进插入诱变的产生,然而相比γ逆转录副本而言这种新型载体的频率较低。
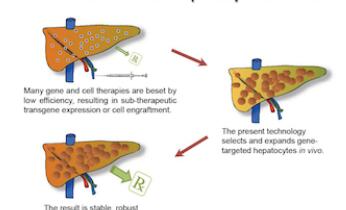
【2】Science子刊:基因疗法新突破!在体内选择性扩增经过基因修饰的肝细胞
doi:10.1126/scitranslmed.aad8166
基因疗法为治疗遗传病提供希望,但是它的效率经常太低而没有治疗价值。如今,在一项新的研究中,来自美国俄勒冈健康与科学大学、斯坦福大学医学院和贝勒医学院的研究人员证实经基因修饰后对一种有毒药物产生抵抗力的肝细胞能够在活的小鼠体内选择性增殖,从而高达1000倍地增加转基因表达。这种新方法也可能用于骨髓、肠道、皮肤或肾脏组织中。相关研究结果发表在2016年6月8日那期Science Translational Medicine期刊上,论文标题为“A universal system to select gene-modified hepatocytes in vivo”。论文第一作者是来自俄勒冈健康与科学大学的Sean Nygaard。
Nygaard说,“基因疗法是一个治疗潜力巨大的领域,但是也是一个充满巨大风险的领域。”
在此之前,科学家们利用重组腺相关病毒(recombinant adeno-associated virus, rAAV)载体治疗血友病等肝脏疾病,取得一定的成功。然而,低剂量的病毒载体通常并不导致高效转导,高剂量病毒载体能够产生免疫反应,而且可能激活癌基因,这使得它成为一种有风险的治疗方案。对已测试的一些疾病而言,经过基因修饰的肝细胞凭借它们自己的力量在与有缺陷的肝细胞的竞争中胜出,但是对大多数肝脏疾病而言,情况并不是这样的。

doi:10.1182/blood-2016-01-688226
近日,世界首个用于儿童治疗的基因疗法获得欧盟委员会(European Commission)批准,这项名为Strimvelis的基因疗法或将开启儿童疗法研究的新时代,相关研究刊登于国际杂志Blood上。该疗法可以治疗重症联合免疫缺陷(ADA-SCID)的患儿,这种疾病是一种非常罕见的儿童疾病,其在患儿受影响的极短时间内往往具有明显的致死率。
重症联合免疫缺陷疾病会使得新生儿对于病毒和细菌没有任何抵抗力,而且该病和X 连锁重症联合免疫缺陷(X-SCID)症密切相关,这种新型基因疗法为何如此特别,因为其是首个利用遗传修复技术来治疗疾病的商用化疗法,目前该疗法在欧洲终于获得批准。
ADA-SCID是由遗传自父母双方的错误基因所引发的疾病,在欧洲该疾病大约每年会影响15位患儿的健康,来自父母机体中错误的基因会影响患儿机体腺苷脱氨酶蛋白的产生,而该蛋白是产生淋巴细胞所必需的,通过在患儿一岁之前ADA-SCID疾病具有致死性。当前研究人员利用风险性的骨髓移植或昂贵的酶类移植疗法来治疗重症联合免疫缺陷症,而在Strimvelis基因疗法中,研究者将来自患儿骨髓中的干细胞进行移除并在检测管中进行纠正去除错误基因,随后重新导入患儿机体中。
【4】基因治疗领域里程碑事件:欧盟批准制药巨头GSK的基因疗法上市
5月27日,全球制药巨头葛兰素史克公司(GlaxoSmithKline,GSK)的基因疗法Strimvelis被欧盟批准上市,此基因治疗是世界上第一个被批准上市用于儿童缺陷基因修复的疗法,是基因治疗走向市场的又一里程碑事件。
基因疗法Strimvelis由GSK公司与意大利科学家共同研发,用于重症联合免疫缺陷症(简称SCID)治疗,其方法是首先获得患者自身的造血干细胞,在体外进行扩增培养,之后利用逆转录病毒将正常ADA(腺苷脱氨酶)基因导入其造血干细胞,最后将修饰后的造血干细胞回输到本人体内。
SCID是一种罕见遗传病,患者的免疫功能几乎完全丧失,对细菌、真菌、病毒和原虫感染均缺乏抵抗力,各种感染连续不断,往往出生一年内即可出现严重的临床病症,生命岌岌可危。此病是由于编码腺苷脱氨酶(ADA, Adenosine Deaminase)的基因出现突变失去原有功能导致的。

英文原文报道:Scientists claim they've completed the first successful gene therapy against human ageing
美国Bioviva公司的CEO Elizabeth Parrish女士称自己成为了历史上第一个成功扭转自然衰老现象的人类,而这都要归功于她们公司开发的基因疗法。
2015年Parrish女士首次接受该治疗方案——具体包括延缓肌肉水平随着衰老而下降的趋势以及抵抗由老年性疾病引发的干细胞数量减少的效应。
目前该疗法的安全性已经得到了证明,如果能够同时证明长期的效果以及承受科学方面细致的考察,将会成为人类端粒能够延长这一假说最好的证明。
“目前针对老年性疾病的疗法效果很微弱,而且生活习惯的不断变化也会限制对这些疾病的治疗。生物技术的进步是最好的方法,如果我们的结果是真实可信的话,将会是历史性的突破”。
【6】Nature Nucleic Acids Res:新技术有助改善CRISPR基因疗法
doi:10.1038/nature16142
基于对人细胞中基因排布和修复方式的理解,加拿大戴尔豪斯大学医学院病理学系副教授Graham Dellaire博士开发出一种很可能能够让基因疗法更加有效和安全的技术。他的研究成果近期发表在Nature期刊和Nucleic Acids Research期刊上。
作为2015年的突破性发现,CRISPR能够准确地靶向作用于靶DNA,并对它进行编辑,从而有潜力治疗遗传病和发现新的抗癌疗法。
为了将CRISPR技术应用于非分裂细胞(non-dividing cell),科学家们首先必须让它们表现得像能够分裂的细胞。为此,他们激活一种保护DNA的被称作同源重组的细胞过程;这种重组允许人们操纵和重排细胞中的基因,同时造成的弊端还应不可能超过带来的益处。

doi:10.1038/nature16465
1999年,美国青少年杰西-基辛格(Jesse Gelsinger)死于转录基因载体而引起的强烈免疫反应,患者在临床试验后接受基因疗法后四天出现严重的炎性综合症反应。近日,刊登在国际著名杂志Nature上的一项研究论文中,来自斯坦福大学的病毒学家Jan Carette就表示基因疗法领域或许可以再次被提上日程,当前治疗许多遗传性障碍的基因疗法都在欧洲得到了批准,而且在美国对抗先天性失明的基因疗法也已经接近批准的阶段。
很多科学家关注此项领域不足为奇,而且越来越多的方法也都将遗传物质直接引入人类细胞,这其中就包括了利用驯化的病毒来引入人类细胞治疗相关的疾病;如果有一种病毒非常善于此项任务,即适合感染细胞,那么病毒或许就会使用它们的伎俩将基病毒自身的基因转移到细胞的DNA中,从而拦截细胞的复制机器,使得细胞产生众多病毒的拷贝。
DOI:10.1007/s13566-015-0239-y
来自美国休斯顿卫理公会医院的研究人员进行了一项长期临床研究,研究结果表明放射治疗结合"自杀基因治疗"技术可以为前列腺癌病人提供安全有效的治疗。"自杀式基因治疗"技术通过对前列腺癌细胞进行基因修饰使得癌细胞向病人免疫系统发送信号实现"自杀"过程。相关研究结果发表在国际学术期刊Journal of Radiation Oncology上。
共有66名前列腺癌病人参与了1999年到2003年间的II期临床研究,研究人员将参与者分为两组,其中一组病人的肿瘤细胞只存在于前列腺组织,研究人员将该组命名为Arm A,这些病人只接受放射治疗,而另外一组病人携带更具侵袭性的前列腺癌细胞,研究人员将该组命名为Arm B,这组病人要同时接受放射治疗和激素治疗。Arm A组内的病人在研究过程中接受了两次试验性基因治疗,而Arm B组的病人接受了三次基因治疗。

近日,英国研究者采用一种基因疗法,成功治愈了一个患有耐药性白血病的一岁女孩,成为免疫细胞疗法治愈“不可治愈”的癌症的全球首个案例。
该患儿名为Layla Richards,在位于伦敦中心的大奥蒙德街医院(Great Ormond Street Hospital)接受治疗,该医院在治疗白血病和其他癌症方面有领先优势。经过几个月的隔离治疗以后,Layla已经摆脱癌症,在家里恢复得不错。医生认为她的治疗结果是“简直就是一个奇迹”,专家也表示这代表人类在治疗白血病方面向前迈进了一大步。
Layla被诊断出癌症时只有14周。就在断奶不久之后,她出现了心跳加快的症状。血液检测证实Layla患有急性淋巴细胞白血病中较有侵略性的一种,这是儿童白血病最常见的形式。
doi:10.1016/j.celrep.2015.07.019
机体免疫系统可以保护机体免受侵袭,但有时候其会排斥解救患者的输血或器官移植,研究者常用的一种方法就是利用病毒作为载体来运输基因疗法进入体内治疗疾病,而近日一项刊登在国际杂志Cell Reports上的研究论文中,来自国外的研究人员就开发了一种新型的基因疗法。
腺病毒伴随病毒(AAVs)被认为可以在临床中作为基因疗法的运输载体来帮助评估血友病及遗传性失明的治疗效果,但目前问题是30%至90%的个体一旦暴露于没有致病性的病毒后,个体机体的免疫系统就会对AAVs产生免疫反应,因此腺病毒伴随病毒往往不能够被选择进行基于AAV的基因疗法。

doi:10.1038/nature14546
近日,来自美国俄勒冈健康与科学大学的研究人员在著名国际学术期刊nature在线发表了一项最新研究进展,他们在利用全新的基因和干细胞疗法治疗线粒体疾病方面迈出了关键的第一步。
在美国,每年有1000~4000名新生儿患有线粒体DNA疾病,线粒体DNA突变会引起许多严重疾病的发生,其中包括糖尿病、耳聋、眼病、胃肠道疾病、心脏病、痴呆以及其他一些神经相关疾病。但到目前为止仍没有有效的方法能够对线粒体DNA相关疾病进行有效治疗。
在该项研究中,研究人员从一些携带线粒体DNA突变的儿童和成年人身上搜集了皮肤细胞,将皮肤细胞中的细胞核与健康捐赠者提供的卵细胞细胞质进行匹配,利用这种技术,研究人员获得了含有正常线粒体的胚胎干细胞。
doi:10.1126/science.1259114
为了理解转座子如何塑造基因组,揭示其靶向作用的分子机制非常关键,近日刊登在国际杂志Science上的一项研究报告中,来自巴黎第七大学(Universite Paris Diderot)等处的科学家通过研究鉴别出了两种特殊蛋白的相互作用对于转座子整合入酵母基因组的特殊区域非常关键,该研究强调了转座子作为移动的DNA元件在进化中的重要性以及对于开发基因疗法的关键作用。
转座子是一种可以在基因组中移动的DNA序列,其可以代表基因组中很大一部分关键序列,同时也在进化中扮演着重要角色;通过整合入DNA,转座子就可以促进基因组的可塑性以及产生新的细胞功能,反之其同时也会引发危机细胞生存的突变,转座子的整合作用通常发生于特殊的基因贫瘠区域,这对机体的伤害是最小的,促使转座子进行靶向整合的分子机制目前尚不清楚。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言