Nature Methods:从胚胎发育到疾病解析:FlowSig引领细胞间信号流动研究新方向
2024-08-30 生物探索 生物探索 发表于上海
介绍 FlowSig 方法从单细胞和空间转录组数据推断细胞间通信流,通过多应用验证其性能及潜力,为理解生物过程提供新工具。
引言
细胞间通信是维持生物体内稳态以及实现复杂生物过程的核心机制之一。细胞通过分泌和接收化学信号,与周围的细胞进行交流,从而协调发育、免疫反应、组织修复等关键生理过程。近年来,单细胞RNA测序(single-cell RNA sequencing, scRNA-seq)和空间转录组学(spatial transcriptomics, ST)技术的发展,为研究者提供了在单细胞水平上解析细胞间通信的前所未有的机会。这些技术能够同时检测成千上万个基因的表达,生成具有高维度的基因表达模式,从中提取与疾病状态、空间位置和时间轴相关的特定基因模块。然而,如何有效整合这些高维度数据,并在此基础上推断出驱动生物过程的细胞间通信流,仍然是一个重大的挑战。
在这个背景下,8月26日Nature Methods的研究报道“Inferring pattern-driving intercellular flows from single-cell and spatial transcriptomics”,提出了FlowSig这一新方法,用于从scRNA-seq和ST数据中推断由细胞间通信驱动的信息流。FlowSig基于图形因果建模和条件独立性测试,通过构建和学习部分定向无环图(completed partial directed acyclic graph, CPDAG),揭示了细胞间通信的方向性依赖关系。不同于传统的基因表达模块(gene expression modules, GEMs)构建方法,FlowSig能够同时考虑细胞间信号(ligand-receptor interactions)和细胞内调控机制,从而准确捕捉细胞间流动的时空动态。
该方法的开发旨在填补现有工具的空白,并提供更为全面的分析框架。通过在多种实验数据上的验证,如胰岛细胞受刺激后、COVID-19不同严重程度下的细胞间流动以及小鼠胚胎发育过程中形态发生素驱动的模式,FlowSig展现出了优异的性能。研究者通过这些应用,展示了FlowSig在捕捉复杂生物过程中的关键细胞间通信流方面的潜力,为进一步理解健康和疾病状态下的生物过程提供了重要的工具和视角。
在未来,随着单细胞和空间转录组数据的积累,FlowSig有望成为推动因果推断和因果结构学习的关键方法之一,并在生命科学研究中发挥更大的作用。

细胞间通信对于组织内的协调和功能维持至关重要。通过分泌和接收信号分子,细胞能够调控彼此的行为,参与到包括发育、免疫响应、再生等多种生物过程中。随着单细胞RNA测序(scRNA-seq)和空间转录组学(ST)技术的迅猛发展,研究者们可以在单细胞水平上获得成千上万个基因的表达数据。然而,由于这些数据的复杂性和高维度特征,直接从中推断出驱动生物过程的细胞间通信流动仍然具有很大挑战。因此,开发能够有效分析这些数据并揭示细胞间通信流的方法成为当下的研究热点。
FlowSig应运而生,它能够通过图形因果建模和条件独立性测试,从scRNA-seq和ST数据中推断细胞间的通信流动。FlowSig的设计旨在揭示这些复杂数据背后的因果关系,并为理解生物过程提供新的视角。
为了验证FlowSig的有效性,研究者们首先在合成数据上进行了模拟测试。合成数据基于已知的生物学网络模型,这些模型模拟了不同类型的细胞间信号流动,如单向信号传导、竞争性信号通路、以及复杂的多细胞类型之间的信号互动。
在一个典型的验证场景中,研究者们模拟了由SHH信号驱动的单向细胞间流动,该信号通过PTCH1受体结合,进而激活下游的FOXF1转录因子,最终引发BMP4信号的输出。通过FlowSig的分析,研究者们能够准确识别出这五个关键节点(SHH配体、PTCH1受体、SHH信号流入、FOXF1转录因子、BMP4配体)之间的因果关系,并且验证了使用FlowSig模型的假设条件(如受体配体结合的信号流入)有助于提高假阳性率(False Positive Rate, FPR)的控制。
研究者们还进一步比较了有无干扰数据的两种情况。结果显示,当引入干扰数据时(例如系统在受到外界刺激或疾病条件下的数据),FlowSig的分析结果更加准确,尤其是在多方向信号流动的复杂模型中,FlowSig通过引入干扰条件,有效减少了假阳性发现,从而提高了信号流动推断的精确度。
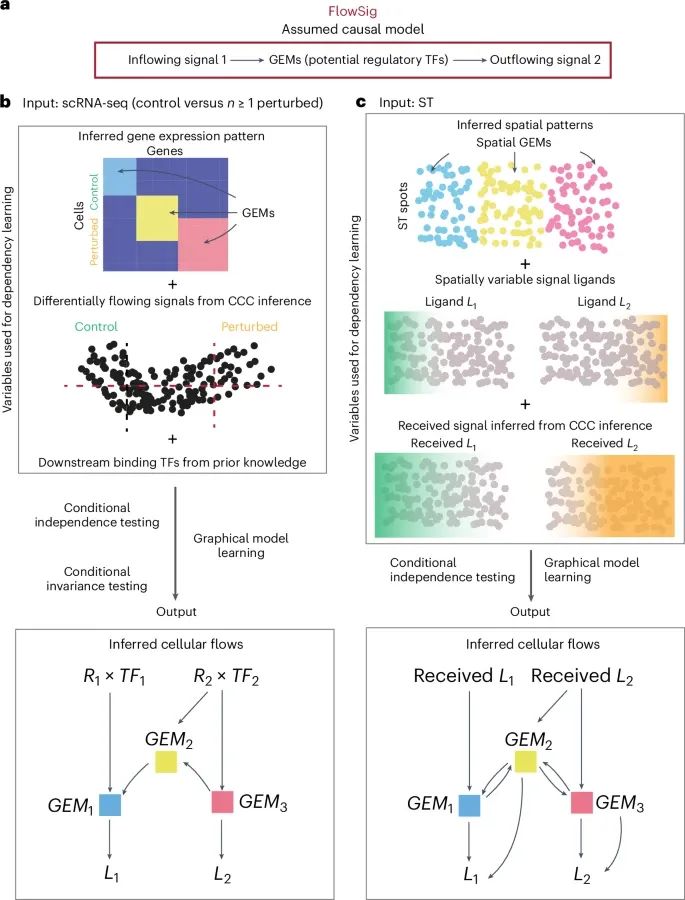
FlowSig模型的工作原理及其在推断细胞间通信流动中的应用(Credit: Nature Methods)
细胞间流动模型的构建: 图a描述了FlowSig模型如何将细胞间信号的流入与细胞内的基因表达模块(GEMs)以及信号的流出联系起来。FlowSig输出了一个细胞间流动网络,其中方向性边从流入信号变量(如受体基因表达与下游转录因子基因集的平均表达的乘积)指向GEMs(捕捉细胞内调控响应的潜在GEM因子),再从GEMs指向流出信号变量(如信号配体基因表达)。
使用干扰数据和路径知识的精确流动推断: 图b展示了FlowSig如何通过引入干扰数据(例如外部刺激、疾病状态等)以及利用已知的下游转录因子靶点信息,来学习由细胞间通信引发的精确细胞间流动。这些信息可以帮助FlowSig更准确地推断出细胞间信号的传递路径。
从空间转录组学数据推断流动模式: 图c则展示了如何通过空间转录组学(ST)数据来更精确地推断每个空间位置接收到的流入信号量,从而推断细胞间流动网络。该方法无需额外的干扰数据,即可通过空间分辨的GEMs推断出信号的流入和流出路径。
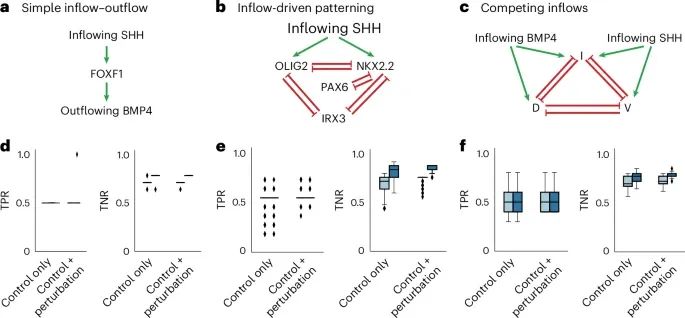
通过合成数据验证了FlowSig模型在不同信号流动场景中的有效性(Credit: Nature Methods)
不同场景下的因果图模型验证: 图a-c展示了三个不同的合成场景下的因果图模型。在第一个场景中(图a),研究者模拟了由SHH信号驱动的单向细胞间流动,这导致了BMP4信号的输出。在第二个场景中(图b),研究者模拟了SHH信号驱动的组织模式化(patterning),包括多个转录因子的表达变化。在第三个场景中(图c),研究者模拟了SHH和BMP4信号之间的竞争性驱动,导致了背腹(dorsoventral)模式化的形成。
真阳性率(TPR)和真阴性率(TNR)的比较: 图d-f展示了FlowSig在上述三种场景下的真阳性率(True Positive Rate, TPR)和真阴性率(True Negative Rate, TNR)表现。结果表明,当使用结合的受体表达(bound receptor expression)作为信号流入变量时,FlowSig的TNR显著提高,特别是在复杂的多向信号流动场景中(如图e和f)。此外,当引入干扰数据(perturbation data)时,FlowSig的TNR值的变化范围减小,表示流动推断的准确性提高。
FlowSig模型假设的验证: 图的结果还验证了FlowSig的两个核心假设。首先,准确测量信号流入对于推断细胞间流动至关重要;其次,引入干扰数据可以显著提高流动推断的准确性。通过在不同场景下的模拟实验,FlowSig证明了其在减少假阳性发现方面的优越性,并通过条件独立性测试和生物学流动模型的约束条件,优化了因果图的推断。
在验证了合成数据之后,研究者们将FlowSig应用于多个实际的生物数据集,以评估其在真实生物系统中的表现。
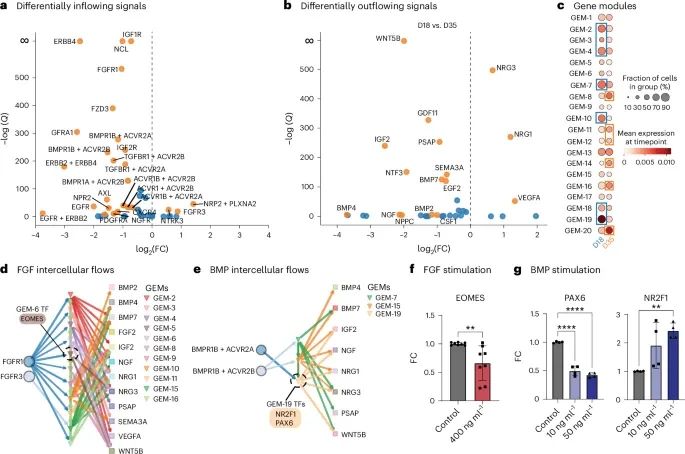
通过实验验证展示了FlowSig在皮层类器官模型中对细胞间通信流动的推断能力(Credit: Nature Methods)
差异性流入和流出信号的识别: 图a和b展示了在D18和D35两个时间点之间,FlowSig识别出的差异性流入和流出信号。研究发现,在这两个时间点之间,有26个信号表现出显著的流入变化(图a),而有16个信号表现出显著的流出变化(图b),其中包括关键的FGF和BMP信号。
基因表达模块(GEMs)的构建: 图c展示了通过pyLIGER构建的20个基因表达模块(GEMs),这些模块捕捉了特定时间点的基因表达模式。研究发现,D18时间点的细胞在GEM-2、GEM-3等模块中更加富集,而D35时间点的细胞则在GEM-8、GEM-11等模块中富集,这表明随着类器官的成熟,基因表达发生了显著变化。
FGF和BMP信号在细胞间流动中的作用: 图d展示了FGF信号驱动的细胞间流动。FlowSig分析发现,FGF信号通过多个GEMs驱动了BMP4、IGF-II、NGF、NRG1等信号的流出,并且推测EOMES可能是FGF信号下游的关键调控转录因子。图e则展示了BMP信号通过更少的GEMs进行细胞间调控,并可能通过PAX6或NR2F1进行介导。
实验验证: 图f和g展示了通过RT-qPCR FGF和BMP信号的实验验证结果。研究发现,激活FGF信号显著下调了EOMES的表达(图f),而BMP信号的激活则同时下调了PAX6的表达并上调了NR2F1的表达(图g)。这些结果与FlowSig的预测相符,验证了FlowSig在捕捉类器官系统中主导细胞间流动方面的准确性。
胰岛细胞受干扰素γ刺激实验
在这个实验中,研究者们利用FlowSig分析了人类胰岛细胞在干扰素γ(IFN-γ)刺激下的单细胞RNA测序数据。通过分析,FlowSig识别出了多个显著变化的信号通路。例如,FGF(成纤维细胞生长因子)信号通路的流入在IFN-γ刺激后显著增加,驱动了下游多种基因模块的表达变化。此外,FlowSig还揭示了IL-6、MDK、SST等信号通路在受刺激后的变化,并展示了这些信号通路如何通过不同的基因模块调控胰岛细胞的功能。
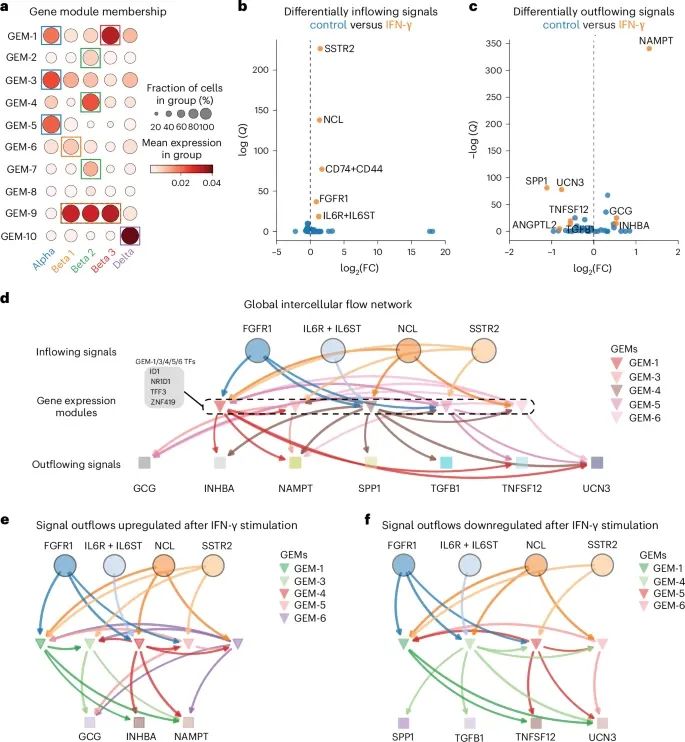
FlowSig如何通过分析非空间scRNA-seq数据,揭示胰岛细胞在IFN-γ刺激下的复杂细胞间通信流动,特别是识别出不同信号通路在细胞间流动中的作用和特定条件下的调控机制(Credit: Nature Methods)
基因表达模块(GEMs)的构建和细胞类型的对齐: 图a展示了FlowSig构建的基因表达模块(GEMs)与通过聚类分析识别出的胰岛细胞类型之间的对齐情况。研究显示,不同的GEMs与不同的细胞类型紧密关联,例如GEM-1、GEM-3、GEM-5和GEM-6在α细胞和β细胞簇中表现出显著富集。
IFN-γ刺激下的差异性信号流入和流出: 图b和c分别展示了干扰素γ(IFN-γ)刺激后显著改变的信号流入和流出。研究发现,IFN-γ刺激增加了多个信号通路的流入,包括FGF信号(通过FGFR1受体)、IL-6信号、MIF信号、MDK信号和SST信号。同时,IFN-γ刺激还导致了一些信号的流出增加,如GCG、INHBA和NAMPT,而其他信号如ANGPTL2、SPP1、TGFβ1等的流出则减少。
细胞间全局流动网络的推断: 图d展示了FlowSig推断出的全局细胞间流动网络,捕捉到了在不同条件下共享的和特定条件下的细胞间流动。结果表明,FGF、IL-6、MDK和SST是主导细胞间流动的关键驱动因素,并通过多个GEMs(如GEM-1、GEM-3、GEM-5和GEM-6)调控了GCG、INHBA、NAMPT等信号的流出。
上调和下调信号流出的特定网络: 图e和f分别展示了在IFN-γ刺激下,流出信号上调和下调的细胞间流动网络。研究发现,GEM-3在IFN-γ刺激下仅存在于上调网络中,表明它在α细胞中特别活跃,驱动了GCG和NAMPT的流出。而其他GEMs则在上下调网络中均有出现,表明它们可能在不同条件下发挥双重调控作用。
COVID-19的严重程度研究
研究者们还将FlowSig应用于COVID-19患者的支气管肺泡灌洗液(BALF)细胞的单细胞RNA测序数据,比较了不同疾病严重程度下的细胞间通信流动。结果表明,随着COVID-19的严重程度增加,细胞间的通信流动变得更加复杂。例如,在重症患者中,炎症相关的趋化因子(如CCL2, CCL3, CCL8)显著上调,主要在巨噬细胞和中性粒细胞中起作用。这表明,FlowSig不仅能够识别不同疾病状态下的细胞间信号流动变化,还可以帮助理解疾病的进展机制。
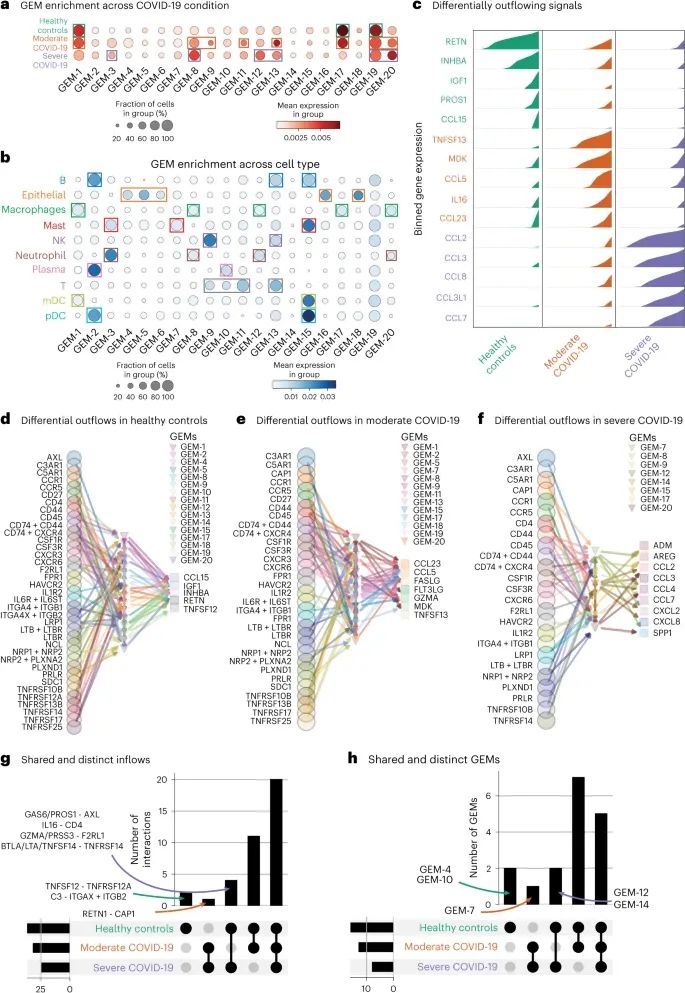
FlowSig在COVID-19研究中的应用,揭示了不同严重程度COVID-19患者之间的细胞间通信差异,特别是炎症相关趋化因子的表达和调控(Credit: Nature Methods)
基因表达模块(GEMs)的构建与COVID-19条件和细胞类型的对齐: 图a和b展示了FlowSig构建的基因表达模块(GEMs)与COVID-19不同严重程度(中度和重度)及细胞类型的对齐情况。研究显示,不同的GEMs在不同的COVID-19条件下表现出特异性,如重度COVID-19患者中某些GEMs的表达显著增强。
差异性流出信号的识别: 图c展示了在健康对照、中度COVID-19和重度COVID-19患者中差异性流出信号的分析结果。研究发现,随着COVID-19严重程度的增加,流出信号的种类和数量有所增加,特别是在重度COVID-19患者中观察到大量炎症相关的趋化因子(如CCL2, CCL3, CCL8)的上调。
健康对照组与COVID-19组之间的细胞间流动网络: 图d-f展示了健康对照、中度COVID-19和重度COVID-19患者中的细胞间流动网络。研究显示,随着COVID-19的严重程度增加,某些信号通路的细胞间流动显著增强,而另一些则减弱。例如,健康对照组中观察到的某些细胞间流动在中度和重度COVID-19患者中消失,反映了随着疾病进展,细胞间通信的复杂性和模式发生了显著变化。
信号流入和GEMs的交集分析: 图g,h分别展示了不同COVID-19条件下共享和特异性的信号流入以及介导这些流入的GEMs。结果显示,尽管COVID-19严重程度不同,多个信号流入和GEMs在各条件之间具有一定的共享性。然而,随着COVID-19的加重,一些特定的信号流入和GEMs在重度患者中变得更加显著,表明这些可能是疾病严重化的关键驱动因素。
小鼠胚胎发育的研究
在小鼠胚胎发育E9.5阶段,研究者们利用FlowSig分析了空间转录组数据,重建了Shh和Wnt5a信号蛋白之间的双向调控关系。研究发现,Shh信号通过自我放大机制驱动自身表达的同时,还通过激活Wnt5a信号来进一步调控发育过程。这种相互作用形成了类似于Turing模式的激活-抑制系统,对于理解胚胎发育中的细胞命运模式形成具有重要意义。
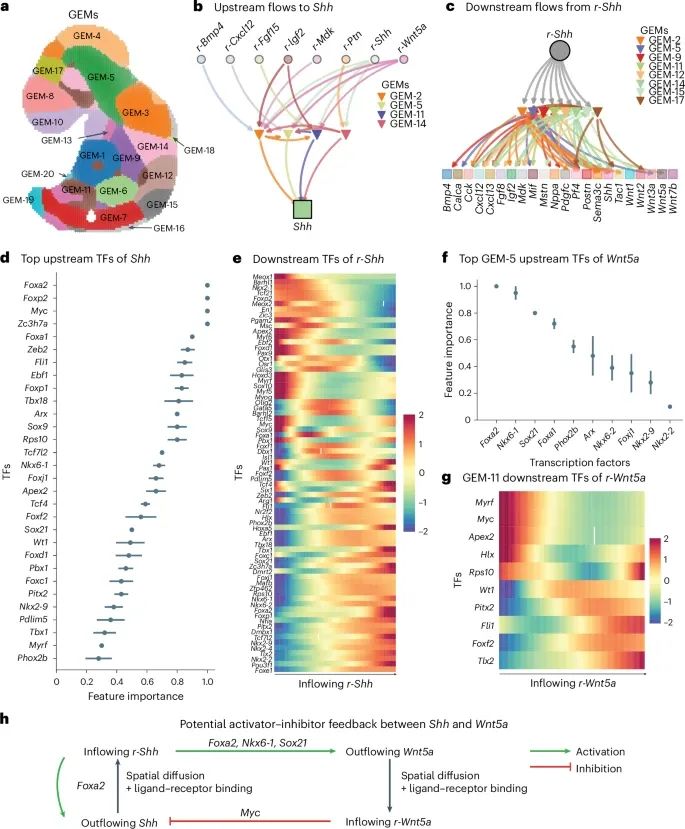
FlowSig在小鼠胚胎发育研究中的应用,特别是如何通过空间转录组数据解析信号传递的空间模式(Credit: Nature Methods)
信号流入和流出的空间分布: 图a展示了FlowSig分析出的多个信号在小鼠胚胎E9.5阶段的空间分布,特别是这些信号的流入和流出模式。研究发现,不同的信号在胚胎的不同区域表现出显著的空间特异性。例如,Shh(Sonic hedgehog)信号的流入主要集中在神经管区域,而FGF(成纤维细胞生长因子)信号的流出则在中胚层和外胚层交界处显著增强。
形态发生素驱动的激活-抑制模式: 图b展示了FlowSig重建的Shh信号驱动的激活-抑制模式。研究显示,Shh信号通过其在神经管中的高表达,激活了下游多个基因模块,并抑制了相邻区域的其他信号表达,从而形成了典型的激活-抑制模式。这种模式在胚胎发育中是非常关键的,有助于调控细胞命运和组织模式的形成。
信号传递网络的空间结构: 图c展示了FlowSig推断出的在E9.5小鼠胚胎中的信号传递网络的空间结构。这个网络展示了在不同胚胎区域之间的信号传递路径,并揭示了这些信号是如何在空间上协调来驱动胚胎的发育。例如,研究发现,Shh信号从神经管中流入,激活了下游的Wnt5a信号,并通过空间上的相互作用调控了胚胎背腹模式的形成。
关键信号的空间调控和基因模块的关系: 图d和e展示了Shh和Wnt5a信号在空间调控中的关键作用,并且这些信号通过特定的基因模块(GEMs)来执行其调控功能。例如,Shh信号主要通过GEM-2来调控神经管中基因的表达,而Wnt5a信号则通过GEM-5来调控中胚层中基因的表达。研究表明,这些信号和基因模块之间的空间关联对于胚胎的正常发育至关重要。
通过这些实际应用的分析,FlowSig展示了其在细胞间通信流动推断中的广泛应用潜力。首先,FlowSig在多个真实生物数据集中的表现证明了它可以有效地捕捉复杂生物系统中的关键信号流动。此外,FlowSig提供的因果推断方法为理解生物过程中的因果关系提供了新的工具。例如,在COVID-19研究中,FlowSig不仅揭示了不同严重程度患者之间的差异,还帮助识别了潜在的治疗靶点,如与炎症反应密切相关的趋化因子和受体。
在胚胎发育研究中,FlowSig揭示了Shh和Wnt5a之间的相互作用,提供了一个新的视角来理解这些信号通路在发育过程中的调控机制。通过结合空间转录组数据,FlowSig还展示了其在推断发育过程中时空信号流动方面的独特优势。
FlowSig的开发为生物学家提供了一个强大的工具,可以从复杂的单细胞和空间转录组数据中提取有价值的信息。未来,随着单细胞测序技术和空间组学技术的不断发展,FlowSig有望在更多的生物学研究中发挥重要作用,例如在肿瘤生物学、神经科学和再生医学中揭示关键的细胞间通信流动。此外,FlowSig的因果推断能力还可以进一步推动个性化医学的发展,帮助开发新的诊断和治疗策略。
总之,FlowSig为研究细胞间通信提供了一个全面而强大的分析框架,其广泛的应用潜力将推动我们对生命科学中复杂生物过程的理解。
参考文献
Almet AA, Tsai YC, Watanabe M, Nie Q. Inferring pattern-driving intercellular flows from single-cell and spatial transcriptomics. Nat Methods. 2024 Aug 26. doi: 10.1038/s41592-024-02380-w. Epub ahead of print. PMID: 39187683.
https://www.nature.com/articles/s41592-024-02380-w
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#空间转录组学# #FlowSig# #细胞间通信#
87