Nature Methods:单细胞研究的新突破:iFlpMosaics如何精准解码基因功能?
20小时前 生物探索 生物探索 发表于陕西省
本文介绍 iFlpMosaics 这一创新工具,阐述传统遗传马赛克技术局限,详述 iFlpMosaics 原理、优势及在单细胞、组织特异性研究等方面突破,探讨其前景与挑战,为基因功能研究提供新助力。
引言
在生命科学研究中,探究基因的功能是解码生命奥秘的核心任务之一。然而,这项工作往往面临一个关键挑战:如何精准地比较携带突变基因的细胞与正常细胞的生物学差异。在传统研究中,研究人员通常通过独立的实验对象(如不同的实验动物)进行比较,然而,这种方法不可避免地受到外部因素如环境、表观遗传改变及组织微环境差异的影响,从而降低研究结果的精确性和可信度。
为解决这一难题,遗传马赛克技术应运而生。通过在同一实验个体中同时生成突变和正常细胞,这一技术允许研究人员在相同的生物背景下比较细胞间的差异。然而,现有技术如CreERT2依赖的马赛克诱导方法,虽然应用广泛,却存在标记精确度低、假阳性和假阴性频率高的问题。此外,这些方法难以在同一组织微环境中同时标记突变和野生型细胞,限制了其在单细胞水平上的研究潜力。
为应对这些挑战,12月13日 Nature Methods的研究报道“iFlpMosaics enable the multispectral barcoding and high-throughput comparative analysis of mutant and wild-type cells”,开发了一种革命性的新工具——iFlpMosaics。该工具结合了Flp重组酶技术和多光谱荧光标记技术,通过对细胞进行精确的基因操控和标记,实现了突变细胞与野生型细胞在同一微环境中的共存和分析。与传统方法相比,iFlpMosaics不仅能够提高实验的准确性和重复性,还能实现对单细胞水平基因功能的深度解析。这一创新工具的问世,为研究基因功能及其在组织发育、稳态和疾病中的作用提供了强大的技术支持。
通过iFlpMosaics,研究人员可以利用荧光成像、流式细胞术(FACS)以及单细胞RNA测序等方法,对突变细胞与野生型细胞进行高通量比较分析。该技术的出现,不仅为理解基因突变如何影响细胞生物学奠定了基础,还为揭示复杂疾病的病因提供了全新的研究视角。

从基因突变到细胞差异:为什么遗传马赛克如此重要?
基因是生命活动的基础,而基因的突变则可能引发深远的生物学效应。然而,这种效应并不仅仅停留在突变细胞本身,而是会逐步影响整个组织甚至个体的健康状态。要精确地理解基因突变对单细胞及其周边组织的影响,研究人员需要在同一生物背景下对比突变细胞和正常细胞的差异。这时,遗传马赛克(Genetic Mosaicism)技术成为关键工具。
遗传马赛克的独特之处在于,它可以在同一组织中创造出既包含突变细胞又包含野生型细胞的“混合体”,使研究者能够在相同的基因组背景和组织微环境下比较细胞间的行为差异。这种方法不仅避免了实验动物间基因型和环境差异的干扰,还提供了更精确的分析平台。传统技术如CreERT2依赖的遗传马赛克方法,尽管广泛应用,却因标记不精确而常产生高频的假阳性和假阴性结果,限制了其应用价值。
更重要的是,遗传马赛克技术为研究细胞自主性(cell-autonomous)功能提供了一个不可替代的平台。当突变和野生型细胞共存于同一微环境中时,研究者可以直接观察到突变如何改变细胞行为,以及这些变化如何反过来影响组织的整体生物学功能。例如,突变细胞可能会通过分泌信号分子改变邻近野生型细胞的行为,从而导致复杂的表型变化。这一现象被称为“非细胞自主效应”(non-cell-autonomous effect),是理解疾病发生和发展的关键。
遗传马赛克技术的科学意义在于,它帮助我们超越单纯的基因功能研究,探索基因如何通过细胞间相互作用影响更广泛的生物学系统。
传统遗传马赛克技术的局限性:为何现有工具难以满足需求?
传统的遗传马赛克技术,如CreERT2依赖的系统,已经成为基因功能研究中的标配工具。然而,尽管其在实验操作上相对简便,却存在一系列技术局限性,使得研究结果的准确性和可重复性受到限制。
首先,CreERT2系统的重组效率不稳定,易受实验条件影响。该技术在诱导遗传马赛克时,会产生较高的假阳性和假阴性率。例如,不同报告基因(reporter gene)和floxed基因的重组效率可能相差悬殊,导致部分突变细胞未能被标记(假阴性),而另一些细胞因非目标重组被误标记为突变细胞(假阳性)。这些误差降低了实验对基因功能的解析能力,尤其在单细胞水平上更为显著。
其次,CreERT2系统无法同时标记突变细胞和野生型细胞,这意味着研究者难以在同一组织微环境中直接比较两种细胞的行为差异。例如,在组织发育或疾病模型中,突变细胞可能通过改变其周边野生型细胞的行为来引发复杂的非细胞自主效应。缺乏对野生型细胞的标记,使得研究者很难明确地分离基因突变的直接效应和间接效应。
此外,CreERT2诱导的马赛克多依赖于他莫昔芬(tamoxifen)的剂量和时间,而这类调控方式的可控性较差。在诱导剂量较低时,突变细胞数量往往不足以进行大规模比较;而在剂量较高时,又可能引入毒性或其他非特异性效应。更为关键的是,该方法无法在静止或非分裂细胞中有效诱导遗传马赛克,这显著限制了其应用范围。
这些技术缺陷不仅影响研究的精确性,还增加了实验的复杂性和成本。正因如此,科学界对更加高效、精确且灵活的遗传马赛克技术需求迫切。而iFlpMosaics的出现,正是为了解决这些长期存在的问题,为基因功能研究注入全新动力。
iFlpMosaics:一次多光谱的技术飞跃
作为一套基于Flp重组酶(Flp recombinase)的工具包,iFlpMosaics克服了传统CreERT2系统的多重限制,为研究基因突变如何影响单细胞及组织生物学带来了前所未有的精确性和灵活性。
技术原理:精准与多样并存
iFlpMosaics的核心在于通过Flp重组酶诱导多光谱荧光标记的遗传马赛克。这套系统包括多个全新设计的小鼠品系,如R26-iFlpMTomato-Cre/MYFP和Tg-iFlpMTomato-H2B-GFP-Cre/MYFP-H2B-Cherry-FlpO。这些基因构造允许在同一组织中标记突变细胞和野生型细胞,分别用荧光蛋白MTomato和MYFP标识。值得注意的是,这些荧光标签不仅具有多光谱分辨能力,还能通过单细胞RNA测序(scRNA-seq)或荧光活化流式细胞术(FACS)实现高通量分析。
设计亮点:突破传统技术的瓶颈
与CreERT2相比,iFlpMosaics具有以下显著优势:
多光谱标记:传统Cre系统只能标记突变细胞,而iFlpMosaics能同时标记野生型细胞,这为直接比较两者的行为提供了内部对照。
高重组精确性:研究表明,iFlpMosaics显著降低了假阳性和假阴性率,同时在突变诱导过程中实现了极高的遗传可靠性。
兼容性强:该系统可与任何现有的floxed基因兼容,并且适用于静止细胞与分裂细胞,应用范围更广。
时间与空间的灵活控制:通过FlpO-ERT2系统,研究者能够精准控制突变诱导的时间点和特定组织。
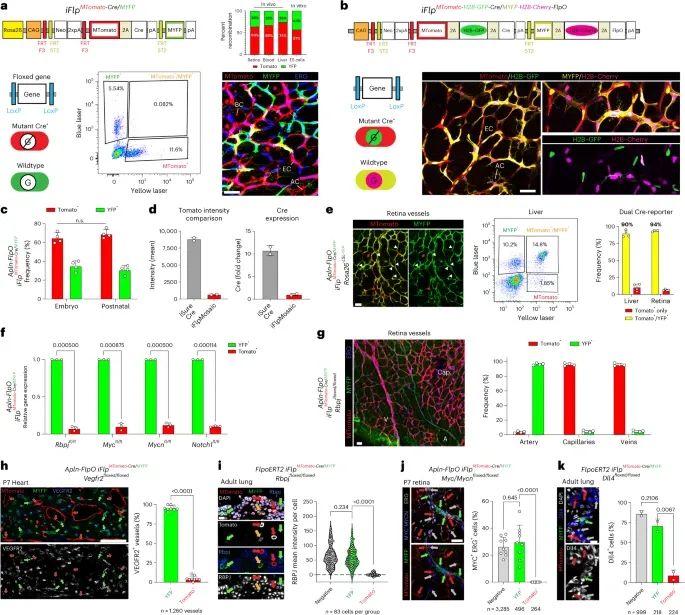
iFlpMosaics技术实现了突变细胞与野生型细胞的高效比率标记(Credit: Nature Methods)
突变与野生型细胞的标记结果(a)
通过Flp/FlpO-ERT2诱导,iFlpMosaics等位基因发生重组后会生成两种可能的细胞类型:表达MTomato和Cre的突变细胞,以及表达MYFP的野生型细胞。共聚焦显微镜图像显示,在视网膜组织中,标记的星形胶质细胞(AC)、内皮细胞(EC, ERG+核)和血细胞(BC)被清晰分辨。
多光谱标记的荧光分离能力(b)
在Tg-iFlpMTomato-H2B-GFP-Cre/MYFP-H2B-Cherry-FlpO等位基因中,突变和野生型视网膜细胞的四种荧光标记(MTomato、MYFP、H2B-GFP和H2B-Cherry)实现了全光谱分离,进一步增强了细胞分辨能力。
细胞比例分析(c)
流式细胞术(FACS)分析了MTomato+和MYFP+细胞的比例,结果表明两者的比例无显著差异(n.s.),表明该标记方法具有稳定性和准确性。
荧光强度与基因表达的相关性(d)
MTomato荧光强度与Cre表达水平进行比较,显示了MTomato+细胞的显著标记效果。
基因重组效率评估(e, f)
通过对Cre报告基因Rosa26-LSL-YFP的重组分析,显示MTomato+细胞(白色箭头)主要为突变细胞,仅有少量假阳性(红色箭头)。qRT-PCR结果进一步表明基因删除效率显著,具有统计学意义。
组织特异性的基因敲除分析(g-k)
动脉、静脉和毛细血管(g):在表达Rbpj等位基因的动脉中,MTomato-2A-Cre+细胞仅占3.5%,而在静脉和毛细血管中则高达96%。
心脏内皮细胞(h):在P7小鼠心脏中,对VEGFR2的免疫染色和基因删除分析显示了高效的基因操控。
肺上皮细胞和视网膜细胞(i, j):在肺和视网膜中分别对RBPJ、MYC和MYCN进行染色和定量,进一步验证了该技术在不同组织中的精确性。
肺上皮DLL4分析(k):对成年小鼠肺部DLL4基因的免疫染色表明,MTomato+和MYFP+细胞的分布清晰。
单细胞层面的基因解析:iFlpMosaics如何助力精确研究?
传统技术在解析单细胞基因功能时,常受限于标记精确性和细胞间比较的可行性。而iFlpMosaics技术的问世,为这一领域带来了革命性的突破。
单细胞水平的精准标记与追踪
iFlpMosaics通过多光谱荧光标记,实现了突变细胞(MTomato+)与野生型细胞(MYFP+)的精确标识。这种双标记系统能够同时追踪同一微环境中的两种细胞,使研究者可以在无干扰的条件下直接比较它们的生长、分化和基因表达模式。研究显示,iFlpMosaics结合单细胞RNA测序(scRNA-seq)技术,能够对单细胞基因表达的变化进行详细的定量分析,从而揭示基因突变的深层机制。
单细胞动态的深入解析
通过iFlpMosaics,研究者能够在不同时间点动态观察突变细胞和野生型细胞的比例变化。例如,在对肝脏细胞的研究中,该技术显示出突变细胞(MycKO)在分裂和克隆扩展方面的显著劣势,而野生型细胞在突变细胞的竞争压力下表现出更强的扩展能力。这一发现表明,基因突变不仅改变了细胞的自主行为,还可能触发复杂的细胞竞争机制。
技术优势:超越传统的单细胞分析
传统CreERT2系统常因标记不精确或重组效率低而难以在单细胞层面解析基因功能,而iFlpMosaics通过以下优势解决了这些问题:
高分辨率多光谱标记:单细胞可被赋予多达12种荧光条码,使得单细胞克隆动态研究成为可能。
更高的重组效率与低毒性:在静止和增殖细胞中均表现出高效重组,同时避免了传统系统的毒性效应。
实时动态监测:能够以细胞为单位追踪突变对细胞生长、分化甚至迁移模式的影响。
从肝脏到胰腺:组织特异性研究的新发现
不同组织中的基因功能可能因微环境和细胞类型的差异而呈现出显著的多样性。iFlpMosaics技术通过精准的多光谱标记和高通量分析,为探索这些组织特异性提供了强大的工具支持。在肝脏和胰腺的研究中,这项技术揭示了基因突变在不同器官中截然不同的生物学效应。
肝脏:克隆动态与基因竞争
该研究展示了iFlpMosaics在肝脏中的研究成果,突出了MYC基因在肝细胞克隆扩展中的重要作用。在实验中,研究者诱导了MYC基因的敲除(MycKO)并通过荧光标记同时追踪突变细胞(MTomato+)与野生型细胞(MYFP+)。结果显示,MycKO细胞的克隆扩展能力显著降低,仅能生成125%的新细胞,而野生型细胞则达到187%。此外,野生型细胞在与MycKO细胞共存时表现出更强的增殖能力,似乎是对突变细胞竞争压力的代偿性反应。这种细胞间竞争现象强调了MYC基因在维持肝脏细胞群体动态中的关键地位。
胰腺:组织特异性的增殖模式
相比肝脏,胰腺中的基因功能呈现出不同的特性。研究发现,野生型胰腺细胞的克隆扩展能力显著高于肝脏细胞,其平均克隆大小为3.60,而肝脏细胞仅为2.87。这表明胰腺细胞在早期发育阶段具有更强的增殖潜力。然而,当MYC基因被敲除后,突变细胞的扩展能力急剧下降,仅为野生型细胞的1/3。最终,突变细胞比例显著降低,揭示了胰腺细胞对MYC基因功能的高度依赖性。
跨器官的基因功能比较
通过iFlpMosaics技术,研究人员能够在不同组织中对同一基因的功能进行系统性比较。研究表明,MYC基因的突变在肝脏中主要影响细胞生存和竞争,而在胰腺中则对细胞增殖具有更直接的抑制作用。这种组织特异性的功能差异,为理解基因如何在不同器官中执行独特的生物学任务提供了关键线索。
突破现有技术的瓶颈:双胞克隆(Twin-Spot Clones)助力精准研究
传统的遗传马赛克技术虽然能区分突变细胞和野生型细胞,但难以揭示来自同一祖细胞的细胞在相同微环境下的行为差异。iFlpMosaics通过“双胞克隆”(Twin-Spot Clones)的创新设计,突破了这一技术瓶颈,为基因功能研究开辟了全新路径。
双胞克隆的设计与原理
双胞克隆方法的核心在于从同一祖细胞同时生成突变细胞和野生型细胞,这两类细胞以不同的荧光标记(如MTomato和MYFP)呈现。iFlpMosaics通过引入iDre/FlpProgenitor等新型等位基因,实现了在单个祖细胞水平上的精确遗传操作。这种设计允许研究者直接比较同一细胞系谱中突变和非突变细胞的行为,从而最大程度减少实验噪音并提高数据可信度。
细胞竞争与克隆动力学的深入解析
利用双胞克隆技术,研究者能够在同一微环境下观察突变细胞与野生型细胞的竞争行为。例如,在MYC基因的研究中,缺失MYC的突变细胞在扩展能力和存活率上显著低于野生型细胞。这一现象不仅揭示了MYC基因在细胞竞争中的关键作用,还为细胞如何感知并应对竞争压力提供了新的视角。此外,在Foxo基因的研究中,双胞克隆显示出突变细胞在心脏和视网膜中的克隆扩展显著增强,而在肝脏和肺部则影响较小,揭示了基因功能的组织特异性。
技术优势:精准性与灵活性的结合与传统CreERT2系统相比,双胞克隆技术具有以下独特优势:
精准的祖细胞追踪:能够将所有实验变量控制在同一细胞系谱中,实现真正意义上的细胞行为比较。
实时动态监测:通过多光谱荧光标记,研究者可以长时间追踪克隆扩展的动态变化。
多基因操作能力:结合iFlpMosaics,研究者可在单一实验中诱导多个基因的突变,进一步扩大技术的应用范围。
未来的无限可能:iFlpMosaics的前景与挑战
iFlpMosaics作为一项突破性的遗传马赛克技术,不仅革新了单细胞和多细胞研究的范式,还为探索基因功能及其在复杂生物过程中的作用提供了强大工具。未来,这项技术将为更广泛的生命科学领域注入新的可能性,但同时也面临着推广和应用中的诸多挑战。
潜在应用:从基础研究到精准医学
iFlpMosaics为研究基因突变如何在多层次上影响细胞行为开辟了广阔前景。在基础科学领域,该技术将帮助研究者更精准地解析基因在发育生物学、细胞分化和组织稳态中的功能。例如,通过实时监测特定基因敲除细胞与其野生型邻居的互动,研究者可以揭示更细致的非细胞自主效应,为疾病机制提供深刻洞察。
在临床应用方面,iFlpMosaics可能会成为精准医学的重要推动力量。研究表明,该技术能够揭示多基因突变的复杂交互效应,这在模拟癌症、代谢紊乱等多因子疾病时尤为重要。未来,通过与药物筛选平台的结合,iFlpMosaics有望加速潜在治疗靶点的发现,并为开发个性化治疗方案提供指导。
技术挑战:高效推广的瓶颈
尽管iFlpMosaics在技术上表现出显著优势,但其推广和应用仍面临多重挑战。首先,操作复杂性可能限制该技术在普通实验室的广泛应用。引入多光谱标记和精密遗传工具对实验条件和设备要求较高,可能会增加研究成本。
其次,数据处理能力也是一个关键瓶颈。iFlpMosaics生成的多光谱标记数据需要高效的分析算法和计算平台支持,尤其是在高通量筛选或单细胞层面研究中,这对实验室的生物信息学能力提出了更高要求。
iFlpMosaics为遗传研究提供了一个独特而强大的平台,其在揭示基因突变的复杂效应和推动精准医学发展方面展现出巨大的潜力。随着技术的不断优化和推广,我们有理由期待,这项技术将在未来的生命科学研究中占据更为重要的地位,为解码生命奥秘和改善人类健康作出不可估量的贡献。
参考文献
Garcia-Gonzalez I, Gambera S, Rocha SF, Regano A, Garcia-Ortega L, Lytvyn M, Diago-Domingo L, Sanchez-Muñoz MS, Garcia-Cabero A, Zagorac I, Luo W, De Andrés-Laguillo M, Fernández-Chacón M, Casquero-Garcia V, Lunella FF, Torroja C, Sánchez-Cabo F, Benedito R. iFlpMosaics enable the multispectral barcoding and high-throughput comparative analysis of mutant and wild-type cells. Nat Methods. 2024 Dec 13. doi: 10.1038/s41592-024-02534-w. Epub ahead of print. PMID: 39672980.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#单细胞分析# #iFlpMosaics#
6